鯉浮腫病毒人工感染錦鯉的試驗研究
徐立蒲,張 文,王小亮,曹 歡,潘 勇,王靜波,王 姝,王 澎,江育林
( 北京市水產技術推廣站,北京 100176 )
鯉浮腫病毒(Carpedemavirus,CEV)是一種痘病毒,主要感染鯉魚(Cyprinuscarpio)和錦鯉(C.carpiokoi),引起鯉浮腫病,或稱為錦鯉昏睡病[1-2]。該病能引起鯉魚和錦鯉出現較高的死亡率,病魚表現昏睡、爛鰓、凹眼等臨床癥狀。該病最早報道見于1974年的日本,之后陸續有北美和歐洲的報道[3-10]。近年來,我國北京、河北、浙江、云南等地養殖的鯉魚和錦鯉多次暴發一種急性爛鰓癥狀的疾病,死亡率高,造成重大經濟損失,已確認該病就是鯉浮腫病[11-16]。之后,全國水產技術推廣總站相繼在河南等地進行了鯉浮腫病的監測和流行病學調查[17]。調查結果表明,鯉魚(包括錦鯉)感染鯉浮腫病毒和發生鯉浮腫病的現象均較為普遍和嚴重。鑒于當前該病防控形勢嚴峻,并且目前未見國內外對鯉浮腫病的感染方式,尤其是未見魚感染鯉浮腫病毒后各組織器官內病毒量動態變化情況等方面的研究報道。基于此,在實驗室條件下,筆者比較研究3種不同感染方式下鯉浮腫病毒對錦鯉死亡率的影響,以及鯉浮腫病毒感染錦鯉后在魚體內主要組織器官中的分布狀況和病毒量動態變化情況,以期為鯉浮腫病的檢測、診斷及防控提供理論依據。
1 材料與方法
1.1 病毒來源
病毒取自2016年北京市順義區某水產養殖場的50尾確診感染鯉浮腫病毒且有典型癥狀的發病錦鯉。共取鰓和腎約50 g,混合研磨后按1∶5加入含10%血清的M199細胞培養液,-80 ℃凍存備用。使用前,將混合組織液pH調至7.5,4 ℃、4000 r/min離心15 min,取上清液。經TaqMan Real-time PCR檢測,鯉浮腫病毒含量約2.9×105個/μL。
1.2 試驗魚
錦鯉購自北京鑫淼水產公司,全長15~20 cm,體質量70~92 g。將魚分組暫養在水族箱內,控制水溫為20~22 ℃。每7 d從各個水族箱內隨機取3尾魚,取試驗魚鰓、腎、肝、脾、腦組織及器官,混合研磨后與含10%胎牛血清的M199細胞培養液按照1∶1比例混勻,凍融1次后用試劑盒抽提核酸,采用nested PCR方法進行鯉浮腫病毒檢測[18]。連續2次檢測確認,試驗魚未感染鯉浮腫病毒。
1.3 儀器和試劑
PCR儀為美國ABI Veriti型,熒光定量PCR儀為美國AB 7500型;2×Master PCR Mix購自北京百泰克生物技術有限公司,DNA抽提試劑盒為德國QIAGEN公司生產,nested PCR以及TaqMan Real-time PCR所用引物、探針等均購自生工生物工程(上海)股份有限公司。
1.4 人工攻毒試驗一
試驗共設置8個水族箱,編號為1~8號。每箱蓄水為150 L,放養13尾錦鯉。1號、2號為注射組,處理方式為腹腔注射,每尾魚注射0.2 mL的感染病魚的鰓和腎組織上清液(鯉浮腫病毒含量2.9×105個/μL);3號、4號為劃傷后浸泡組,處理方式為先用針頭劃傷錦鯉體表,再在含2.4×108個/L鯉浮腫病毒的水中浸泡1 h后放回水族箱。5號、6號水族箱為浸泡組,將體表無損傷的魚于含2.4×108個/L鯉浮腫病毒的水中浸泡1 h后放回水族箱。7號、8號水族箱為空白對照組,不感染病毒。浸泡時水溫保持在20 ℃。試驗持續20 d。期間各試驗組不投喂,充氣泵不間斷充氣,保持水中溶解氧為7~8 mg/L,水溫為20~22 ℃。每3~4 d換水1次,換水量不超過25%。每日記錄死亡情況和臨床癥狀。每尾死亡魚均制為兩份樣品,一份為鰓樣品,一份為腎、肝、脾、腦的混合樣品。此外每日自7號或8號對照箱中抽取1尾魚制樣。
所有樣品制備方法均是稱取質量0.5 g,充分勻漿后與500 μL M199細胞培養液混合。取樣后置-36 ℃凍存,至試驗全部結束后,統一用nested PCR對樣品進行檢測[18]。
1.5 人工攻毒試驗二
試驗設置8個水族箱,體積為150 L/箱,每箱放20尾錦鯉。按順序編為1~8號,分為2個試驗組,即劃傷后浸泡組和對照組。劃傷后浸泡組設6個平行箱,編號為1~6號;對照組設2個平行箱,編號為7號和8號。劃傷后浸泡組處理方式為將健康錦鯉用針頭劃傷體表,在鯉浮腫病毒含量約2.4×108個/L的30 L水中浸泡1 h后放回各水族箱。對照組處理方式為將健康錦鯉用針頭劃傷體表后直接放回水族箱。劃傷浸泡時水溫保持在20 ℃。
試驗共進行12 d。試驗期間不投喂,充氣泵不間斷充氣,保持水中溶解氧為7~8 mg/L,水溫為20~22 ℃。每日定時自1~6號箱中各箱隨機取1尾活魚(棄死魚)。每尾魚逐個器官制樣,即每尾魚均分別取全血、鰓、腦、腎、肝、脾、腸、肌肉組織制樣。鰓、腦、腎、肝、脾、腸、肌肉制備方法是稱取質量0.5 g組織,充分勻漿后與500 μL M199細胞培養液混合;全血制備方法是抽取尾靜脈血500 μL,加500 μL M199細胞培養液混合。取樣后置-36 ℃凍存,此外每日自7號、8號對照箱中各抽取1尾魚制樣。試驗全部結束后,所有樣品統一用TaqMan Real-time PCR方法檢測[8]。
1.6 nested PCR檢測鯉浮腫病毒
樣品取200 μL組織上清液,采用試劑盒抽提核酸,參考文獻[18]的nested PCR方法進行鯉浮腫病毒檢測。第一次PCR擴增的正向引物F1: 5′-GCTGTTGCAACCATTTGAGA-3′,反向引物R1:5′-TGCAGGTTGCTCCTAATCCT-3′,擴增該病毒編碼外膜蛋白的4a基因(P4a)中的548 bp片段;第二次擴增的正向引物F2:5′-GCTGCTGCACTTTTAGGAGG-3′,反向引物R2:5′-TGCAAGTTATTTCGATGCCA-3′,再從中擴增180 bp片段。
1.7 TaqMan Real-time PCR檢測和定量鯉浮腫病毒
以本實驗室制備、保存的4-1C質粒(鯉浮腫病毒 P4a基因528 bp)標準品DNA個數6.0×1010個/μL,對其進行10倍系列稀釋。取6.0×108~6.0×100個/μL的稀釋度,每個稀釋度3個平行,用于建立Real-time PCR檢測的標準曲線。
樣品取200 μL組織上清液,采用試劑盒抽提核酸,按英國環境、漁業水產養殖研究中心的TaqMan Real-time PCR方法進行鯉浮腫病毒檢測[8]。引物qF1:5′-AGTTTTGTAKATTGTAGCATTCC-3′,qR1:5′-GATTCCTCAAGGAGTTDCAGTAAA-3′,熒光探針probe1:5′-[FAM]+AGAGT TTGTTTCTTGCCATACAAACT+[BHQ]-3′。
組織的病毒載量按下式計算:
病毒載量/個·ng-1={[10(Ct值-38.73)/-3.3606×PCR反應終體積20 μL/PCR體系加入的模板量2.5 μL]×抽提DNA終體積200 μL}/抽提核酸用組織量100 mg/1000
1.8 鰓組織病理觀察
試驗對象為人工攻毒試驗一中的錦鯉。在發病死亡高峰期,取出現昏睡、凹眼、爛鰓等癥狀的瀕死錦鯉和對照組錦鯉,剪取鰓絲,按鰓絲鏡檢法檢測[19]。同時分別取鰓絲室溫保存于10%甲醛固定液中,制備病理組織切片[19],顯微鏡下觀察。
2 結果與分析
2.1 不同感染方式對錦鯉感染鯉浮腫病毒的影響
試驗共持續20 d。空白對照組的魚無死亡;而采用注射、劃傷后浸泡、浸泡3種方式感染病毒的試驗組魚均出現爛鰓、凹眼、昏睡等典型鯉浮腫病癥狀(圖1),并出現死亡(圖2)。不同感染攻毒方式的死亡率依次為劃傷后浸泡組(88%)>注射組(85%)>浸泡組(35%)(表1)。劃傷后浸泡組和注射組間的死亡率差異不顯著(P>0.05),但這兩個組均與浸泡組之間存在極顯著差異(P<0.01)。
劃傷后浸泡組試驗魚在試驗第4 d開始出現死亡情況,第5~7 d出現死亡高峰,死亡情況共持續9 d。試驗開始的4~5 d內,發病錦鯉僅有不同程度的鰓絲損傷,無其他癥狀。至第6~7 d,發病錦鯉開始出現凹眼以及昏睡癥狀;剪取魚鰓時會出現黑色血液,極快即凝固;發病錦鯉的體表、鰭條有出血癥狀。第8 d,發病錦鯉出現了全身浮腫癥狀;剖檢脾淤黑腫大,腹水嚴重。表現癥狀與報道的鯉浮腫病癥狀基本一致。
浸泡組試驗魚在第5 d開始出現死亡情況,死亡持續9 d。試驗錦鯉的發病過程和癥狀與劃傷后浸泡組基本相同,僅死亡率低于劃傷后浸泡組。
注射組試驗魚在試驗第2 d開始出現死亡情況,但第2 d和第3 d死亡數量均較少,第4 d后死亡情況與劃傷后浸泡組相近,死亡持續14 d。試驗錦鯉的發病過程和癥狀與劃傷后浸泡組基本相似。
檢測3種感染方式下死亡錦鯉的鰓樣品以及肝、腎、腦、脾混合樣品,均可擴增出鯉浮腫病毒的548 bp和180 bp特異性條帶。而對照組魚不能擴增出鯉浮腫病毒特異性條帶(圖3)。

圖1 人工感染病魚癥狀(爛鰓和凹眼)

圖2 3種不同方式感染試驗組魚的累積死亡情況各曲線上標注數字為相應時間的累積死亡魚尾數.
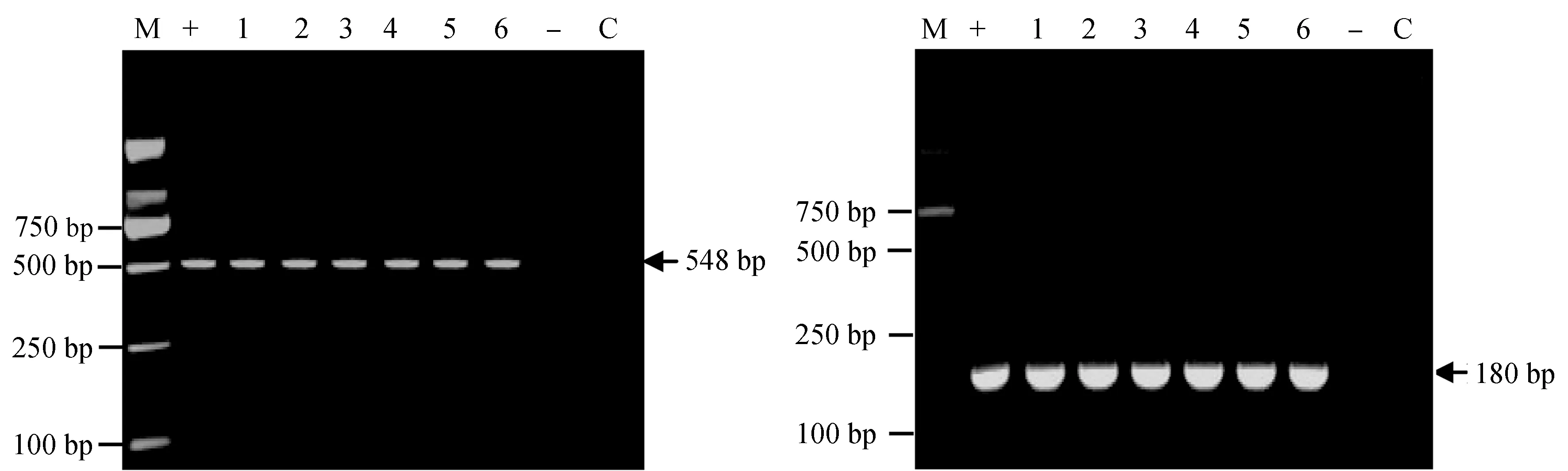
圖3 人工感染試驗第7 d死亡錦鯉的nested PCR檢測鯉浮腫病毒電泳示意a:第一輪PCR擴增結果電泳,b:第二輪PCR擴增結果電泳;+:陽性對照,-:對照組鰓、肝、腎、腦、脾的混合樣,C:空白對照;1:注射組的鰓,2:注射組的肝、腎、腦、脾的混合樣;3:劃傷后浸泡組的鰓,4:劃傷后浸泡組的肝、腎、腦、脾的混合樣;5:浸泡組的鰓,6:浸泡組的肝、腎、腦、脾的混合樣.
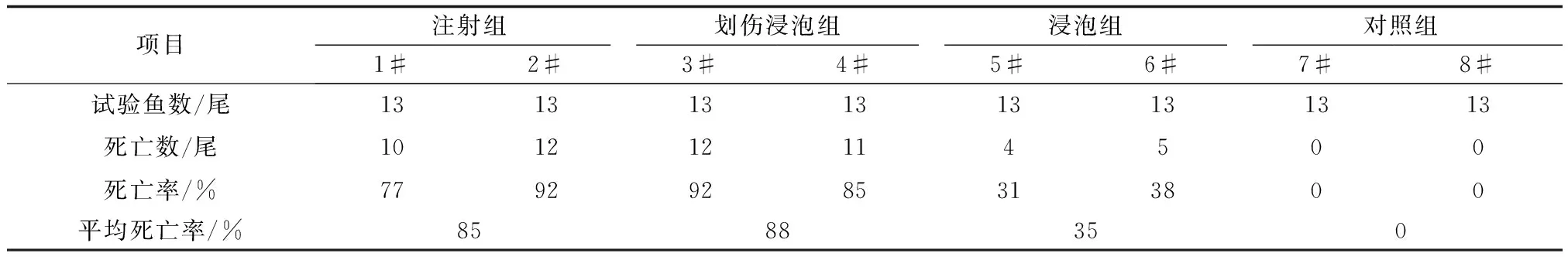
項目注射組劃傷浸泡組浸泡組對照組1#2#3#4#5#6#7#8#試驗魚數/尾1313131313131313死亡數/尾101212114500死亡率/%77929285313800平均死亡率/%8588350
2.2 劃傷后浸泡感染方式下鯉浮腫病毒在不同組織器官中的檢出情況
2.2.1 標準曲線
標準質粒4-1C梯度稀釋后,獲得Real-time PCR擴增曲線(圖4),由左至右依次為6.0×108~6×100個/μL;陰性和空白對照沒有擴增。以6.0×108~6.0×100個/μL質粒密度的對數為橫坐標,以Real-time PCR反應過程中樣品擴增達到閾值水平經歷的循環數(3個平行樣Ct值的平均數)為縱坐標制作標準曲線(圖5),標準曲線的回歸系數為0.999。質粒密度與Ct值關系:Ct=-3.3606lg(質粒密度)+38.73。
2.2.2 各組織器官中鯉浮腫病毒的動態分布情況
錦鯉采用劃傷后浸泡法人工感染鯉浮腫病毒,第1~3 d,各組織中均未檢出鯉浮腫病毒。至第4 d,在鰓組織中首先檢測到鯉浮腫病毒,病毒載量為0.4 個/ng,并且隨著時間的推移鰓組織中鯉浮腫病毒的含量呈上升趨勢,至第7 d達到峰值,病毒載量為314.8個/ng,隨后病毒載量逐日降低,至第12 d在鰓組織中檢測不到鯉浮腫病毒(表2)。在腎、肝、腦、肌肉和脾組織中也檢出了鯉浮腫病毒,但是鯉浮腫病毒在這些組織中的含量及存在時間均顯著低于鰓組織,表明鰓是鯉浮腫病毒增殖的最主要靶器官。試驗期間在血和腸組織中未檢出鯉浮腫病毒。在對照組魚的各組織中未檢出鯉浮腫病毒。
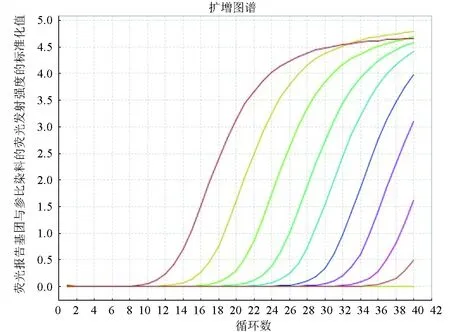
圖4 Real-time PCR檢測靈敏度試驗由左至右質粒梯度依次為6.0×108~6.0×100 個/μL.
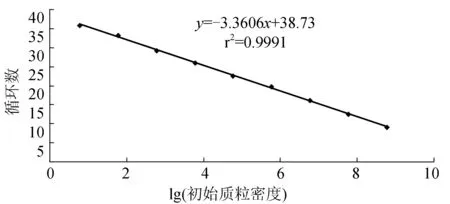
圖5 Real-time PCR擴增標準曲線以6.0×100~6.0×108個/μL梯度的標準質粒進行標準曲線擴增.
2.3 病魚鰓組織病理觀察
在劃傷后浸泡組感染發病高峰時,取鰓絲制作水浸片觀察,可見鰓絲末端細胞增生,呈腫大狀并相互黏附,有融合;末端充血嚴重,膨大成球狀(圖6)。進一步觀察病理組織切片,病魚鰓上皮組織腫脹,并有很多脫落,鰓血管充血和裸露,有血細胞大量逸出(圖7)。
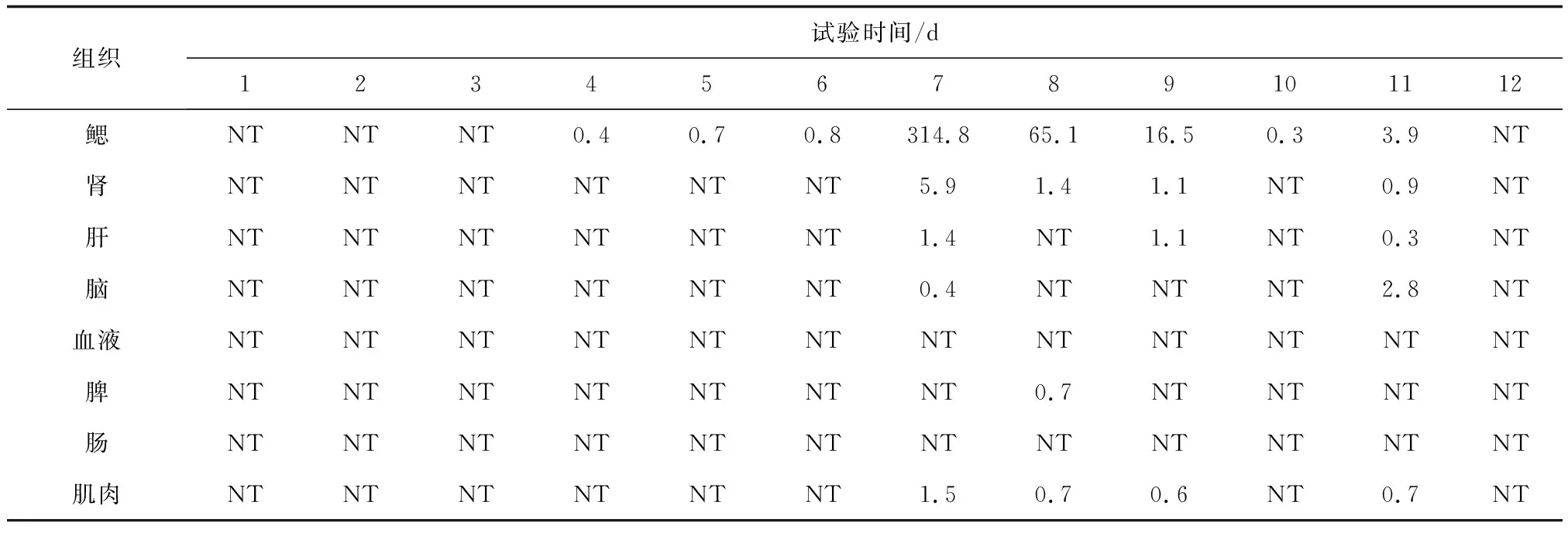
表2 錦鯉人工感染鯉浮腫病毒后不同組織中平均病毒載量 個/ng
注:NT表示未檢出.
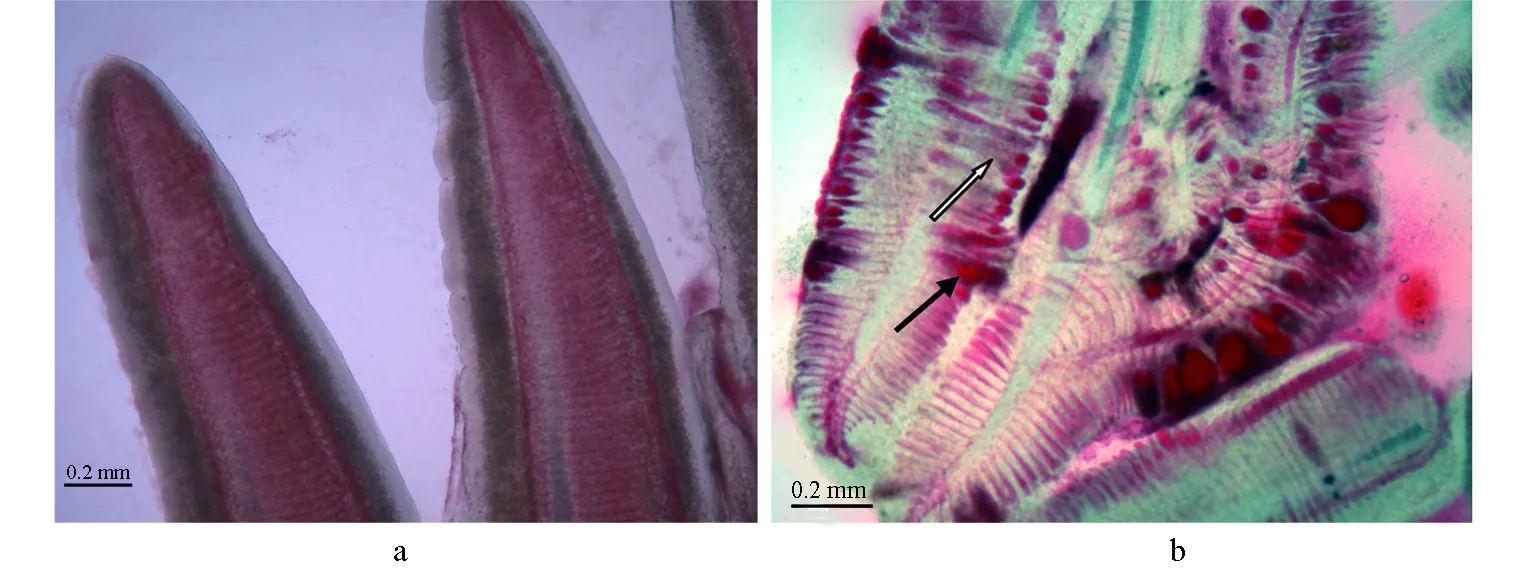
圖6 錦鯉鰓絲水浸片a:對照組錦鯉; b:劃傷后浸泡組發病錦鯉,鰓絲變粗并相互黏附(空箭頭)、末端充血膨大成球狀(實箭頭).

圖7 錦鯉鰓組織切片a.對照組錦鯉; b.劃傷后浸泡組發病錦鯉, 箭頭示鰓上皮組織脫落.
3 討 論
3.1 不同方式感染鯉浮腫病毒對錦鯉發病狀況和死亡率的影響
在注射、劃傷后浸泡、浸泡3種感染方式下,試驗魚均出現了爛鰓、凹眼、昏睡等鯉浮腫病典型癥狀[3-5],nested PCR檢測也確認試驗錦鯉的鰓樣品以及肝、腎、腦、脾混合樣品中存在鯉浮腫病毒,說明可通過人工感染方式感染鯉浮腫病毒。浸泡,特別是劃傷后浸泡可導致錦鯉較高的死亡率(88%),這也符合痘病毒在動物間的傳播途徑——主要通過皮膚的傷口感染,或由污染環境的直接或間接傳染[20]。這提示養殖魚類皮膚損傷或寄生蟲叮咬在鯉浮腫病毒感染中起到比較重要的作用。浸泡組死亡率較劃傷后浸泡組低很多,推測當錦鯉感染鯉浮腫病毒后,如果體表沒有損傷或其他應激刺激,不會導致較高的死亡率。有研究表明,在養殖過程中發生鯉浮腫病后,施用抗菌或殺蟲藥、換水等應激措施會導致鯉魚或錦鯉更高的死亡率[13,17],本試驗結果也驗證了這一點。注射組在試驗第2 d即開始出現死魚情況,但檢測結果顯示,未見病毒增殖,且第2 d死亡數量較少,第3 d后死亡情況與劃傷后浸泡組相似,前3 d試驗魚的死亡可能因注射損傷所致,非病毒感染所致。
據國內外已有報道,鯉浮腫病發病水溫范圍較廣,在7~27 ℃時均可發病[1-7,10-12]。經對我國河南等地區發生的鯉浮腫病的養殖場流行病學調查顯示,發病一般有兩個高峰,5—6月和9月,這兩個時間段養殖水溫為20~27 ℃[17]。本試驗在20~22 ℃水溫下進行,感染死亡率為35%~88%,這與調查的實際生產中鯉浮腫病發病死亡率基本一致。但20~22 ℃水溫是否為鯉浮腫病的最適發病溫度還有待進一步研究確定。
3.2 鯉浮腫病毒的主要靶器官及在不同組織內的分布和變化情況
溫智清等[14]檢測發現,云南發病錦鯉鰓和腎中鯉浮腫病毒載量為1~5 個/ng,鰓中病毒載量約為腎的6~7倍。Adamek等[21]在研究鯉浮腫病毒感染鯉魚的臨床癥狀與鯉魚鰓、皮膚組織中的病毒載量關系時,發現鰓組織的平均病毒載量(520 個/ng)顯著高于皮膚組織。本試驗采用劃傷后浸泡感染試驗進一步研究了各組織器官中鯉浮腫病毒載量動態變化情況,在鰓、腎、肝、腦、脾、肌肉組織中均能檢出鯉浮腫病毒,其中鯉浮腫病毒在鰓組織中出現最早(第4 d)、持續存在時間最長(7~8 d)、含量最高(峰值為314.8 個/ng組織)。在顯微鏡下進一步觀察鰓絲水浸片,鰓絲末端細胞增生,并有融合;觀察鰓絲組織切片,鰓絲血管中血細胞大量逸出,這些均是鰓有顯著組織病理變化的表現。這表明鰓是鯉浮腫病毒感染的最主要靶器官。推測原因為,痘病毒科種類傳播的主要方式是通過皮膚的傷口感染[20],鰓絲最易受到寄生蟲或水質影響而被破壞,且鰓絲與養殖水中鯉浮腫病毒直接接觸。鰓絲末端細胞增生的組織病理變化,會嚴重影響血液的氣體交換,導致魚缺氧,出現浮頭、反應遲緩、甚至死亡。研究結果還顯示,除鰓外,鯉浮腫病毒在腎組織內載量較低并能持續存在4~5 d;鯉浮腫病毒在肝、腦、脾、肌肉(含皮膚)組織內載量低且存在時間短。在感染的第12 d,包括鰓在內的各組織已經檢測不出鯉浮腫病毒。因此在開展鯉浮腫病監測及檢測工作時,建議主要取鰓和腎組織。
不同感染方式對錦鯉感染鯉浮腫病毒影響的試驗結果顯示,劃傷后浸泡組試驗魚第4 d開始出現死亡,第5~7 d出現死亡高峰,死亡共持續9 d。劃傷后浸泡組試驗魚各組織器官中鯉浮腫病毒的動態分布情況顯示,錦鯉感染鯉浮腫病毒后有3 d的潛伏期,然后病毒大量增殖,在第7~9 d到達高峰,隨后病毒量開始逐漸下降。上述兩個試驗結果顯示,錦鯉感染鯉浮腫病毒后的死亡情況和病毒增殖情況基本同步,這也與實際生產中發病死亡過程相似。綜上認為,在20~22 ℃,錦鯉感染鯉浮腫病毒有3~5 d的潛伏期,發病時間持續約9 d,隨后各組織中病毒含量下降直至消失,這一現象提示魚能夠產生足夠的免疫力,這也為用疫苗控制鯉浮腫病提供了可能性。關于魚感染鯉浮腫病毒后抗體產生和細胞免疫的變化情況,還有待于進一步的深入研究。建議在進行鯉浮腫病毒監測時,最好抽取正在發病的魚或尚未發病的魚作為樣本;如果取發病停止后存活的魚為樣本,則易得到假陰性檢測結果,造成漏檢。

