慢性充血性心力衰竭兔左心室三層心肌間Cx43表達的差異及其意義
吳美霞,劉亞軍,陸士娟,孫定軍,吳淼,張偉,黃康,鐘江華
慢性充血性心力衰竭(congestive heart failure,CHF)主要為老年發病,病情復雜且兇險,容易引發惡性室性心律失常(MVA),隨之出現心源性猝死(SCD)[1]。目前有調查顯示,約75%的老年CHF患者猝死與MVA有關[2]。但迄今為止,CHF易發MVA的生理機制仍未明確,因而缺乏有效的預防及控制措施。近年來有研究發現MVA的發生可能與跨室壁復極離散(TDR)有關[3]。成人心臟在解剖上由心內膜下心肌(Endo)、中層心肌(Mid)及心外膜下心肌(Epi)組成,其中Mid的復極化持續時間比另外兩層心肌明顯延長,從而造成TDR。在某些病理條件下,這種心肌橫斷面上的復極差異還會進一步擴大[4],容易誘發MVA,但其發生的蛋白分子機制并不清楚。
縫隙連接蛋白43(connexin 43,Cx43)廣泛參與左心室心肌細胞和傳導系統的各種工作,通過相鄰細胞間電、化學信號通路參與MVA的發生發展[3]。Chang等[5]在大鼠心肌梗死(MI)模型中發現Cx43表達明顯降低,且梗死邊緣區心肌細胞電傳導功能受損,說明MVA與Cx43的異質性有關。本研究通過縮窄腹主動脈建立CHF兔模型,觀察其左心室三層心肌間Cx43表達的差異,旨在探討CHF發生MVA的機制。
1 材料與方法
1.1 動物分組及模型制作 24只雄性健康新西蘭大白兔,體重(2.5±0.5)kg,由杭州余杭科聯兔業提供[合格證號:SCXK(浙)2013-0055]。將24只兔隨機分為CHF組(n=12)和假手術組(Sham組,n=12)。CHF組兔稱重后經耳緣靜脈用氨基甲酸乙酯(1.0g/kg)麻醉,腹部常規消毒,正中線切開,沿左腎動脈上方游離出腹主動脈并鈍性分離,用5F或6F導管平行于腹主動脈,4號線結扎,取出導管,使腹主動脈橫截面積狹窄約為70%[6]。Sham組開腹后不結扎腹主動脈,其余步驟同CHF組。兩組兔均在縫合切口后青霉素連續肌內注射3d以預防感染,術后連續喂養8周后進行實驗。本實驗經中南大學湘雅醫學院附屬海口醫院生物醫學倫理委員會批準。
1.2 溶液制備 ①10%過硫酸銨(AP):超純水1.0ml和過硫酸胺0.1g溶解后,于4℃保存1周;②電泳緩沖液:Tris[重均分子量(MW)121.14]3.04g、甘氨酸(MW 75.07)14.42g、十二烷基硫酸鈉(SDS)0.5g加蒸餾水至1000ml;③轉移緩沖液:甘氨酸(MW 75.07)14.42g、Tris(MW 121.14)3.04g、甲醇200ml加蒸餾水至1000ml;④TBST緩沖液:Tris(MW 121.14)1.22g、NaCl 2.92g、Tween 20 0.5ml加蒸餾水至1000ml;⑤封閉液:脫脂奶粉5g加TBST緩沖液100ml。
1.3 實驗方法
1.3.1 在體心臟超聲檢查 兔喂養8周后稱重,并通過耳靜脈用1.0g/kg氨基甲酸乙酯靜脈麻醉,取仰臥位,固定兔的四肢,采用超聲掃描儀(ATLHDI-5000型)在胸骨旁左室長軸掃描,通過心臟彩超檢查兔的左心室舒張末期內徑(LVEDD),左心室收縮末期內徑(LVESD)、室間隔厚度(IVS)、左心室后壁厚度(LVPW)和左室射血分數(LVEF)。
1.3.2 在體血流動力學檢測 分離并切開右頸總動脈,然后插入含有1%肝素的直徑約1mm心導管,緩慢推進的同時接BL-420S生物機能分析系統(成都泰盟軟件有限公司),穩定5min后,測量其外周動脈收縮壓(SBP)、舒張壓(DBP)、平均動脈壓(MAP)、左心室最大上升速度和最大下降速度(±dp/dtmax)等參數。
1.3.3 左心室三層心肌的提取 兔稱重后處死,剪取心臟,用濾紙吸干生理鹽水洗凈的心臟,分別稱量整個心臟重量(HW)和左心室重量(LVW),計算心臟重量比(HW/BW)和左心室重量比(LVW/BW)。按照相關文獻報道[7]剪取兔左心室游離壁,并用刀片分離三層心肌組織,其中Epi為心外膜面至其下2mm,Mid為心外膜面下2~7mm,Endo為心內膜面至其下2mm。將上述提取出的組織分別用Eppendorf管凍存于-80℃冰箱中備用。
1.3.4 左心室心肌HE染色及免疫組化染色 取左心室心肌組織,用4%聚合甲醛溶液沖洗,在石蠟包埋之前進行固定、脫水然后切片,厚度約為4μm,常規行HE染色。石蠟包埋的左心室不同心肌層切片用于Cx43表達的免疫組化染色檢測,脫蠟、水合和抗原修復后,在室溫下用1%BSA封閉組織45min,切片加入一抗孵育過夜,并用生物素化標記二抗1h,然后用ABC過氧化物酶和DAB(二氨基聯苯胺)孵育,蘇木素復染,并在光鏡下觀察,Cx43陽性為深棕黃色,陰性不顯色[8]。對染色結果進行半定量分析,采用Image-Pro Plus 6.0圖像分析系統,每張切片隨機選取5個高倍視野(×200)測定免疫組化圖像中的平均光密度值。
1.3.5 Western blotting檢測左心室心肌Cx43蛋白表達 將兩組兔心肌組織溶解在裂解緩沖液內,提取蛋白后用BCA試劑盒檢測蛋白質濃度。在SDS丙烯酰胺凝膠上負載30μg蛋白,轉移至PVDF膜。使用發光體化學發光法針對Cx43、GAPDH和二次抗體(辣根過氧化物酶)的特異性抗體進行檢測。將目標蛋白/參考蛋白的半定量值作為Cx43蛋白的表達水平,用Cx43-pro代表左心室三層心肌的Cx43蛋白的含量;左心室壁心肌間最大Cx43-pro與最小Cx43-pro的差值用ΔCx43-pro表示,反映跨室壁Cx43蛋白表達的差異。
1.3.6 RT-qPCR檢測左心室Cx43 mRNA的表達用Trizol試劑提取心肌總RNA,并將其反轉錄為cDNA,隨后將100ng cDNA作為模板,加入1μl正反引物,行RT-qPCR反應,每個樣品最終體積為20μl。RT-qPCR反應條件為:95℃變性1min;60℃擴增30s,95℃變性10s,隨后循環40次。熔解曲線從70℃增加到95℃,每5s增加0.5℃。qPCR擴增過程中收集熒光,反應結束后,分析、計算qPCR過程各檢測樣本熒光信號能被檢測到的循環閾值(Ct值),并計算樣本的Cx43 mRNA表達差異倍數(Cq值)用于反映Cx43 mRNA的相對表達水平[9]。左心室壁心肌最大Cx43-Cq與最小Cx43-Cq的差值用ΔCx43-Cq表示,反映跨室壁Cx43 mRNA表達的差異。
1.4 統計學處理 采用SPSS 22.0軟件進行統計分析。所有數據以表示,多組間比較采用單因素方差分析(ANOVA),進一步兩兩比較方差齊時采用SNK-q檢驗,方差不齊時采用Tamhane'sT2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 一般資料 實驗結束時CHF組兔存活9只,死亡3只,Sham組全部存活。在體血流動力學參數顯示,與Sham組比較,CHF組SBP、DBP、MAP及±dp/dtmax均明顯降低,差異有統計學意義(P<0.01,表1)。與Sham組比較,CHF組HW/BW及LVW/HW明顯增加,差異有統計學意義(P<0.05,表1)。心臟病理切片檢查結果顯示,CHF組心肌細胞體積增大、直徑增寬,細胞排列不規則、染色不均勻,間質纖維化明顯,而Sham組心肌細胞體積、直徑正常,細胞排列規則,間質無明顯纖維化,組織學表現正常(圖1)。
表1 兩組兔一般資料比較(±s)Tab.1 Basic data of the two groups of rabbits (±s)
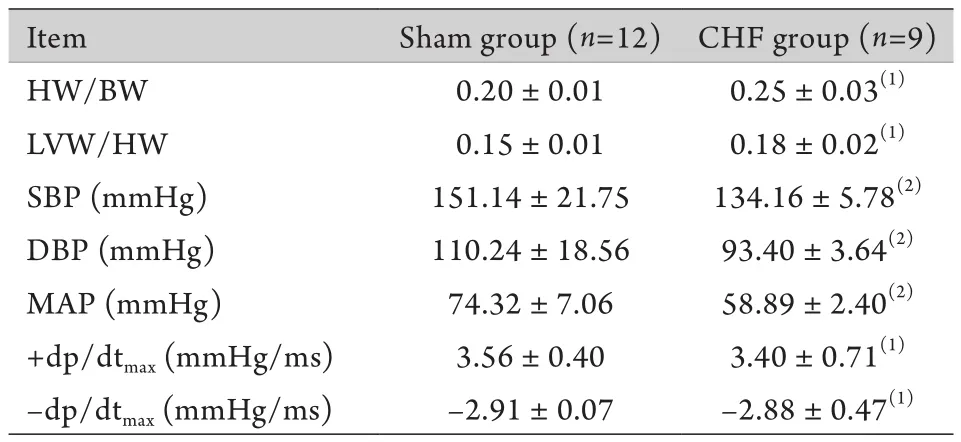
表1 兩組兔一般資料比較(±s)Tab.1 Basic data of the two groups of rabbits (±s)
(1)P<0.05, (2)P<0.01 compared with sham group
Item Sham group (n=12) CHF group (n=9)HW/BW 0.20±0.01 0.25±0.03(1)LVW/HW 0.15±0.01 0.18±0.02(1)SBP (mmHg) 151.14±21.75 134.16±5.78(2)DBP (mmHg) 110.24±18.56 93.40±3.64(2)MAP (mmHg) 74.32±7.06 58.89±2.40(2)+dp/dtmax (mmHg/ms) 3.56±0.40 3.40±0.71(1)–dp/dtmax (mmHg/ms) –2.91±0.07 –2.88±0.47(1)
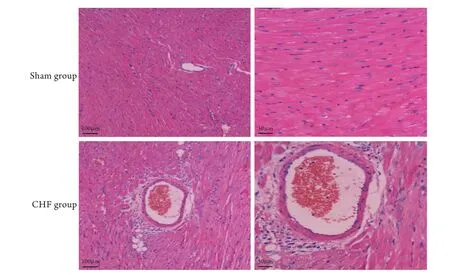
圖1 兩組兔左心室心肌病理切片觀察(HE染色)Fig.1 Pathological observation of left ventricular myocardium in the two groups of rabbits (HE staining)
2.2 超聲心動圖檢測結果 與Sham組比較,CHF組LVEF降低,LVEDD、LVESD明顯升高,差異有統計學意義(P<0.05);而IVS、LVPW比較差異無統計學意義(P>0.05,表2)。
表2 兩組兔超聲心動圖檢測結果(±s)Tab.2 Results of echocardiography in the two groups of rabbits (±s)
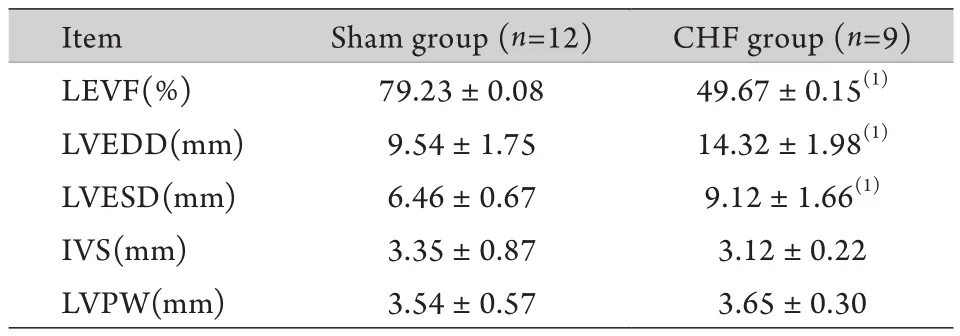
表2 兩組兔超聲心動圖檢測結果(±s)Tab.2 Results of echocardiography in the two groups of rabbits (±s)
(1)P<0.05 compared with sham group
Item Sham group (n=12) CHF group (n=9)LEVF(%) 79.23±0.08 49.67±0.15(1)LVEDD(mm) 9.54±1.75 14.32±1.98(1)LVESD(mm) 6.46±0.67 9.12±1.66(1)IVS(mm) 3.35±0.87 3.12±0.22 LVPW(mm) 3.54±0.57 3.65±0.30
2.3 左心室三層心肌Cx43蛋白的表達的Western blotting檢測結果 CHF組Epi、Mid及Endo的Cx43蛋白表達水平(分別為43.76±2.43、32.49±2.27及44.28±4.75)均明顯低于Sham組(分別為56.23±2.45、50.43±4.56、58.65±3.21),差異有統計學意義(P<0.05)。兩組組內比較,Endo的Cx43蛋白表達水平明顯高于Mid、Epi,而Epi的Cx43蛋白表達水平明顯高于Mid,差異均有統計學意義(P<0.05)。CHF組的ΔCx43-pro(15.37±2.08)明顯高于Sham組(11.19±1.48,P<0.05,圖2)。
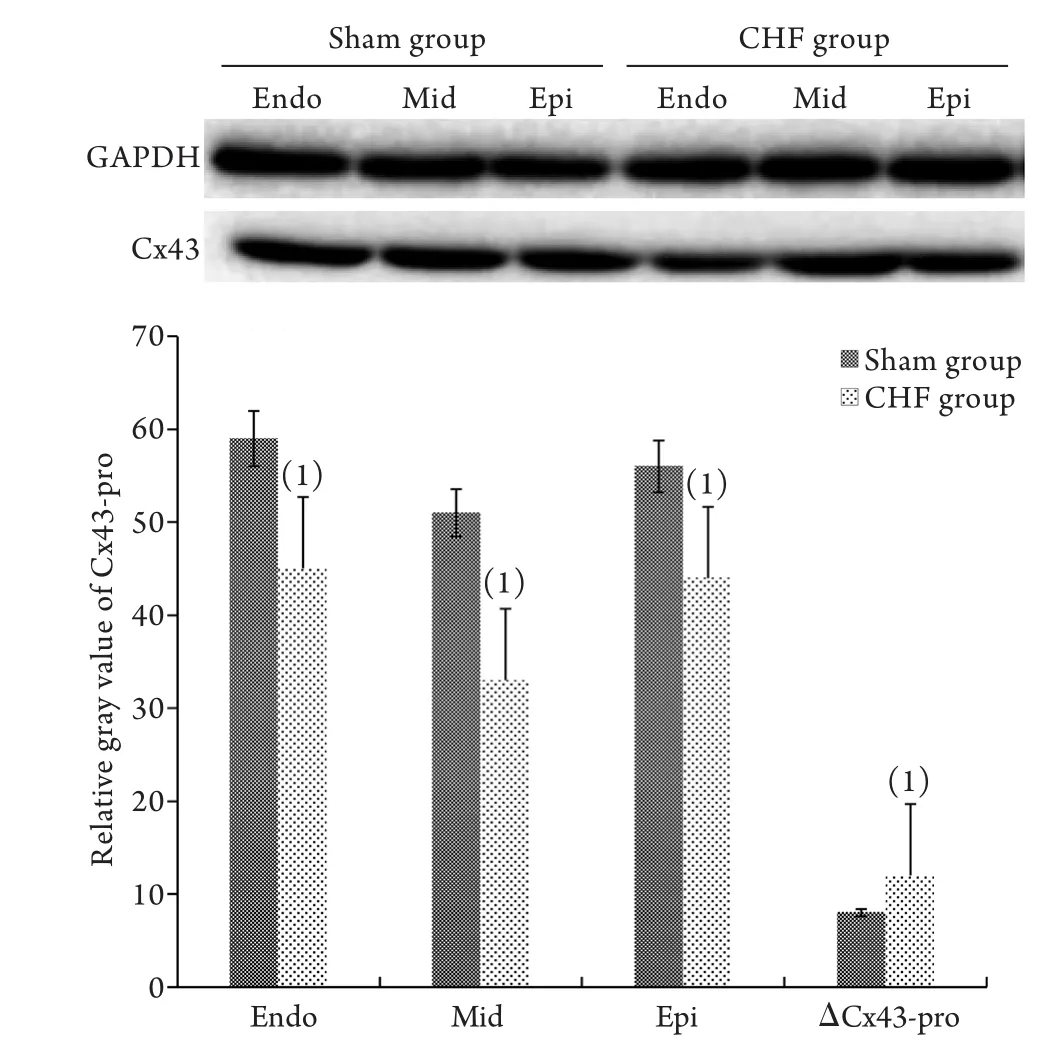
圖2 兩組兔左心室三層心肌Cx43蛋白的表達(Western blotting)Fig.2 Expression of Cx43 protein in three layers of left ventricular myocardium in the two groups of rabbits (Western blotting)
2.4 左心室三層心肌間Cx43蛋白表達的免疫組化檢測結果 CHF組Endo、Mid及Epi的Cx43蛋白表達水平(分別為2.69±0.31、2.03±0.29、2.54±0.33)明顯低于Sham組(分別為3.72±0.12、3.59±0.13、3.69±0.17),差異有統計學意義(P<0.05)。CHF組各層心肌深棕黃色顆粒較Sham組明顯減少,且三層心肌中以Mid減少最為顯著(圖3)。
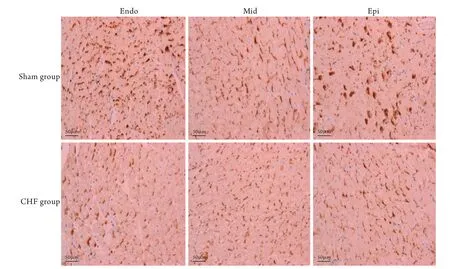
圖3 兩組兔左心室三層心肌Cx43蛋白的表達(免疫組化染色)Fig.3 Expressions of Cx43 protein in three layers of left ventricular myocardium in the two groups of rabbits (Immunohistochemical staining)
2.5 RT-PCR檢測左心室三層心肌間Cx43 mRNA的表達 CHF組Epi、Mid及Endo的Cx43 mRNA表達(Cq值分別為21.07±1.02、17.54±1.08及20.62±1.21)明顯低于Sham組(Cq值分別為23.45±0.98、22.48±1.08、24.87±1.45),差異有統計學意義(P<0.05)。兩組組內比較,Endo的Cx43 mRNA明顯高于Mid、Epi,Epi的Cx43 mRNA明顯高于Mid,差異均有統計學意義(P<0.05)。CHF組的ΔCx43-Cq(4.26±0.27)較Sham組(2.22±0.48)明顯升高,差異有統計學意義(P<0.05,圖4)。
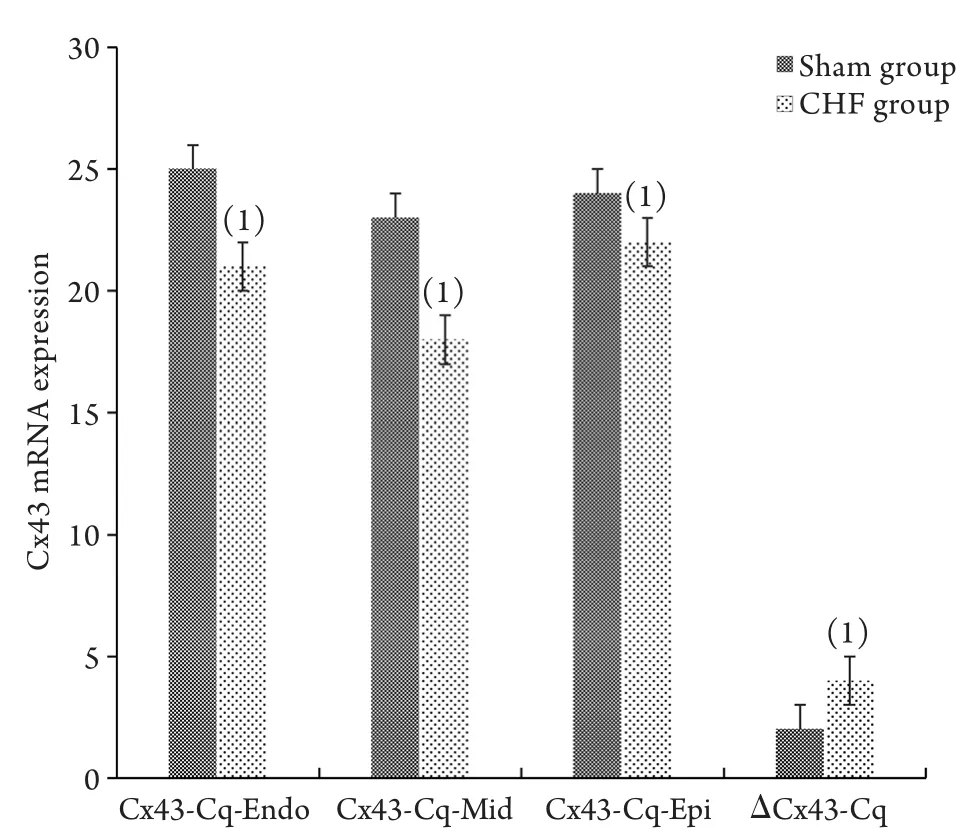
圖4 RT-PCR檢測兩組兔左心室三層心肌Cx43 mRNA表達Fig.4 Expressions of Cx43 mRNA in three layers of left ventricular myocardium in the two groups of rabbits (RT-PCR)
3 討 論
CHF是因心臟結構改變、功能和代謝紊亂引起心臟擴大、心室充盈受損及心臟射血能力下降的臨床綜合征[10-11],是各種類型心臟疾病發展的最后階段。本研究通過腹主動脈縮窄術建立兔CHF模型,CHF組兔死亡3只,模型成活率75%。術后8周CHF組的LEVF<50%,且LVEDD、LVESD增高,提示兔造模8周后心臟收縮功能及舒張功能均明顯受損。此外,通過頸動脈插管也證實,CHF組SBP、DBP及左心室±dp/dtmax明顯降低,表明CHF兔心臟泵功能明顯降低,心臟逐漸喪失代償能力。病理結果顯示,CHF組心肌細胞體積變大,直徑加寬,細胞排列混亂、染色不一,間質有明顯的纖維化現象,與CHF的病理表現相同,證明本研究成功建立了可靠的CHF動物模型。
MVA是CHF的一種常見并發癥,其死亡發生率高達50%~60%,更是CHF患者突發SCD的常見因素[12]。Cx43主要負責心肌細胞間電位的快速傳送,在電流傳導中具有重要作用[13]。研究表明,Cx43蛋白主要在心肌細胞中豐富表達,作為心室肌電流傳導的介質并維持搏動節律,是MVA發生的潛在基礎[14]。此外,有研究發現,右心室發育不良導致心律失常的患者存在Cx43蛋白的減少及分布異常,且可發生持續性心動過速[15]。進一步研究發現,在心肌肥厚小鼠中Cx43分布的空間異質性增加,出現了Cx43的去磷酸化,Cx43的去磷酸化可導致耦聯受損,引起傳導阻滯,從而增加了MVA的易患性,心電圖表現為QRS波延長[16]。本研究結果顯示,CHF組左心室三層心肌的Cx43蛋白表達均明顯低于Sham組,這可能是CHF易發MVA的重要原因之一。
近年來,國內外還有研究認為跨室壁電生理差異性是心室壁固有的心電現象[17]。而Mid具有特殊的電生理特性,這種特殊性在于:在各種離子交換產生的作用下,Mid的動作電位持續時間較Endo及Epi延長,這種差異使得心臟在不同的層面上出現復極異常,也就是TDR。本研究的Western blotting及RT-PCR檢測結果均表明,Sham組兔的Cx43在三層心肌橫斷面上存在表達差異,Mid的Cx43蛋白及mRNA表達均明顯少于Epi及Endo,由此可見,左心室三層心肌間的Cx43表達差異可能是心肌不同層面電生理異質性的蛋白基礎。
此外,左心室壁各層心肌細胞不僅復極時程不一致,對其他疾病如心肌梗死和CHF產生的復極作用也不盡相同,這些差異性會增加心肌細胞有效不應期的離散,使TDR增大,進而更加容易引起MVA[17],但是各層心肌復極化不一致的蛋白機制尚不明確。既往研究發現,小鼠心肌梗死模型中Cx43含量降低,MVA的發生率明顯增加,而增加Cx43表達后,發生MVA的敏感性減弱[18]。Wu等[19]研究發現,與對照組比較,缺血組心肌細胞活性降低,Cx43含量減少且分布出現異常,MVA發生的評分率也增加,而加入增加心肌細胞Cx43表達的藥物后,其發生MVA的機會明顯減少。以上結果均表明,器質性心臟病的心肌Cx43表達水平降低在心律失常的發生中起到了一定的作用。本研究結果還發現,CHF三層心肌Cx43蛋白表達水平下降的同時,ΔCx43-pro和ΔCx43-Cq明顯增大,Cx43在心肌各層面上的表達差異性進一步擴大,這可能使CHF的TDR增大,從而更易發生SCD。導致Cx43在各層心肌表達差異性擴大的潛在因素有很多,可能與CHF心肌細胞之間的Cx43異常表達造成神經體液調節失衡、細胞間的互相制約減弱及心電傳導推遲有關[20]。有研究發現,CHF患者血漿中血管緊張素Ⅱ(AngⅡ)含量升高,而接受血管緊張素受體阻滯劑的患者其血漿中拮抗AngⅡ的物質增多[21]。此外AngⅡ可能通過促進心臟成纖維細胞(CFs)增殖和轉化而導致心肌纖維化,降低Cx43的滲透性,從而損害心臟細胞之間化學信息的傳遞,造成了心臟電生理障礙[22-23]。
總之,Cx43異質性的擴大可能會擾亂左心室心電活動的平衡,繼而使心臟發生MVA的機會明顯增高,而具有減輕左心室各層心肌Cx43表達異常作用的藥物,將能夠減少Cx43三層心肌間復極的不一致,提高心室顫動閾值,減少MVA的發生。本研究的觀察時間跨度相對較小,而心肌重塑進而形成CHF是一個長期的漸進性病理過程,因此,今后的研究可以選擇不同的時間長度來觀察Cx43表達異質性的變化,并進一步探討這種異質性所引起的心電離子通道改變的機制。

