探討鈣敏感受體及緊密連接蛋白-14在大鼠腎草酸鈣結石形成中的作用
李朋,高存祥,王勤章,錢成,徐浩,申茂磊,郝志強,傅家豪,錢彪
(1.石河子大學醫學院第一附屬醫院泌尿外科,新疆 石河子 832000 2.解放軍69235部隊衛生所,新疆 奎屯 833200)
泌尿系結石是泌尿系統最常見的疾病之一,常發部位為腎臟,其發病原因和發病機制目前尚不明確。腎臟部位的結石主要為草酸鈣等含鈣結石[1-2],有研究表明,鈣的代謝異常是導致含鈣尿路結石形成的重要因素之一,高鈣尿引起尿液相對過飽和誘發了含鈣結石的形成[3]。鈣敏感受體(calcium-sensing receptor,CaSR)可通過上調髓袢升支粗段(thick ascending limb,TAL)緊密連接蛋白-14(Claudin-14)的表達,使腎小管TAL鈣的重吸收受到抑制,尿鈣排泄率增加,進而形成高鈣尿誘發了含鈣結石的形成[4-5]。據此推測:CaSR及Claudin-14在大鼠腎草酸鈣結石的形成過程中扮演著重要的角色。本研究對CaSR及Claudin-14在草酸鈣結石形成過程中表達水平的改變進行動態觀察,對兩者在結石形成中的作用機制進行初步探討。
1 材料與方法
1.1 材料
SPF級雄性Wistar大鼠60只,6周齡左右,體質量(210±15)g,購自新疆醫科大學實驗動物中心〔合格證號SCXK(新)2013-0001〕。多功能光學顯微鏡及圖像采集系統(BX40,日本Olympus公司),CaSR抗體(Abcam公司)、Claudin-14抗體(英國Abcam公司)。
1.2 大鼠腎結石模型的建立及實驗分組
參照孫穩等[6]的方法制作大鼠腎結石模型。適應性喂養1周后,按照隨機數字表法將60只SPF級雄性Wistar大鼠分為空白對照組與結石組,每組各30只。空白對照組給予正常飲水加每日每只2 mL灌胃兩周;結石組給予1%乙二醇飲水和2%氯化銨每日每只2 mL灌胃兩周。1~10周,每組每周處死3只大鼠,并取其雙側腎臟為標本。
1.3 腎組織HE染色
將一部分石蠟包埋后的腎組織標本制成切片,將切片固定于載玻片上,常規HE染色切片,光學顯微鏡下觀察結晶的形成情況及腎臟病理改變,并按照文獻[7]提供的腎臟結晶分級判定標準進行統計,0級判定為陰性結果,表示腎組織內未發現有結晶形成;Ⅰ-Ⅳ級判定為陽性結果,分別表示腎組織內結晶形成的程度。
1.4 免疫組織化學檢測
CaSR及Claudin-14的表達:選取成功建立模型的一部分腎組織做免疫組織化學染色。免疫組化采用SP法,石蠟包埋后切片4 μm,常規脫蠟,H2O2處理清除內源性過氧化物酶,枸緣酸緩沖液抗原修復,血清封閉。滴加CaSR抗體(1∶150) 和Clanudin-14抗體(1∶200),4 ℃孵育過夜,滴加二抗,DAB顯微鏡下控制顯色,蘇木素復染,不同濃度酒精和二甲苯脫水,樹膠封片,顯微鏡下觀察1~10周兩組Wistar雄性大鼠腎臟CaSR和Clanudin-14免疫組織化學染色情況。
2 結果
2.1 腎組織HE染色
光學顯微鏡下觀察,造模期間正常對照組大鼠腎組織冰凍切片內未見結晶沉積,無病理學改變(圖1A)。第2周起結石組部分大鼠腎臟可見腎小管上皮細胞脫落或腎間質淋巴細胞浸潤,及數量不等透明晶體,多數晶體以不規則碎片出現于腎小管中,部分見于集合管、間質及被膜下,并伴有部分腎小管擴張、上皮細胞空泡樣變性及小管上皮腫脹。第5~10周腎組織結晶量多,細胞排列紊亂,腎小管多畸形,腎小管管腔擴大或因上皮細胞腫脹而變窄,擴大腔內多有壞死脫落樣物,腎小球多有形狀不規則甚至壞死,以腎小管內為著(圖1B)。
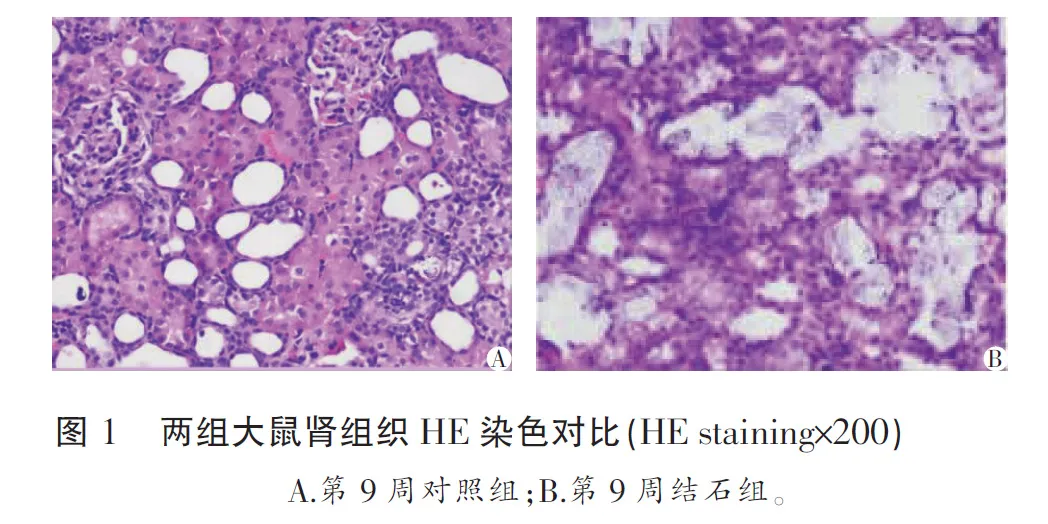
2.2 腎臟結晶形成及分級
正常對照組大鼠腎組織未見結晶。第3周起結石組大鼠腎臟切片可見明亮晶體,主要分布于遠曲小管,近曲小管及部分腎小球周圍,形態不規則,晶體多呈零星散在分布,少量晶體呈互相連接成片或成堆,結石組與正常對照組之間成石率差異具有統計學意義(P<0.05)(因結石組大鼠在第3周開始成石,而前兩周已處死的大鼠也存在成石的可能,所以在計算成石率時將兩組內前兩周已處死的大鼠排除在大鼠總計數之外)。見表1。

表1 兩組大鼠腎組織結晶分級
*P<0.05,與對照組成石率比較。
2.3 腎組織CaSR免疫組織化學檢查結果
光學顯微鏡下觀察到,第1~2周結石組與對照組大鼠腎組織均有CaSR的表達但沒有明顯差異,主要定位于腎小管上皮細胞的細胞膜上,呈棕褐色;第3~10周對照組大鼠腎組織CaSR的表達較第1~2周無明顯變化,但結石組大鼠腎組織CaSR的表達強度則逐漸增強且明顯高于對照組,鏡下可見結石組腎組織CaSR呈高度表達且彌漫分布。見圖2。
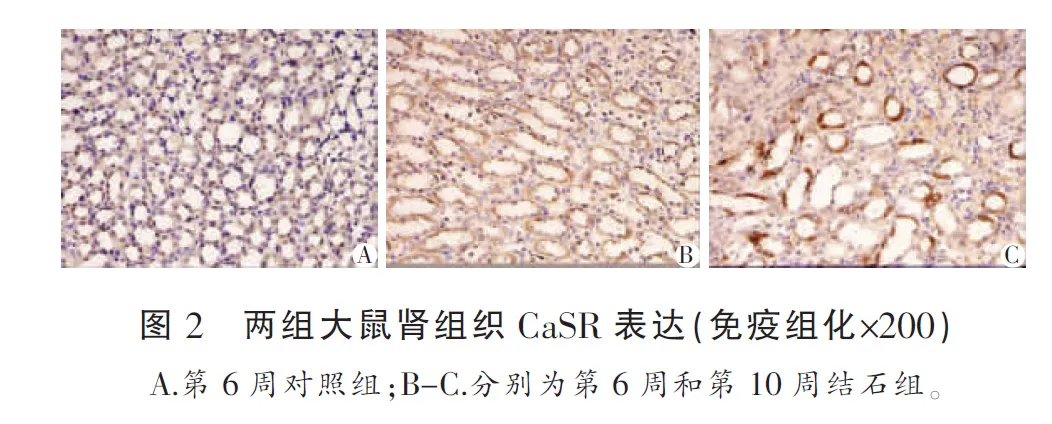
2.4 腎組織Claudin-14免疫組織化學檢查結果
1~10周在對照組大鼠腎組織中均未能檢測到有Claudin-14的表達;結石組在第1~2周也未在大鼠腎組織中發現有Claudin-14的表達,但在第3~10周則觀察到在大鼠腎小管髓袢升支粗段有Claudin-14的表達,且表達強度在持續增加。見圖3。
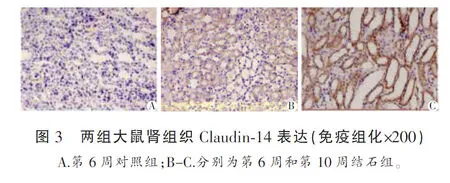
3 討論
泌尿系結石是泌尿外科最常見的疾病之一,是導致尿路梗阻和感染的主要原因。泌尿系結石的結石成分主要有草酸鈣、尿酸、磷酸鈣草酸鈣混合物、鳥糞石及胱氨酸結石,其中以草酸鈣結石等含鈣結石最為多見[8-10]。尿液中游離鈣增高是泌尿系結石形成的主要危險因素[11],高鈣尿使尿液相對過飽和從而誘發了含鈣結石的形成。有研究[6]發現,在高鈣尿性腎結石形成過程中可能存在一個CaSR-Claudin-14調控通路,其可通過促進尿鈣排泄參與泌尿系含鈣結石的形成。鈣敏感受體(CaSR)是G蛋白偶聯受體(GPCR)家族的一員,在調節全身Ca2+的動態平衡中起主要作用[12]。有研究表明,CaSR在腎臟中表達于腎小管髓袢升支粗段(TAL)[13],激活后通過改變細胞旁途徑的滲透性來降低腎小管髓袢升支粗段對鈣的重吸收。緊密連接蛋白(Claudins)是緊密連接結構的膜蛋白,其在上皮細胞中的旁細胞途徑中既起到孔隙又起阻礙作用。在腎臟中,claudins決定沿著腎小管的不同腎單位片段的滲透性和選擇性。在髓袢升支粗段,claudins對鈣的重吸收是非常重要的,并受到鈣敏感受體的嚴格調控[14]。緊密連接蛋白-14(Claudin-14)是緊密連接蛋白家族的一員,在腎臟中嚴格定位于腎小管的髓袢升支粗段(TAL)[14],可通過調節細胞旁途徑的緊密連接蛋白-16和緊密連接蛋白-19構成的陽離子通道滲透性調節腎小管對鈣的重吸收。有研究發現通過激活小鼠腎組織的CaSR,Claudin-14蛋白表達顯著增高,且尿鈣的排泄也發生了相應程度的增加[4],證實CaSR在髓袢升支粗段(TAL)主要是通過調節下游Claudin-14蛋白的表達來抑制鈣的重吸收,同時,腎臟TAL的Claudin-14的表達主要受該處CaSR的調控。由此說明泌尿系草酸鈣結石等含鈣結石的形成與腎組織中CaSR及Claudin-14蛋白的表達有著緊密的聯系。
本研究中,第1~2周HE染色結果分析發現結石組與對照組大鼠腎組織的病理改變無差異,免疫組化顯示第1~2周兩組大鼠腎組織CaSR表達水平無明顯差異且在兩組大鼠腎組織中均未有Claudin-14的表達。第3周開始HE染色可見結石組大鼠腎臟切片有明亮晶體;免疫組化觀察到第3周開始到第10周CaSR的表達程度逐漸增強且明顯高于對照組,同時開始發現有Claudin-14的表達且表達強度在逐步增加。而第3~10周對照組大鼠腎組織HE染色結果以及腎組織中CaSR的表達水平與第1~2周相比并未發生明顯改變。有研究發現Claudin-14基因在正常腎臟中不表達,通常在飲水過少或攝入鈣過多時表達[15],這與本研究結果一致:在對照組大鼠腎組織中未發現有Claudin-14的表達。
CaSR和Claudin-14表達水平的改變說明二者在大鼠腎組織含鈣結石的形成過程中起著至關重要的作用,其作用機制可能是通過激活腎組織中的CaSR,從而引起其下游Claudin-14高度表達,Claudin-14可以阻斷由Claudin-16和Claudin-19構成的細胞外陽離子通道[16],使腎小管髓袢升支粗段上皮細胞膜上離子通道的滲透性發生改變,導致該部位Ca2+的重吸收障礙[17],Ca2+的排泄增加[18],最終尿路中出現大量的Ca2+累積,大大增加了形成結石的可能性。
綜上所述,CaSR和Claudin-14的表達強度在大鼠草酸鈣結石形成過程中存在動態改變,這種動態的改變在結石形成過程中起著非常重要的作用,之后將進一步探討泌尿系含鈣結合的形成機制,為臨床治療提供有力依據。

