DPP-4抑制劑與α糖苷酶抑制劑治療2型糖尿病比較的Meta分析
高倩 章文俊 金華偉
近30年來,我國糖尿病患病率顯著增加。2010年流行病學調查顯示,我國成人糖尿病患病率為9.7%。二肽基肽酶-4(DPP-4)抑制劑(DPPIs)是一類治療 2 型糖尿病相對較新的藥物,目前上市及處于臨床研究階段的DPPIs有西格列汀、維格列汀、阿格列汀、沙格列汀、利格列汀、利拉利汀、吉格列汀、特力利汀及奧瑪格列汀[1-3]。DPPIs通過抑制DPP-4而抑制內源性胰高血糖素樣肽-1在體內失活,使內源性胰高血糖素樣肽-1水平升高[4]。DPPIs還能以葡萄糖濃度依賴方式促進胰島素分泌,抑制α細胞分泌胰高血糖素[5-6]。美國糖尿病協會(ADA)、歐洲糖尿病研究協會和中國糖尿病協會已經推薦DPPIs作為治療2型糖尿病的二線藥物[2,7]。α糖苷酶抑制劑(AGIs)通過抑制碳水化合物在小腸上段的吸收而降低餐后血糖[8]。目前上市的AGIs有阿卡波糖、伏格列波糖及米格列醇。中國指南推薦AGIs作為治療2型糖尿病的一線備選藥物及二線藥物[7]。目前研究顯示DPPIs和AGIs均能有效降低血糖,且兩者低血糖發生率均較低[9]。為了給臨床治療提供新的循證醫學證據,本研究采用系統評價和Meta分析的方法,對DPPIs與AGIs治療2型糖尿病療效和安全性進行比較,以期為臨床實踐提供決策參考。
1 資料和方法
1.1 資料來源和檢索策略 使用主題詞和自由詞檢索PubMed、EMbase、The Cochrane library、CNKI、WanFang Data和VIP數據庫,檢索時限從建庫至2017年7月,搜集DPPIs與AGIs治療2型糖尿病的相關隨機對照試驗(RCT)。同時,追溯納入文獻的參考文獻,以補充獲取相關文獻。中文檢索詞包括:二肽基肽酶-4抑制劑/西格列汀/維格列汀/阿格列汀/沙格列汀/利格列汀/利拉利汀/特力利汀、α糖苷酶抑制劑/阿卡波糖/伏格列波糖/米格列醇、2型糖尿病/糖尿病,英文檢索詞包括:Type 2 Diabetes Mellitus/NIDDM/diabetes mellitus、acarbose/voglibose/miglitol/alpha-glucosidase inhibitors、sitagliptin/vildagliptin/saxagliptin/alogliptin/linagliptin/gemigliptin/teneligliptin/DDP-4 inhibitors。
1.2 文獻納入標準和排除標準 納入標準:(1)比較DPPIs與AGIs治療2型糖尿病的隨機對照試驗;(2)各研究報道了治療的時間、治療例數、安全性和有效性相關指標;(3)治療療程≥8周。排除標準:(1)重復發表的文獻;(2)非中、英文文獻;(3)Jadad評分<3 分的文獻。干預措施:試驗組在運動飲食治療的基礎上給予DPPIs,對照組給予 AGIs。
1.3 文獻數據提取 由2位研究者獨立進行文獻篩選和資料提取,并交叉核對,如遇分歧,則討論解決或交由第3位研究者裁決,缺乏的資料盡量與原作者聯系予以補充。文獻篩選時首先閱讀文題,在排除明顯不相關的文獻后,進一步閱讀摘要和全文,以確定最終是否納入。資料提取內容主要包括:(1)納入研究的基本信息,包括研究題目、第一作者、發表雜志及時間等;(2)研究設計類型及質量評價的關鍵要素;(3)試驗組與對照組患者基本情況,包括納入例數、年齡等;(4)有效性、安全性等。
1.4 文獻質量評價 對每項原始研究的偏倚風險采用Jadad量表評價[10]:隨機化(0~2分)、雙盲(0~2分),撤退(0~1分)。總分0~5分,≥3分的研究認為是“高質量”研究,即可納入。
1.5 統計學處理 采用STATA 11.0統計軟件。計量資料采用加權均數差(WMD)及其95%CI為效應分析統計量,計數資料采用風險差異(RD)及其95%CI為效應分析統計量。納入研究結果間的異質性分析采用Q檢驗(檢驗水準設為α=0.1),并結合I2定量判斷異質性的大小。若P>0.1且I2<50%,則說明各研究結果間無統計學異質性,采用固定效應模型進行Meta分析;反之,則采用隨機效應模型進行Meta分析[11]。采用Egger法和Begg法以糖化血紅蛋白(HbA1C)作為對象檢驗發表偏倚[12]。Meta分析的檢驗水準設為α=0.05。明顯的臨床異質性進行敏感性分析。P<0.05為差異有統計學意義。
2 結果
2.1 文獻檢索結果 初檢出相關文獻1 128篇,最終納入10個RCT[13-22]。文獻篩選流程及結果見圖1。
2.2 納入研究的基本特征與偏倚風險評價 10個納入研究的發表時間為2008—2016年,樣本量為28~601例。納入研究的基本特征及偏倚風險評價結果見表1。
2.3 Meta分析結果
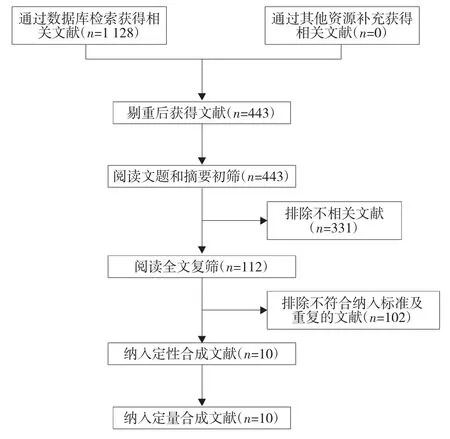
圖1 文獻篩選流程圖及結果
2.3.1 HbA1C10個RCT[13-22]報道了治療前后HbA1C水平的變化,共納入3 293例患者,其中DPPIs組1 852例,AGIs組1 441例。各研究結果間有統計學異質性(P=0.000,I2=92.8%),采用隨機效應模型分析,結果顯示DPPIs與AGIs治療均能明顯降低HbA1C,DPPIs在降低HbA1C水平方面優于AGIs,兩組差異有統計學意義(WMD=-0.33,95%CI:-0.5~-0.16,P=0.000)。
2.3.2 胰島素分泌指數(HOMA-β) 7個RCT[13-15,18-21]報道了治療前后HOMA-β水平的變化,共納入1 723例患者,其中DPPIs組861例,AGIs組862例。各研究結果間無統計學異質性(P=0.745,I2=0%),采用固定效應模型分析,結果顯示DPPIs組在降低HOMA-β水平方面優于AGIs組,兩組差異有統計學意義(WMD=7.5,95%CI:0.59~5.42,P=0.000)。
2.3.3 胰島素抵抗指數(HOMA-IR) 6個RCT[14-15,18-21]報道了治療前后HOMA-IR水平的變化,共納入1 639例患者,其中DPPIs組623例,AGIs組616例。各研究結果間無統計學異質性(P=0.121,I2=42.7%),采用固定效應模型分析,結果顯示DPPIs組在降低HOMA-IR水平方面優于AGIs組,兩組差異有統計學意義(WMD=-0.10,95%CI:-0.12~-0.08,P=0.000)。
2.3.4 體重變化 9個RCT[13-20,22]報道了治療前后體重的變化,共納入2 910例患者,其中DPPIs組1 664例,AGIs組1 249例。各研究結果間有統計學異質性(P=0.000,I2=92.5%),采用隨機效應模型分析,DPPIs降低體重療效劣于AGIs,兩組差異有統計學意義(WMD=0.67,95%CI:0.23~1.11,P=0.003)。
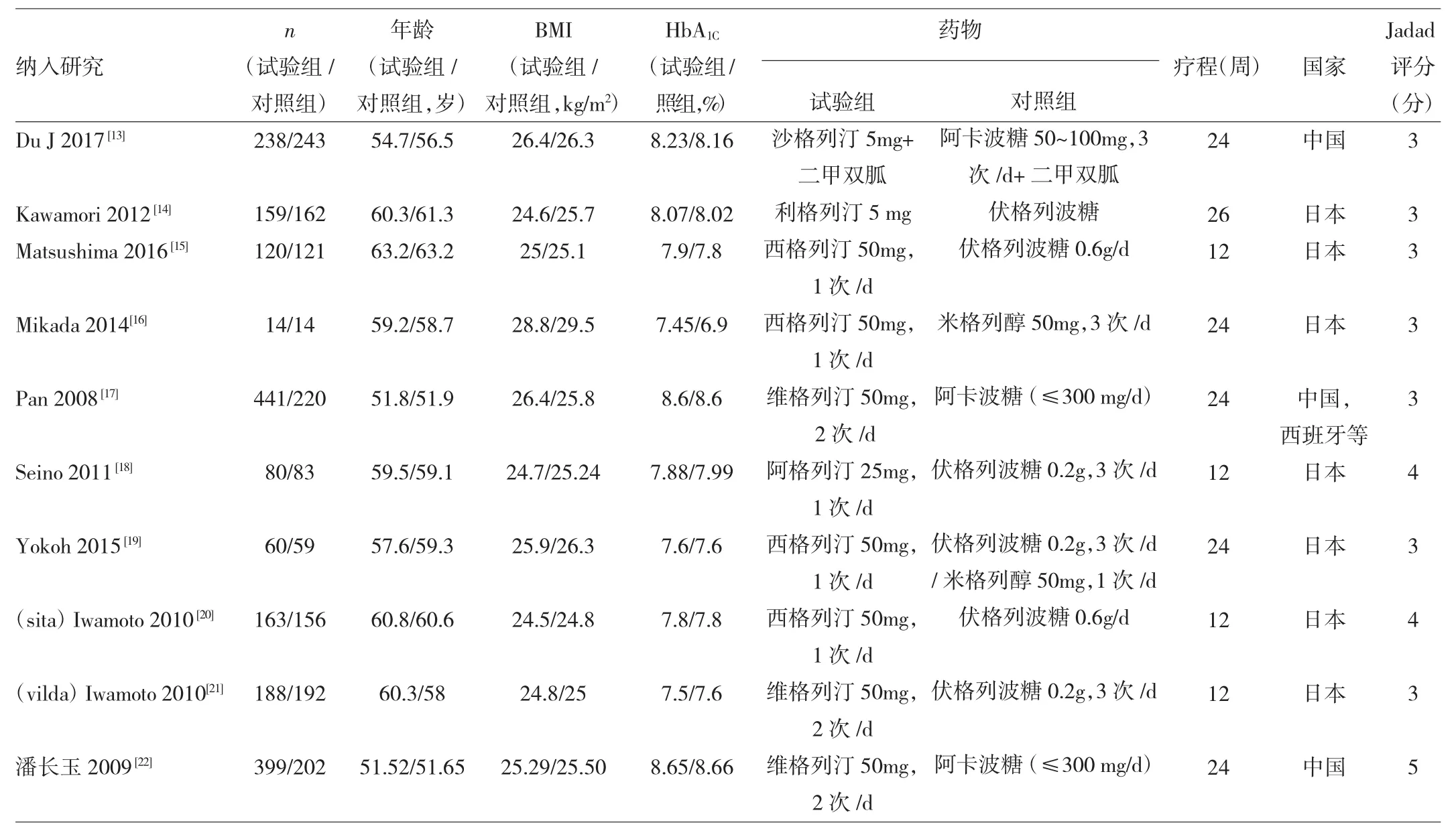
表1 納入研究的基本特征與偏倚風險評估
2.3.5 低血糖發生率 9個RCT[13-15,17-22]報道了低血糖的發生情況,共納入3 236例患者,其中DPPIs組1 827例,AGIs組1 409例。固定效應模型Meta分析結果顯示,DPPIs與AGIs低血糖發生率比較差異無統計學意義(RD=0,95%CI:-0.01~0.00,P=0.458)。
2.3.6 不良反應 Meta分析顯示DPPIs組的總體不良反應發生率(RD=-0.13,95%CI:-0.18~-0.08,P=0.000)及胃腸道不良反應發生率(RD=-0.15,95%CI:-0.18~-0.12,P=0.000)明顯低于AGIs組,但是兩組嚴重的不良反應發生率無統計學意義(RD=0,95%CI:-0.01~0.01,P=0.881)。
2.4 發表偏倚 用Egger法和Begg法對以HbA1C為指標的納入文獻的發表偏倚進行檢測,結果顯示納入研究均無發表偏倚(Egger∶P=0.653;Begg∶P=0.721)。
2.5 敏感性分析 當合并研究存在明顯異質性時,逐一剔除單個研究進行敏感性分析,以判斷單個研究對合并效應量的影響,本研究僅對HbA1C及體重變化結果進行敏感性分析,結果顯示HbA1C結論的穩定性良好。而潘長玉[22]對體重變化結論的穩定性影響較大,在剔除該研究后,隨機效應模型分析,DPPIs降低體重療效仍劣于DPPIs組,兩組差異有統計學意義(WMD=0.54,95%CI:0.18~0.90,P=0.003)。
3 討論
本系統評價結果顯示:DPPIs在降低HbA1C水平、改善HOMA-β及HOMA-IR方面均優于AGIs,而AGIs減輕體重方面優于DPPIs。此外,DPPIs與AGIs的低血糖風險及嚴重不良反應發生率均較低,但DPPIs的總體不良反應發生率及胃腸道不良反應發生率低于AGIs。
DPPIs降糖作用優于AGIs,考慮與兩者的降糖機制不同有關:DPPIs可以血糖濃度依賴性增加胰島素分泌并可抑制胰高血糖素分泌,因此,DPPIs可有效降低空腹血糖及餐后血糖。AGIs主要是通過延緩胃腸道碳水化合物的吸收而以降低餐后血糖為主,降低空腹血糖作用甚微。
一項包括52個RCT的Meta分析結果顯示:與安慰劑比較,單用DPPIs可明顯改善2型糖尿病患者的胰島功能,但是對胰島素抵抗無明顯改善[23]。目前尚無Meta分析研究AGIs對2型糖尿病患者胰島β細胞功能及胰島素抵抗的影響,但是Rudovich等[24]研究發現阿卡波糖能改善胰島功能,但不能改善胰島素抵抗。本研究顯示DPPIs在改善HOMA-β及HOMA-IR方面均優于AGIs。DPPIs改善胰島功能明顯優于AGIs,可能因為DPPIs可提高內源性腸促胰島素活性,促進葡萄糖依賴性胰島素分泌,而AGIs沒有促胰島素分泌作用;DPPIs改善胰島素抵抗方面優于AGIs,可能因為DPPIs可能有藥物增敏作用而改善胰島素抵抗,目前研究顯示DPPIs可增加胰島素介導的骨骼肌對葡萄糖的攝取及可顯著抑制肝糖輸出,從而改善肝臟胰島素抵抗[25]。
既往研究顯示DPPIs對體重改變作用為中性或增加體重[26],AGIs能減輕體重[27-28]。本系統研究顯示:AGIs減重作用優于DPPIs,可能原因為DPPIs能促進胰島素分泌,眾所周知,胰島素有增加體重作用,而AGIs可通過減少能量攝入而減輕體重。
DPPIs與AGIs總體安全性良好。兩者低血糖風險及嚴重不良反應發生率均較低。糖尿病是心血管疾病的危險因素,糖尿病合并心血管疾病,特別是心力衰竭,可導致患者長期預后欠佳[29]。目前,EXAMINE和TECOS研究均發現,DPPIs不增加患者的心力衰竭住院率[30-31],SAVOR-TIMI 53研究結果則顯示服用沙格列汀藥物組患者心力衰竭住院率明顯增高[32]。然而,本系統研究納入的文獻均沒有報道因心力衰竭住院的患者。對肝腎功能影響方面,Seino等[18]研究報道伏格列波糖組1.3%的患者因ALT及AST升高而退出研究。Iwamoto等[20]報道伏格列波糖組ALT異常率明顯高于西格列汀組(7.1%/0.6%)。
本系統評價的局限性:(1)本Meta分析中納入的研究大部分都是短期的(最長持續時間為52周),因此,筆者不能評估藥物的長期耐受性和安全性。(2)納入研究間存在異質性,這些異質性可能源于研究設計、2型糖尿病病程及對照藥物的不同。(3)西格列汀的標準劑量為100mg/d,然而本研究納入研究西格列汀的使用劑量為50mg/d。(4)納入研究主要來源于亞洲,缺少來源于歐美國家的數據,可能導致偏倚。
綜上所述,DPPIs在降低HbA1C水平、提高HOMA-β水平及降低HOMA-IR水平方面方面均優于AGIs,兩者低血糖風險及嚴重不良反應發生率均較低,DPPIs的總體不良反應發生率及胃腸道不良反應發生率低于AGIs。但受納入研究數量和質量限制,本研究結論尚需開展更多高質量的研究予以驗證。

