Th17/Treg細胞平衡及其細胞因子在感染性早產中的研究進展
曹 琦,董生鳳,胡 瓊
(遵義醫學院附屬醫院產科,貴州 遵義 563000)
早產指妊娠滿28周至不滿37周的分娩[1]。其病因包括宮內感染、胎盤血管功能不全、子宮過度移位和宮頸管縮短等,其中宮內感染約占80%[2]。孕婦體內免疫細胞分泌多種細胞因子構成了母胎界面(蛻膜和子宮組織)復雜的細胞因子網絡,維持母胎免疫平衡[3]。若細胞因子網絡改變將導致妊娠失敗[4]。輔助性T細胞(helper T cell,Th)17是一種有效的促炎細胞,其能促進中性粒細胞的動員、聚集、激活等,并能通過產生白細胞介素(interleukin,IL)17A、IL-17F、IL-21等細胞因子參與感染性早產的發生[5]。調節性T細胞(regulatory T cells,Treg)及其分泌的細胞因子IL-35在妊娠時可抑制母體對胎兒的免疫殺傷反應,從而維持妊娠的發生發展。當微生物感染時,母胎界面的Th17細胞數量增加,導致其分泌的IL-17表達增加;而Treg細胞數量減少,致使其分泌的IL-35表達減少。在以上兩種變化的共同作用下,母胎界面的Th17/Treg細胞比例改變,這可能會造成妊娠結局的改變。現就Th17/Treg細胞免疫失衡及其細胞因子IL-17、IL-35表達紊亂在感染性早產中的作用予以綜述,為感染性早產的預防和治療提供一個新視角。
1 Th17細胞
2 Treg細胞

3 Th17/Treg細胞失衡與感染性早產的關系
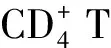
妊娠過程與同種異體移植過程相似,胚胎內一半的基因來自母親,母體的部分抗原組織也由這些基因表達。人類早期蛻膜中含有大量的Treg細胞,其隨著孕周增大逐漸增多,在懷孕6個月左右時數量達到最大值,孕晚期無明顯改變,產后6~8周逐漸回到較低水平,但仍較未孕時高[21]。Th17細胞不僅存在于正常妊娠的蛻膜組織,也大量存在于自發性早產和急性絨毛膜羊膜炎的絨毛中。妊娠期間,先天性免疫應答的生理調節可防止胎兒同種異體移植的排斥。這種調節的核心是細胞因子網絡的變化。正常的妊娠過程包括受精卵形成、胚胎著床、母胎界面免疫耐受維持等一系列生理過程,其中母胎界面的免疫耐受平衡在正常妊娠過程中發揮重要作用,任何一個環節出現問題均可能導致妊娠失敗。母胎界面形成免疫耐受是由于母體會產生一種抗體,這種抗體可以封閉其父系B淋巴細胞上的抗原形成,免疫耐受的平衡可以防止母體內有害的抗體通過胎盤屏障,并覆蓋胚胎中的父系抗原,保證了母胎界面的Th17/Treg細胞免疫平衡,從而維持妊娠的發生發展[22]。因此,封閉抗體的缺失可能是導致妊娠失敗的原因。Cuckle和Van Lith[23]研究發現,淋巴細胞的主動免疫治療能提高妊娠的成功率。但發生炎癥反應、自身免疫性疾病時,母體不能分泌足夠的封閉抗體,蛻膜組織內微環境被破壞,母體對胚胎產生免疫識別和免疫排斥損傷,致使Th17/Treg細胞平衡遭到破壞產生一系列病理反應,進而導致不良妊娠結局的發生[24]。
早產在全球所有孕婦中的發生率為5%~18%,且是新生兒發病和死亡的主要原因[25]。雖然世界各國早產兒的存活率不同,但每年約有310萬嬰兒因早產而死亡;1990年,美國新生兒患病率為10.6%,2010年上升至11.99%[25]。其中,急性絨毛膜羊膜炎所導致的早產在早產兒中約占40%,是導致早產的最常見原因[26-28]。炎癥與早產的病理過程有關,病理性炎癥可由微生物引起的先天性免疫應答或由壞死或細胞應激導致的內源性信號引起,稱為損傷相關分子模式或警報蛋白[29]。Gomez-Lopez等[30]發現在非自然殺傷T細胞激活并誘導早產發生前,母胎界面的Treg和Th17細胞之間存在不平衡。雖然存在絨毛膜羊膜炎的孕婦常發生早產,但其致病機制尚不清楚。Gleditsch等[31]應用低劑量脂多糖刺激孕鼠,仙臺病毒作用于子代小鼠建立肺部感染的新型聯合小鼠模型發現,母體炎癥調節免疫程序可以驅動仔鼠出生后的慢性炎癥過程,其炎性相關疾病的發病率明顯升高。微生物感染造成的絨毛膜羊膜炎和局部炎癥的協同作用形成了對早產的惡性循環,因此對早產的治療或干預措施應側重于抗感染和抗炎策略,以阻止這種惡性循環。上述研究表明,Th17/Treg細胞平衡與感染性早產關系非常密切,Th17/Treg細胞免疫失衡導致的炎癥反應很可能是導致感染性早產發生的機制之一,且可能成為預測感染性早產的特異性指標。
4 IL-17
4.1IL-17的免疫特點 IL-17是1995年首次克隆出的細胞因子,其包括IL-17A~F 6個成員。其中,IL-17A主要由外周血T細胞中的Th17細胞分泌,與免疫細胞上的IL-17RA有強親和力,是重要的促炎因子[32]。IL-17不僅在自身免疫性疾病機制中發揮重要作用,當微生物入侵機體時,Th17細胞被激活,分泌IL-17,使IL-17表達增加,從而有助于宿主防御細胞內和細胞外病原體的侵襲,包括煙曲霉、新型隱球菌和白色念珠菌[33]。
4.2IL-17與感染性早產的關系 有研究表明,IL-17表達正常有利于妊娠過程順利進行[34-36]。也有學者認為,IL-17可能參與胚胎著床及滋養細胞浸潤過程[37]。Xu等[38]發現,與足月分娩婦女相比,自發性早產婦女中的IL-17A、IL-22、IL-13等表達水平明顯升高。Wang等[4]研究發現,不明原因復發性流產患者的IL-17水平約為16.0 ng/L,顯著高于正常早孕婦女(7.5 ng/L)。母胎界面含有IL-17R的免疫細胞為IL-17作用的靶細胞,母胎界面免疫失衡時,Th17細胞表達增加,促使其分泌的IL-17增加;大量的細胞因子IL-17作用于IL-17R,促進中性粒細胞、巨噬細胞等大量增殖和成熟,進而過度發揮對抗細胞外細菌感染及促炎的作用。此外,IL-17、IL-6和腫瘤壞死因子α等炎性介質可刺激子宮肌層中相關收縮蛋白的表達,如催產素受體、前列腺素受體等,誘發宮縮最終導致早產的發生。雖然IL-17R-IgG-Fc融合蛋白對IL-17的中和已被證明可以預防主動脈同種異體移植物的急性排斥反應并延長患者存活時間[39],但抑制IL-17或Th17細胞表達的類似治療是否會阻止感染性早產仍有待研究。
5 IL-35
5.1IL-35的免疫特點 IL-35是一種相對較新型的異源二聚體,其含有由EB病毒誘導的基因3(Epstein-Barr virus-induced gene 3,EBI3)和p35(IL-12p35)亞基。IL-35主要由天然Treg細胞產生,且其對于天然Treg細胞能否在體內體外發揮最大免疫負調控作用至關重要[40]。IL-35不僅參與神經、消化、骨骼、呼吸、關節、生殖等系統的炎癥反應,在過敏性疾病和器官移植等方面也發揮重要作用。作為IL-12家族的一種新型細胞因子,IL-35通過促進Treg細胞和抑制Th17細胞的增生及分化,達到抑制促炎性細胞因子表達的作用,以防止自身免疫應答的過度發生[41]。
5.2IL-35與感染性早產的關系 IL-35在多種感染性疾病的免疫發病機制中發揮重要作用[42]。因此,IL-35受到廣泛關注。有學者在人胎盤滋養層細胞中發現,EBI3和IL-12p35的表達均顯著上調,且可檢測到兩者的表達產物IL-35,說明滋養層細胞中含有IL-35[42]。趙玲俊等[43]認為,滋養細胞在母體與同種異體的胎兒間保持免疫耐受平衡起關鍵作用,其中部分是通過IL-35抑制母體內潛在有害的效應細胞對胎兒產生免疫排斥反應來發揮作用。Collison等[44]通過建立EBI3和p35基因缺失的Treg細胞小鼠模型發現,模型組小鼠基因敲除后IL-35表達缺失,這導致Treg細胞對炎癥的抑制作用顯著降低。此外,有研究發現模型組小鼠基因敲除后Th1、Th2、Th17細胞活性增強,Treg細胞亞群數量明顯減少及抗炎能力顯著下降[45]。因此,IL-35在抑制Th17、Th1、Th2細胞等炎性細胞活性、促進Treg細胞表達和發揮最大抑制炎癥能力方面具有重要意義。
另外,Treg細胞可能通過某種機制或因子發揮其抑制炎癥功能調節母體-胎兒界面的局部微環境,維持妊娠的發生發展。細胞因子在介導機體針對病原微生物的免疫反應及維持機體免疫穩態等過程中具有重要作用。因此推測,Treg細胞可能是通過分泌細胞因子IL-35來發揮免疫抑制功能,進而調節母體-胎兒界面的局部微環境。但有微生物感染時,Treg細胞數目減少及其細胞因子IL-35表達減少,無法發揮有效的免疫抑制作用來對抗胎兒與母體的免疫排斥,進而可能導致妊娠失敗、感染性早產的發生。故IL-35可能成為Treg細胞在預測感染性早產病情進展中的新生標志物。
6 小 結