基于緩控釋技術制備布洛芬雙層片的研究及釋藥機制評價
孫曉飛,孫敬蒙,景嘯瀾,劉 璐,王 丹,張煒煜*
(1.長春中醫藥大學藥學院,長春 130117;2.吉林大學第一醫院,長春 130021)
布洛芬(Ibuprofen)為苯丙酸類非甾體類抗炎藥,溶解性差,屬BCSⅡ類藥物,半衰期較短,約為1.8~2.0 h,需給藥3~4次/d,且存在生物利用度低、服用劑量大等缺點。因此市售劑型多為緩釋制劑,但由于緩釋制劑起效慢,不能在短時間內緩解癥狀,因此將其制備成速釋緩釋雙層片,速釋部分在給藥后迅速釋放有效劑量的藥物,在最短時間內達到有效血藥濃度,迅速有效地緩解癥狀;緩釋部分以相對恒定的速率釋放剩余劑量的藥物,在較長的一段時間內維持有效血藥濃度,從而達到最優化的治療效果。通過溶出度、釋放度研究優化布洛芬速釋緩釋雙層片處方,并進行釋藥模型擬合。
1 儀器與材料
1.1 儀器 Agilent 1200 Series 高效液相色譜儀(美國安捷倫公司),PJ-3片劑四用儀(天津市國銘醫藥設備有限公司),DP30A單沖壓片機(北京國藥龍立科技有限公司),UV5100型紫外-可見分光光度計(上海元析儀器有限公司),AR2140型電子天平(梅特勒-托利多儀器(上海)有限公司),KQ2200B型超聲波清洗器(昆山市超聲儀器有限公司),HH.S21-Hi6電熱恒溫水浴鍋(北京市長源實驗設備廠)。
1.2 材料 布洛芬原料藥(批號:20130308)購自山東新華制藥有限公司;布洛芬(批號:100179-201406)來自中國食品藥品檢定研究院;甲醇(色譜純)購自美國Sigma公司;純凈水購自哇哈哈集團有限公司;HPMCK4M(藥用級,批號:130410)、HPMCK15M( 批 號:130412)、HPMCk100M( 藥用級,批號:130412) 、L-HPC(藥用級,批號:20140206)、乳糖(批號:20130531)、微晶纖維素(批號:20100602)、羧甲基淀粉鈉(藥用級,批號:130404)、預膠化淀粉(藥用級,批號:20110802)、糊精(藥用級,批號:20120411)、淀粉(藥用級,批號:20130105)、硬脂酸鎂(批號:130525)、聚乙烯吡咯烷酮(PVPK30,批號:20130531)等均購自安徽山河藥用輔料股份有限公司;PEG4000(藥用級,批號:20120801)、PEG6000(藥用級,批號:20130902)均購自湖南爾康制藥股份有限公司;L-HPC(藥用級,批號:20140206)購自上海昌為醫藥輔料技術有限公司;交聯聚乙烯吡咯烷酮(PVPP,批號:140325)購自上海康朗生物科技有限公司。
2 試驗方法
2.1 布洛芬速釋緩釋雙層片處方優化研究
2.1.1 基于布洛芬速釋層溶出度優化布洛芬速釋層處方研究
2.1.1.1 對制備方法進行考察 根據預實驗,選擇乳糖為填充劑、HPC用量為20%,崩解劑為交聯聚維酮,用量為5%,硬脂酸鎂用量為1%;以溶出度為考察指標,分別考察粉末直接壓片法、干法制粒壓片法、濕法制粒壓片法對溶出度的影響。結果如表1所示,速釋層3 min溶出度分別為58.87%、13.96%、63.12%,因此確定速釋層制備方法為干法制粒壓片法。

表1 制備方法對布洛芬速釋層溶出度的影響
2.1.1.2 對崩解劑種類進行考察 根據預實驗,選擇乳糖為填充劑、HPC用量為20%,崩解劑用量為5%,硬脂酸鎂用量為1%,分別考察崩解劑為CMS-Na、PVPP、CCNa、L-HPC時對溶出度的影響,如表2所示,溶出度大小為:PVPP>CMS-Na>L-HPC>CCNa,即崩解劑定為PVPP。
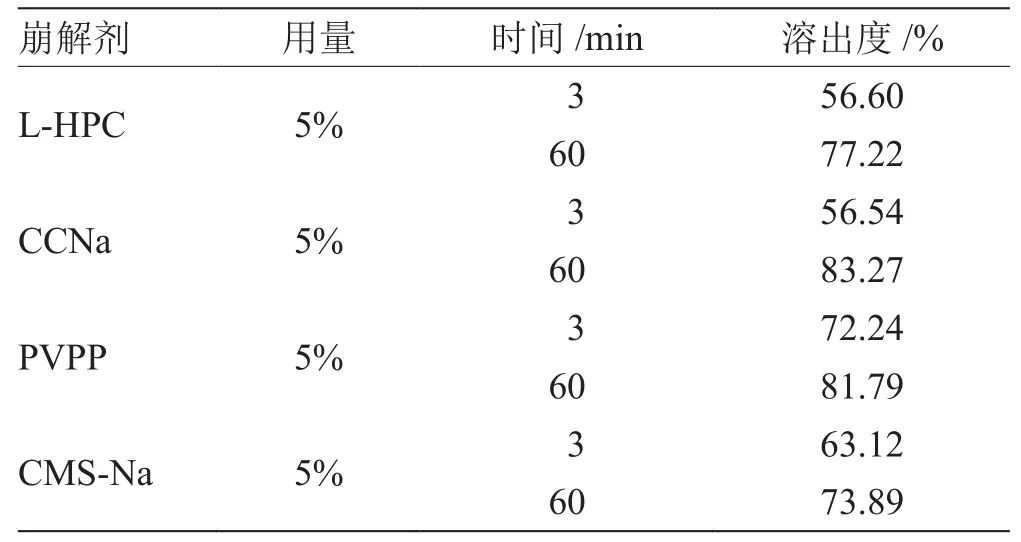
表2 崩解劑種類對布洛芬溶出度的測定結果
2.1.1.3 對崩解劑用量進行考察 根據預實驗,選擇乳糖為填充劑,HPC用量為20%,崩解劑為PVPP,硬脂酸鎂的用量為1%,考察崩解劑用量為2%、3%、5%、7%、9%時對溶出度的影響,結果如表3所示,PVPP用量不同時,布洛芬速釋層3 min溶出度均大于75%,且用量為7%時溶出度最高,因此確定崩解劑PVPP用量為7%。
2.1.1.4 對干黏合劑種類進行考察 根據預實驗,選擇乳糖為填充劑,崩解劑為PVPP,用量為7%,干黏合劑用量為20%,硬脂酸鎂的用量為1%,考察干黏合劑為HPC、MCC、MC4M、MC15M、MC100M對溶出度的影響,結果如表4,布洛芬速釋層3 min溶出度均大于75%,根據溶出度大小確定干黏合劑為HPC。
2.1.1.5 對干黏合劑用量進行考察 根據預實驗,選擇乳糖為填充劑,崩解劑為PVPP,用量為7%,干黏合劑為HPC,硬脂酸鎂的用量為1%,分別考察HPC用量對溶出度的影響,結果如表5所示。干黏合劑用量分別為5%、10%、15%、20%、25%、30%、35%、40%時,布洛芬速釋層3 min溶出度分別為55.56%、62.46%、70.70%、72.89%、76.14%、78.99%、76.32%、69.71%,即干黏合劑用量為30%時速釋層溶出度最高,因此確定干黏合劑用量為30%。

表3 PVPP用量不同時布洛芬溶出度的測定結果

表4 干黏合劑對布洛芬速釋層溶出度的測定結果
2.1.1.6 對填充劑種類進行考察 根據預實驗,選擇崩解劑為PVPP,用量為7%,HPC用量為30%,硬脂酸鎂的用量為1%,考察填充劑種類對布洛芬速釋層溶出度的影響;結果見表6,當填充劑為糊精時,3 min溶出度最高,符合規定,確定填充劑的種類為糊精。
2.1.2 基于布洛芬緩釋層釋放度優化布洛芬緩釋層處方研究
2.1.2.1 對緩釋材料種類進行考察 根據預實驗,選擇乳糖、淀粉為填充劑,緩釋材料用量為18%,致孔劑為PVPK30,用量為5%,5%PVPk30~80%醇溶液為黏合劑,分別考察不同緩釋材料對布洛芬緩釋層釋放度的影響。結果如圖1所示,殼聚糖、海藻酸鈉、黃原膠為緩釋材料易發生突釋行為,乙基纖維素為緩釋材料導致藥物釋放不出來,HPMCk15M更接近緩釋層釋放標準,所以確定緩釋材料為HPMC。

表6 填充劑種類不同時對布洛芬溶出度的測定結果
2.1.2.2 對緩釋材料用量進行考察 根據預實驗,選擇乳糖、淀粉為填充劑,致孔劑為PVPk30,用量為5%,5%PVPk30~80%乙醇溶液為黏合劑,考察緩釋材料不同用量對釋放度的影響。結果如圖2所示,HPMCk15M用量分別為9%、12%、15%時發生突釋行為,用量為24%時藥物釋放不完全,HPMCk15用量為21%時,更接近緩釋層釋放標準。
2.1.2.3 對致孔劑種類進行考察 根據預實驗,選擇乳糖、淀粉為填充劑,緩釋材料為HPMCk15M,用量為21%,致孔劑用量為5%,5%PVPk30-80%醇溶液為黏合劑,考察致孔劑的種類對釋放度的影響。如圖3所示,PEG6000、乳糖、SDS為致孔劑作用不太明顯,PVPk30作為致孔劑聯合緩釋材料HPMCk15M接近緩釋層釋放標準,所以致孔劑為PVPk30。

圖1 緩釋材料種類考察結果圖
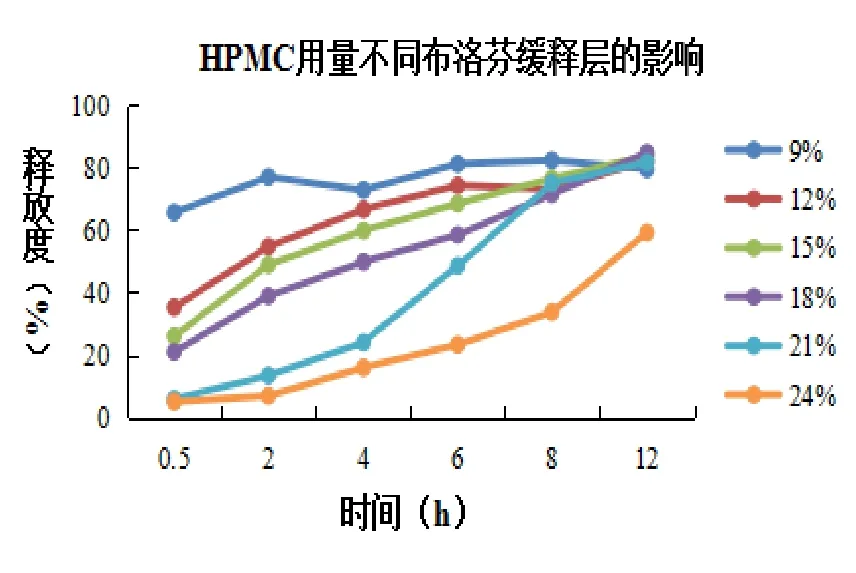
圖2 緩釋材料用量考察結果圖
2.1.2.4 對致孔劑用量進行考察 根據預實驗,選擇乳糖、淀粉為填充劑,緩釋材料為HPMCk15M,用量為21%,致孔劑為PVPk30,5%PVPk30~80%乙醇溶液為黏合劑,分別考察致孔劑用量為0、3%、5%、7%、9%對釋放度的影響,確定致孔劑的用量。

圖3 致孔劑種類考察結果圖
2.1.2.5 對填充劑種類進行考察 根據預實驗,選擇緩釋材料為HPMCk15M,用量為21%,致孔劑為PVPk30,用量為5%,5%PVPk30~80%乙醇溶液為黏合劑,考察填充劑的種類對釋放度的影響。結果如圖5所示,填充劑為淀粉、糊精、微晶纖維素時,均對緩釋層釋放起抑制作用,乳糖用量過大時,致孔劑作用顯著,預膠化淀粉為填充劑緩釋層釋放更加接近緩釋釋放標準,但是預膠化淀粉作為填充劑制備的緩釋顆粒較松,根據前期基礎,考察淀粉和乳糖作為填充劑之間的比例。

圖4 致孔劑用量考察結果圖

圖5 填充劑種類考察結果圖
2.1.2.6 對填充劑混合物比例進行考察 根據預實驗,選擇緩釋材料為HPMCk15M,用量為21%,致孔劑為PVPk30,用量為5%,5%PVPk30~80%乙醇溶液為黏合劑,分別考察乳糖和淀粉混合物的比為1:1、2:1、3:1、淀粉和乳糖混合物的比為2:1、3:1時對釋放度的影響,如圖6,乳糖和淀粉混合物比1:1時,更接近緩釋釋放標準,所以填充劑為乳糖和淀粉混合物比1:1。
2.1.2.7 對黏合劑種類進行考察 根據預實驗,選擇填充劑乳糖和淀粉混合物的比為1:1,緩釋材料為HPMCk15M,用量為21%,致孔劑為PVPk30,用量為5%,考察黏合劑種類對釋放度的影響。如圖7所示,黏合劑種類為1%HPMCK4M水溶液,所制備的顆粒較硬、黏篩,不宜制成片劑;黏合劑為10%PEG6000~80%醇溶液時,6 h釋放過于緩慢且12 h釋放不足90%;黏合劑為1%EC~95%醇溶液時,6 h釋放較快但12 h釋放不足90%,所以黏合劑為5%PVPK30~80%醇溶液。
2.2 布洛芬速釋緩釋雙層片釋藥機理的初步研究 藥物釋放速率和釋放量的可控性是緩控釋技術所要實現的重要目標。藥物制成制劑后,要求其在體內能按一定的規律釋放藥物,以達到預期用藥目的[1-12]。本章研究布洛芬速釋緩釋雙層片的釋藥機理,目的在于探索其體外釋藥規律,為其體內釋藥行為提供理論依據。

圖6 填充劑混合物比例考察結果圖

圖7 黏合劑種類考察結果圖
2.2.1 常見釋藥機理擬合模型[13-16]
零級模型 Mt/M∞=kt
一級模型 Mt/M∞=1-e-kt
Higuchi模型 Mt/M∞=kt1/2
Ritger-Peppas模型 Mt/M∞= ktn
Hixson-Crowell模型 (1- Mt/M∞)1/3=1- kt
其中,t為時間,Mt為t時間的藥物釋放量,M∞為藥物最大釋放量,k為藥物釋放速率常數,n為擴散釋放指數。
在上述模型中,比較常用的是Hiugchi模型和Ritger-Peppas模型。前者是以Fikcina擴散定律為基礎提出的動力學方程;后者是將藥物釋放的溶出項與擴散項相加,提出的一個簡單的半經驗指數方程,用于解釋骨架片的釋藥機制。對于圓柱形制劑即片劑,常采用Ritger-Peppas方程進行具體分析。Hixson-Crowell模型應用于藥物在平坦表面發生溶出,它的釋藥面積正比于藥物表面積。該模型是假設藥物的釋放速率不是由藥物的擴散速率決定,而是藥物顆粒的溶解速率決定的。
2.2.2 布洛芬緩釋層釋藥過程的動力學擬合 將布洛芬緩釋層最佳處方進行藥物釋放度測定,選擇適宜的取樣時間點,建立擬合方程,分別用上述已知模型擬合,并將擬合所得方程的計算值進行比較,以相關系數(R)最大的為擬合結果最好。
取布洛芬緩釋片,精密稱定,置轉籃中,放入含900 mL釋放介質(pH 7.2磷酸鹽緩沖溶液)的溶出杯中,分別于0.5 h、2 h、4 h、6 h、8 h、12 h,取樣5 mL,并同時補充相同溫度相同體積的溶出介質。將5 mL溶出介質置于蒸發皿中,水浴揮干,依據含量測定方法計算各時間點的釋放率,繪制釋放曲線,建立擬合方程。
3 結果
3.1 布洛芬緩釋層釋藥過程動力學擬合結果 見表7、表 8 及圖 8-1、8-2、8-3、8-4、8-5。
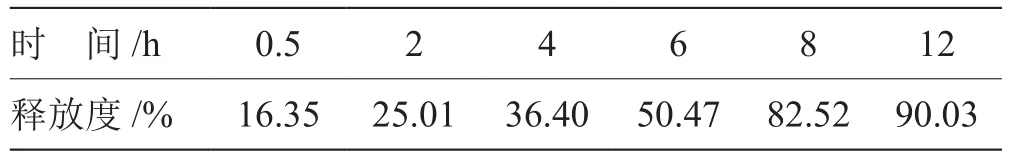
表7 布洛芬緩釋層釋放結果
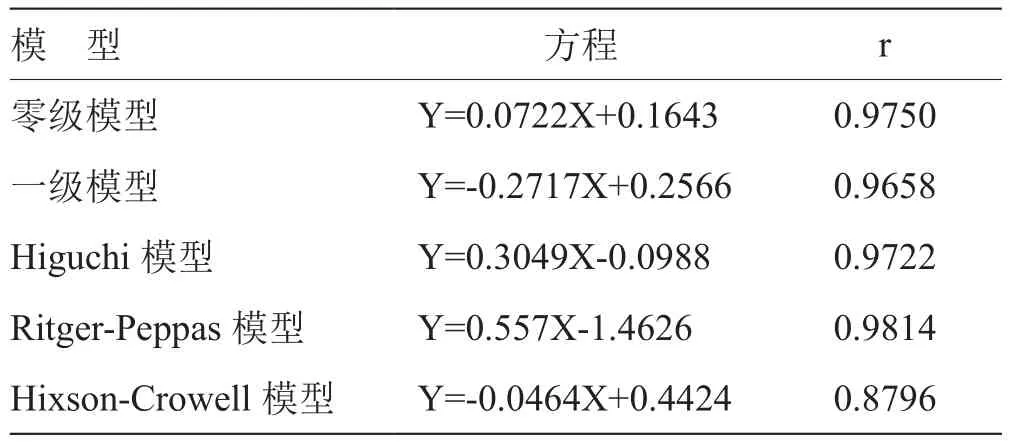
表8 布洛芬緩釋層釋藥過程的動力學擬合表

圖8-1 零級釋藥模型

圖8-2 一級釋藥模型
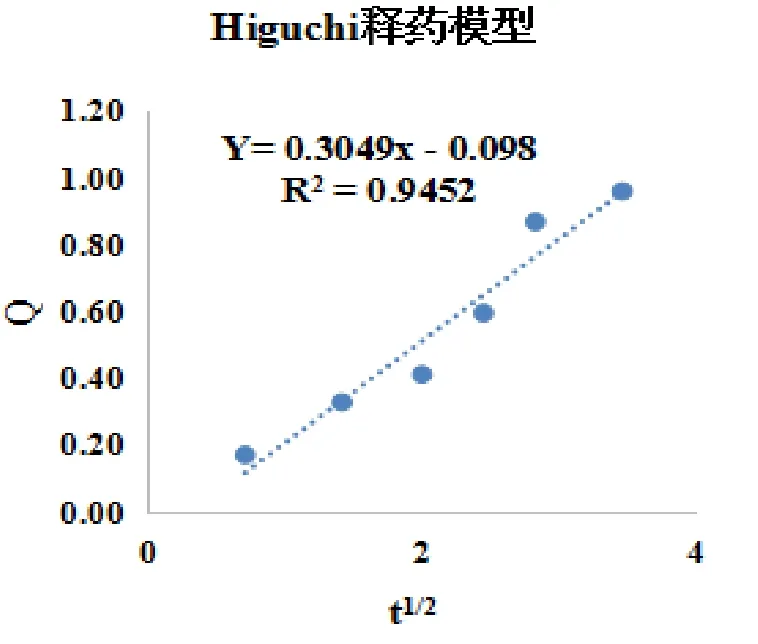
圖8-4 Ritger-Peppas釋藥模型

圖8-5 Hixson-Crowell釋藥模型
3.2 布洛芬緩釋層釋藥機理分析 布洛芬緩釋層釋藥行為Ritger-Peppas模型擬合最好。因此,布洛芬緩釋層釋藥行為符合Ritger-Peppas模型。對釋藥機理進一步分析,采用Ritger-Peppas方程進行擬合,擬合機理的判斷,主要依據釋放指數n的大小,它是表征釋放機制的特征參數。對于圓柱型制劑而言,當0.45<n<0.89時,藥物的釋放機制為non-Fickina擴散,即藥物擴散與骨架溶蝕協同作用;當n<0.45時,為Fikc擴散;當n >0.89時,為骨架溶蝕機制。將Ln Mt/M∞對Int進行線性回歸,得回歸方程:Y =0.5570X-1.462 6(r = 0.981 4,n = 0.557)。因此,布洛芬緩釋層釋藥過程為擴散與溶蝕并存的non-Fickina擴散。
4 討論
4.1 表面活性劑對布洛芬速釋層溶出度的影響 表面活性劑可以增加難溶性藥物的溶解度,促進藥物的吸收,表面活性劑作為增溶劑有以下方法:可作為片劑的崩解劑(溶于黏合劑中;與崩解劑混合加入顆粒中;制成醇溶液噴入顆粒中);在溶出介質中加入等。在布洛芬速釋層處方優化過程中,由于布洛芬為難溶性藥物,以水為溶出介質3 min溶出度未能達到速釋片溶出要求,因此,將Tween-80作為增溶劑,向溶出介質中加入適量的Tween-80,可有效的提高布洛芬速釋層的溶出度,使其符合標準。
4.2 布洛芬緩釋層制備工藝參數的影響 在布洛芬緩釋片制備工藝研究中,分別考察了緩釋材料的種類和用量、致孔劑種類和用量、填充劑種類、黏合劑種類;但在試驗過程中發現,工藝參數對布洛芬緩釋層釋放度也具有較大影響,如制粒目數、壓片壓力等。因此對制粒目數、壓片壓力進行研究發現壓片壓力為5~9 kgf時,緩釋層釋放度較好,符合緩釋片釋放度要求;制粒目數對緩釋層釋放度影響較小,且不同制粒目數制備的布洛芬緩釋片釋放度接近,無較大差異,因此可根據實際生產需要進行調整。
4.3 骨架釋放對布洛芬緩釋片釋放度的影響 布洛芬為難溶性藥物,正常情況下釋放度不能達到要求,因此,將布洛芬制成親水凝膠骨架片,以HPMC為骨架材料,HPMC遇水時,其表面由于水合作用形成凝膠層,表面的藥物很快溶解,凝膠層繼續水化,骨架溶脹,凝膠層增厚延緩藥物釋放,能長時間維持安全有效的血藥濃度,達到緩釋的作用,從而提高布洛芬的療效。

