川芎赤芍對急性腦梗死大鼠Nogo-A/NgR/RhoA/ROCK mRNA水平的影響*
黃 赫,甘 雨,袁 媛,喬 敏,馬 進
(1.遼寧省中醫藥研究院 沈陽 110034;2.遼寧中醫藥大學附屬第二醫院 沈陽 110034)
急性腦梗死是一類多見的突發性心腦血管疾病,致殘率和死亡率較高,嚴重危及人類健康[1-4]。血液粘度、血小板聚集、炎癥的增加和細胞因子級聯反應是患者溶栓后繼發血栓和死亡的主要原因[1,5,6]。當急性腦梗死發生時冠狀動脈阻塞,血管供應大腦的血流中斷并引起壞死或缺血腦組織的軟化。急性腦梗死缺血半暗帶是正常腦組織之間一個可逆的壞死區域,然而缺血中心組織存在不可逆的功能損害[2]。許多以往研究表明成人大腦有對腦缺血損傷進行自我修復的能力[7]。一般來說,神經營養因子是參與神經可塑性和腦卒中后修復的重要調節因子[7,8]。同時,特異性生長抑制劑的高表達是參與限制神經可塑性[7]。本文意在尋找通過調節內源性生長刺激因子與生長抑制因子來放大某些內源性過程以替代神經修復的療法。
Nogo-A是一類著名的髓鞘相關軸突生長抑制蛋白,已被證明能抑制神經細胞的遷移和擴散并在阻斷軸突再生方面發揮重要作用[9,10]。Nogo-A主要通過與受體NGR結合,通過其功能部件激活胞內Nogo-A信號RhoA和它的下游靶基因ROCK,最終導致軸突生長錐凋亡[7,11,12]。
治療急性腦梗死包括溶栓藥和活血藥等。中醫藥由于其安全性被廣泛應用,《本草綱目》中記載:“芎?,血中氣藥也。”川芎有活血行氣,祛風止痛之功效,常用來治療缺血性腦血管病。《滇南本草》中提到赤芍具“行血,破瘀,散血塊”之功效。具有高安全性的中醫藥可能在急性腦梗死過程起神經修復作用。本實驗將川芎赤芍作為行氣活血方,應用實時定量PCR手段從Nogo-A、NgR、RhoA、ROCK途徑探討川芎赤芍治療急性腦梗死的機制,并尋求最佳給藥劑量,為臨床治療提供指導。
1 材料與方法
1.1 實驗試劑與儀器
實驗試劑:組織用RNA提取試劑盒Ⅲ0333059-1001,鑼蓋管03358941001,SYBR GREEN染料04707-516001均購自羅氏診斷產品(上海)有限公司;反轉錄試劑盒RR047A購自寶生物工程(大連)有限公司;引物由華大基因公司合成。
實驗儀器:羅氏全自動核酸分離純化系統MagNA Pure LC 2.0、羅氏勻漿儀MagNA Lyser、羅氏實時定量PCR儀LC 480。
1.2 動物分組
健康雄性SD大鼠,體質量250±10 g,由遼寧長生生物技術有限公司供應;動物生產合格證號為SCXK(遼)2015—0001,動物使用許可證號為SYXK(遼)2012—0003。隨機分為8組,分別為空白組、模型組、假手術組、川赤低劑量組,川赤中劑量組,川赤高劑量組,銀杏葉組,尼莫地平組。
1.3 模型建立與給藥
線栓法制備大鼠局灶性腦缺血(MCAO)模型。使用10%水合氯醛(3 mL·kg-1)注射大鼠腹腔麻醉,使大鼠仰臥并固定在手術臺上,頸前術區脫毛殺菌。無菌操作下做頸部前正中切口長約3 cm,經右側胸鎖乳突肌后氣管旁進入,暴露右側頸總動脈,向外牽引二腹肌及胸鎖乳突肌,由頸總動脈向頭端依次剝離出頸內動脈、頸外動脈,頸總動脈剪一切口,插入魚線18.5±0.5 mm,尼龍線固定,依次縫合切口。2 h動物清醒后拔出線栓1 cm,并剪斷皮膚外部分,進行神經功能評分,放回籠中常規飼養。
第二日開始喂藥,予其等體積的藥物,第三日取材,取其受損腦組織和腹腔血清。剩余繼續喂藥,分別在第7天和14天以上述方法取材。
1.4 RNA提取
本實驗在羅氏全自動核酸分離純化系統中進行。啟動系統,油脂工作站檢查;洗脫盒、儲存盒、加工盒、反應吸頭、廢物袋、廢液瓶、試劑桶放入機器;使用電子天平稱取35 mg組織加入裝有600 mL組織裂解液的鑼蓋管中;組織勻漿儀研磨組織,6500 r·min-150 s兩次;兩次裂解之間的等待將樣品放在冷凍塊里;冷凍塊里培育樣品30 min;13000 r·min-1離心2 min,將350 μl裂解的勻漿加入到樣本管中備用;按照說明的量加注試劑桶,將樣本管放到樣本槽,運行“RNA Tissue Fresh-Frozen”程序,進行RNA提取反應。

表1 Nogo-A、NgR、RhoA、ROCK2、GAPDH引物序列
1.5 cDNA合成
cDNA合成使用寶生物cDNA合成試劑盒RR047A,在反應體系1中加入5 μl RNA,1 μl oligo(dT)18,7 μl ddH2O至總體積13 μl,混勻,離心,65 ℃,10 min。在反應1混合物中加入0.5 μl Protector RNase Inhibitor,4 μl反轉錄酶 Buffer,2 μl Deoxynucleotide Mix,0.5 μl反轉錄酶至總體積 20 μl,混勻,離心,55℃ 30 min,85℃ 5 min,4℃ +∞。
1.6 實時定量PCR
實時定量PCR反應體系包括cDNA 1 μl,上、下游引物各1 μl(引物序列見表1),10 μl Master Mix,7 μl ddH2O。反應程序如下95 ℃ 10 min;95℃ 30 s,60℃30 s,72℃ 1 min,40個循環;95℃ 5 s,65℃ 1 min,4℃30 s。
1.7 統計學分析
使用 2-ΔΔCt公式計算 mRNA 的相對表達量。使用SPSS18.0軟件對結果進行統計學處理,采用單因素方差分析。P<0.05為有統計學意義,P<0.01為有顯著性差異。
2 結果分析
為探索川芎赤芍對大鼠急性腦梗死的療效,檢測不同川赤劑量組與空白組、模型組、假手術組Nogo-A、NgR、RhoA、ROCK2 mRNA相對表達量的差異,銀杏葉組和尼莫地平組分別作為中藥陽性和西藥陽性對照組。同時,本研究對用藥3天、7天和14天后急性腦梗死大鼠Nogo-A、NgR、RhoA、ROCK2 mRNA相對表達量進行對比,統計其差異。
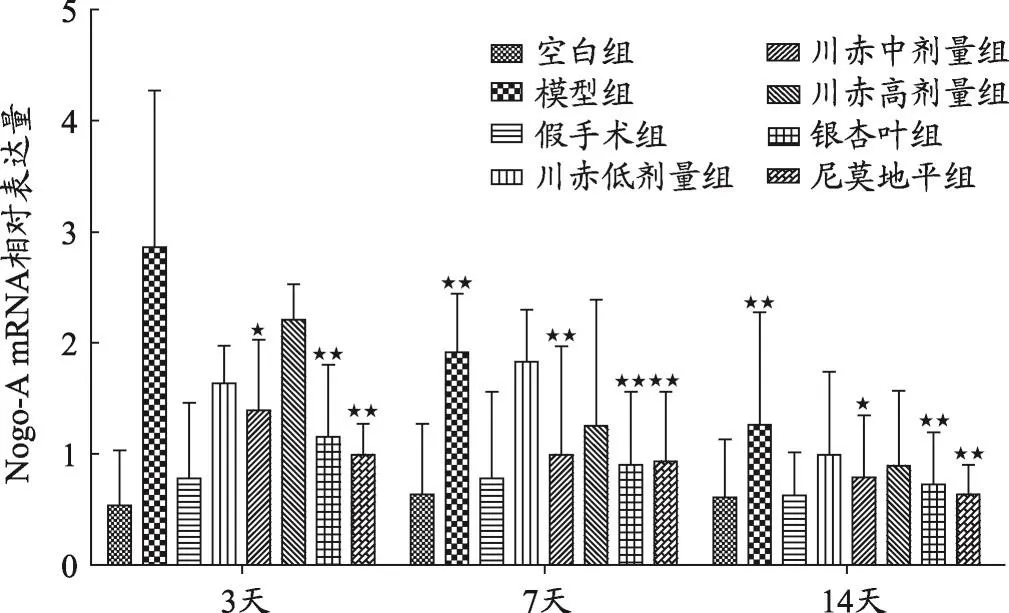
圖1 不同組大鼠Nogo-A mRNA相對表達量變化
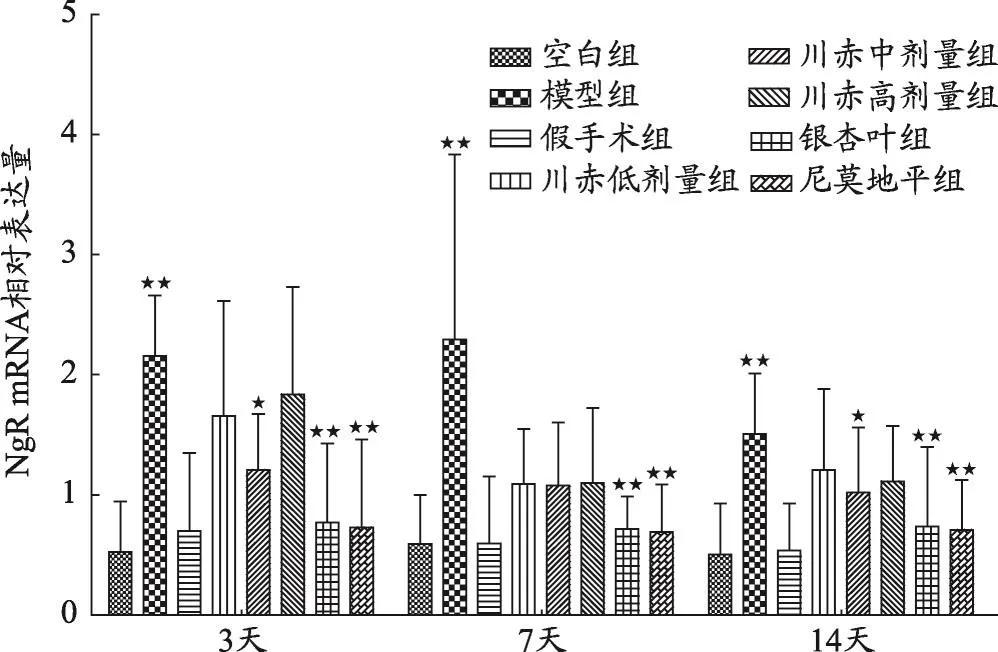
圖2 不同組大鼠NgR mRNA相對表達量變化
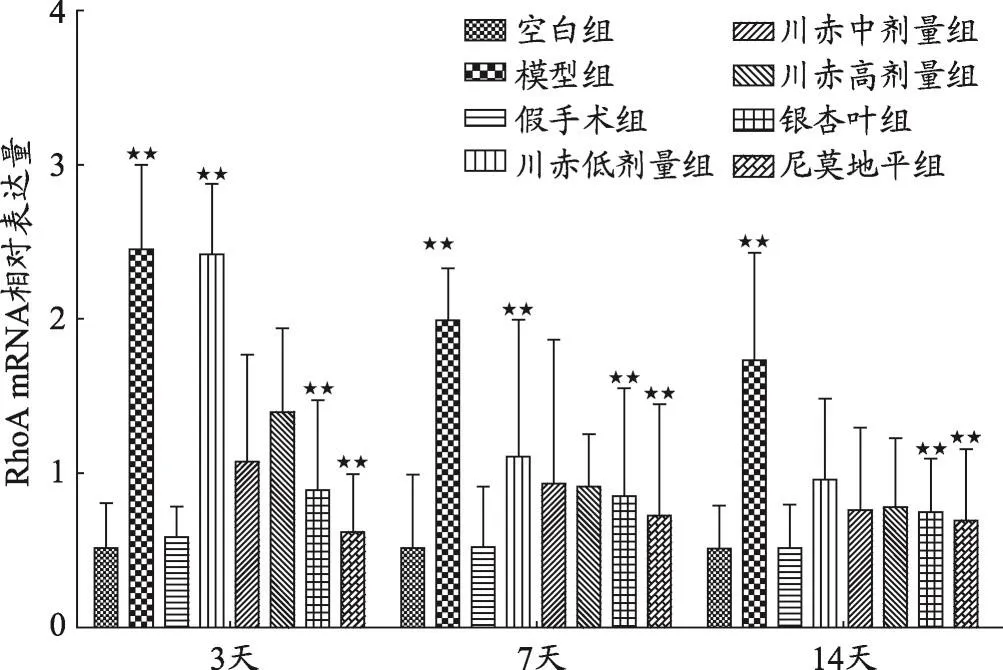
圖3 不同組大鼠RhoA mRNA相對表達量變化
結果如圖1、2、3、4,不同用藥天數模型組與空白組、假手術組相比,Nogo-A、NgR、RhoA、ROCK2 mRNA相對表達量明顯升高(P<0.05)。
見圖1,給藥3天后Nogo-A mRNA相對表達量川赤高劑量組>低劑量組>中劑量組(P<0.05),且與模型組相比以上三組都顯著降低(P<0.01),銀杏葉組和尼莫地平組Nogo-A mRNA相對表達量亦顯著低于模型組(P<0.01)。給藥7天后,川赤中、高劑量組與模型組相比Nogo-A mRNA相對表達量顯著降低(P<0.01)。川赤低劑量組對Nogo-A mRNA相對表達量的抑制作用低于川赤中、高劑量組(P<0.01),川赤中高劑量組Nogo-A mRNA相對表達量無顯著差異,銀杏葉組和尼莫地平組與模型組相比Nogo-A mRNA相對表達量顯著降低(P<0.01)。給藥14天后,川赤低、中、高劑量組Nogo-A mRNA相對表達量與模型組相比顯著降低(P<0.01),且川赤中劑量組Nogo-A mRNA相對表達量低于高劑量組(P<0.05),川赤低、高劑量組無明顯差異,而銀杏葉組和尼莫地平組與模型組相比Nogo-A mRNA相對表達量顯著降低(P<0.01)。
如圖2,給藥3天后,川赤低、中、高劑量組NgR mRNA相對表達量與模型組相比顯著降低(P<0.01),且川赤中劑量組<低劑量組<高劑量組(P<0.05),銀杏葉組和尼莫地平組與模型組相比NgR mRNA相對表達量顯著降低(P<0.01)。給藥7天后與模型組相比,川赤低、中、高劑量組NgR mRNA相對表達量顯著降低(P<0.01),但川赤低、中、高劑量組之間該基因相對表達量無顯著性差異,銀杏葉組和尼莫地平組與模型組相比NgR mRNA相對表達量顯著降低(P<0.01)。給藥14天后川赤低、中、高劑量組比模型組NgR mRNA相對表達量顯著降低(P<0.01),川赤中劑量組NgR mRNA相對表達量略低于川赤高劑量組(P<0.05),川赤中劑量組NgR mRNA相對表達量顯著低于川赤低劑量組(P<0.01),川赤低、高劑量組之間NgR mRNA相對表達量無顯著性差異,銀杏葉組和尼莫地平組與模型組相比NgR mRNA相對表達量顯著降低(P<0.01)。
如圖3所示,給藥3天后與模型組相比,川赤低、中、高劑量組RhoA mRNA相對表達量顯著降低(P<0.01),川赤低劑量組RhoA mRNA相對表達量高于川赤中、高劑量組(P<0.01),銀杏葉組和尼莫地平組與模型組相比明顯降低(P<0.01)。給藥7天后與模型組相比,川赤低、中、高劑量組RhoA mRNA相對表達量顯著降低(P<0.01),川赤低劑量組RhoA mRNA相對表達量高于川赤中、高劑量組(P<0.01),川赤中、高劑量組RhoA mRNA相對表達量無顯著差異,銀杏葉組和尼莫地平組與模型組相比顯著降低(P<0.01)。給藥14天后與模型組相比,川赤低、中、高劑量組RhoA mRNA相對表達量顯著降低(P<0.01),川赤低、中、高劑量組RhoA mRNA相對表達量無明顯差異,而銀杏葉組和尼莫地平組與模型組相比顯著降低(P<0.01)。
給藥3天后與模型組相比,川赤低、中、高劑量組ROCK mRNA相對表達量顯著降低(P<0.01),川赤低劑量組ROCK mRNA相對表達量高于川赤中、高劑量組(P<0.05),川赤中、高劑量組之間無顯著性差異,銀杏葉組和尼莫地平組與模型組相比顯著降低(P<0.01)。給藥7天后與模型組相比,川赤低、中、高劑量組ROCK mRNA相對表達量顯著降低(P<0.01),川赤中劑量組ROCK mRNA相對表達量低于川赤低、高劑量組(P<0.01),川赤低、高劑量組ROCK mRNA相對表達量無顯著差異,銀杏葉組和尼莫地平組與模型組相比顯著降低(P<0.01)。給藥14天后與模型組相比,川赤中、高劑量組ROCK mRNA相對表達量顯著降低(P<0.01),川赤低劑量組低于模型組(P<0.05),川赤低劑量組ROCK mRNA相對表達量高于中劑量組(P<0.05),川赤高劑量組與中劑量組ROCK mRNA相對表達量無顯著性差異,而銀杏葉組和尼莫地平組與模型組相比顯著降低(P<0.01)(圖4)。
3 討論
急性腦梗死是一類嚴重的神經系統疾病[13]。當前關于急性腦梗死的研究大多集中在炎癥細胞因子[1,13]和細胞凋亡[2]的角度上,從保護神經角度研究的較少。本研究從軸突生長抑制因子mRNA水平的改變入手探討川芎赤芍治療急性腦梗死的分子機制。
信號因子Nogo-A、NgR、RhoA、ROCK2可以限制軸突生長和神經可塑性[7,14]。Nogo-A是一類眾所周知的髓鞘相關軸突生長抑制蛋白,已被證明參與抑制神經細胞的遷移和擴散,并在阻止軸突再生和中風后軸突重建方面具有重要作用[7,9,15]。NgR為Nogo-A受體,通常與Nogo-A一起發揮抑制神經突生長的作用[11]。抑制RhoA能顯著促進小鼠神經干細胞神經突生長與神經元分化[7,16]。抑制ROCK可調節軸突生長并保護神經元免于興奮性毒性誘導的細胞死亡[7,17,18]。在小膠質細胞中,活化的ROCK會影響神經炎癥和多巴胺能神經變性,而被抑制的ROCK主要在多巴胺能神經元的神經保護方面發揮作用[7,19]。
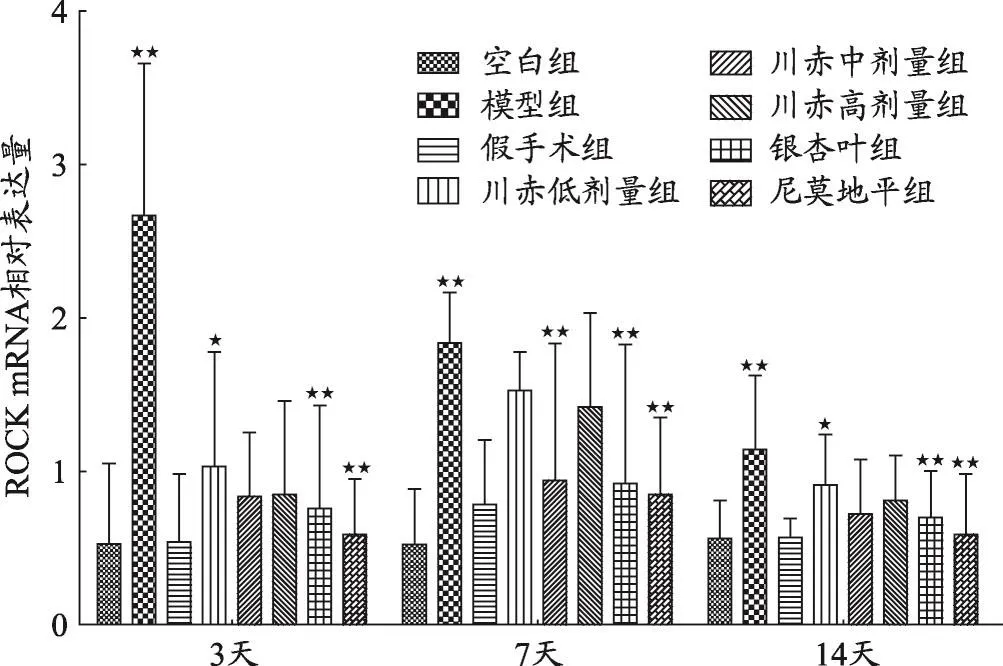
圖4 不同組大鼠ROCK mRNA相對表達量變化
當腦血管疾病發生時,Rho和ROCK活動通常增加,不僅僅在血管平滑肌和內皮細胞,也存在于炎癥細胞和神經元[20,21]。Rho和ROCK通過細胞信號轉導系統對平滑肌細胞功能產生影響[22]。Rho通過其下游效應物ROCK調節細胞重組肌動蛋白骨架,廣泛參與細胞遷移、基因轉錄、細胞凋亡和神經再生[23]。ROCK是Rho下游產物,包括兩種細胞亞型ROCK1和ROCK2,后者主要存在于中樞神經系統中像海馬錐體神經元和腦區皮質。韋斯等人[24]表明ROCK通過許多渠道影響細胞信號轉導系統,并參與平滑肌細胞增殖和再狹窄的調節。其作用機制已得到證實,如促進MLC磷酸化,增加內皮細胞滲透,并下調內皮型一氧化氮合酶的表達[25,26],上述機制可導致大腦供血障礙,影響記憶與學習能力。
實驗結果顯示,模型組Nogo-A、NgR、RhoA、ROCK2相對表達量與空白和假手術組相比上調,提示急性腦梗死可能增加大鼠軸突生長抑制因子的表達。川赤中劑量組Nogo-A相對表達量在給藥3天和14天與川赤低、高劑量相比下調最多(P<0.05),在7天時川赤中高劑量組間相對表達量無差異,且低于川赤低劑量組(P<0.01)。川赤中劑量組NgR相對表達量在給藥3天、7天和14天均低于川赤低、高劑量組(P<0.05)。給藥3天、7天川赤中、高劑量組RhoA相對表達量下調最多(P<0.01),而給藥14天川赤低、中、高劑量組RhoA相對表達量差異不明顯。給藥3天川赤中、高劑量組ROCK相對表達量低于川赤低劑量組(P<0.05);給藥7天與川赤低、高劑量組比,川赤中劑量組下調最多(P<0.01);給藥14天,川赤中劑量組比低劑量組下調明顯(P<0.05),與高劑量組無差異。由此可以推測,川芎赤芍組成的益氣活血方能夠下調內在生長抑制因子Nogo-A/RhoA/ROCK2 mRNA的表達以降低急性腦梗死帶來的神經損傷,且中劑量川芎赤芍療效可能較好。
通過本研究我們發現川芎赤芍可降低急性腦梗死大鼠Nogo-A、NgR、RhoA、ROCK2 mRNA的相對表達量(P<0.05),且給藥3天、7天和14天后這種下降趨勢依然存在,因此推測川芎赤芍對于急性腦梗死大鼠神經損傷的保護是持續性的,川赤中劑量組可能治療效果較好。這些數據均支持川芎赤芍可能有神經修復作用,為研究其作為治療急性腦梗死潛在新藥打下基礎。

