實驗動物遺傳質量控制微衛星標記檢測法重復性研究
王 洪,戴方偉,王 靜,魏 杰,杜江濤,黃樹武,賈松華,岳秉飛*
(1. 中國食品藥品檢定研究院,北京 102629;2. 浙江省醫學科學院,杭州 310013;3. 廣東省實驗動物監測所,廣州 510663)
微衛星(microsatellites),也叫做短串聯重復(short tandem repeat,STR)。該序列由2~6 bp的核心序列和相對保守的側翼序列組成。根據側翼序列設計引物,擴增結果能夠反映出不同品系或不同個體的實驗動物的核心序列重復個數的差異。對不同品系或不同群體在微衛星核心序列上的差異進行統計分析,獲取實驗動物的遺傳背景信息。參照實驗動物國家標準GB 14923-2010[1],“可選用DNA多態性檢測法進行群體遺傳質量檢測”。我們國家的實驗動物遺傳質量檢測標準GB/T 14927.1-2008[2]仍采用生化標記檢測法,而美國Jackson實驗室和Charles River實驗室均采用微衛星標記以及SNP標記等分子生物學方法[3-4]。
實驗動物的遺傳質量控制是所有其他質量控制的基礎,只有在遺傳質量滿足標準要求的前提下,其他方面的質量控制才有意義。為了滿足送檢單位的需求,提升檢測能力,滿足國際合作與交流的需要,急需建立微衛星標記方法的檢測標準,為實驗動物遺傳質量控制提供檢測依據。本研究針對團體標準[5]中微衛星標記檢測法,在3家實驗室進行方法驗證,證實該方法能否用于實驗動物遺傳質量檢測,在不同的實驗室是否具有較好的重復性[6]。
1 材料和方法
1.1 實驗動物
6只C57BL/6J實驗小鼠,SPF級,8周齡,雌雄各半,體重20~22 g,來源于國家嚙齒類實驗動物種子中心[SCXK (京) 2014-0013]。小鼠取材于中國食品藥品檢定研究院動物實驗設施[SYXK (京) 2016-0004],并按實驗動物使用的3R原則給予人道的關懷。
1.2 主要試劑與儀器
Tris飽和酚,氯仿,異戊醇,采購于國藥集團化學試劑有限公司;Takara HS Taq 酶(R007B),100 bp DNA ladder(3422A),DL500 DNA marker購自TaKaRa(A701A和A801C),瓊脂糖(5260)和6× loading buffer(A6101)均購自北京六合通經貿有限公司。所用PCR儀為美國ABI VeritiTM96;微量分光光度計為美國Thermo Nanodrop 2000;凝膠成像系統為美國Kodak GL212Pro;基因測序儀ABI3730xl。
1.3 實驗方法
1.3.1 微衛星位點選取
本研究隨機選取團體標準[5]中12個微衛星位點,所用引物信息見表1。
1.3.2 模板DNA提取[7]
實驗小鼠尾尖組織樣本5 mm,用酚/氯仿抽提法提取基因組DNA。經微量分光光度計檢測,將所有DNA濃度均稀釋為50 ng/μL。
1.3.3 PCR體系和反應條件[7]
PCR反應體系為20 μL,其中含10× PCR buffer:2 μL,上下游引物(10 pmol/μL):各1 μL,dNTP(100 μmol/L):1.2 μL,Taq酶(5 U/μL):1 μL,50 ng/μL基因組DNA:1 μL,鎂離子終濃度1.5 mmol/L,無菌蒸餾水補齊20 μL。反應條件為94℃預變性, 5 min;94℃變性,30 s;退火溫度(見表1),30 s;72℃延伸,30 s;35個循環;72℃繼續延伸8 min;擴增產物4℃保存。
PCR擴增產物在2.5%瓊脂糖凝膠電泳,120 V,30 min。
分別位于北京、浙江、廣東的3家實驗室用同樣的12個微衛星位點對6份實驗小鼠DNA模板進行PCR擴增和電泳。北京實驗室電泳使用100 bp DNA ladder,浙江和廣東實驗室電泳使用DL500 DNA marker。
1.3.4 測序[7]
對PCR擴增結果進行STR掃描測序。
1.4 統計學方法
對測序結果進行統計分析。所用軟件POPGENE 1.32和PIC Calc 0.6。
2 結果
北京、浙江和廣東的3家實驗室分別獲得清晰電泳條帶,獲得等位基因數72個。其中D16Mit9位點在6只C57BL/6 J小鼠獲得一致的143 bp的等位基因片段。D12Nds11位點在6只C57BL/6 J小鼠獲得一致的174 bp的等位基因片段。詳見圖1A~1F,圖2A~2F和圖3A~3F測序結果表明3家實驗室獲得片段大小一致的等位基因。12個微衛星位點在6只實驗小鼠的等位基因片段長度見表2。
3 討論
微衛星標記檢測法是國內外通用的實驗動物遺傳質量評價手段。國外實驗室對于實驗動物遺傳質量的控制主要采取微衛星DNA標記檢測法和SNP方法[8-9],為滿足國際合作與交流的需要,本研究驗證了本實驗室建立的微衛星標記檢測法在實驗動物遺傳質量檢測領域應用的可行性以及可重復性。
基于微衛星標記檢測法的重要性,近些年來,已有科研人員在微衛星方法的建立及應用方面開展過一些研究。周建華等人[10]采用14個微衛星DNA標記技術對福建獼猴與河南獼猴遺傳多樣性進行分析。劉麗等人[11]利用微衛星分子標記技術,分析祁連山東段高寒草甸區小尺度下4個高原鼢鼠種群的遺傳多樣性和遺傳結構特點。衛振等人[12]從400對微衛星引物中篩選得到51對分辨率高的引物用于豚鼠的常規檢測研究。李銀銀等人[13]利用30個微衛星位點對國內24個近交系實驗小鼠進行遺傳狀況分析。范濤等人[14]應用30個微衛星位點對4種不同來源高度免疫缺陷小鼠微衛星DNA 遺傳檢測的分析。郭羽等人[15]應用微衛星技術對兩個來源的NIH實驗小鼠進行群體遺傳結構分析。微衛星技術在實驗動物品系鑒定和群體結構分析方面應用廣泛。
但是之前建立的方法,沒有進行方法重復性研究,極大地限制了微衛星方法在實驗動物遺傳質量控制方面的應用。本研究側重于微衛星標記檢測法在3家實驗室的重復性研究。選擇位于北京,浙江和廣東的3家實驗室應用12個微衛星位點對6只實驗小鼠進行遺傳質量檢測,研究結果表明,擴增條帶與標準規定一致,微衛星標記檢測法可以實現對實驗動物的遺傳質量評價,并在不同實驗室獲得較好的重復性。本研究成果豐富了我國的實驗動物遺傳質量監測手段,為團體標準[5]升級為國家標準提供合理依據,保障國際交流與合作的順利開展。
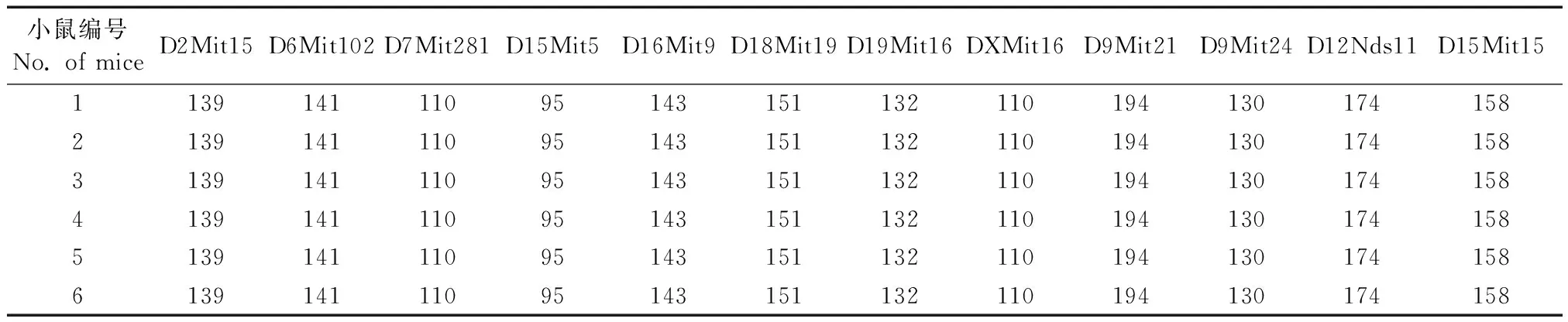
表2 6只小鼠在12個微衛星位點的等位基因片段大小Table 2 Length of alleles of the six mice using 12 microsatellites
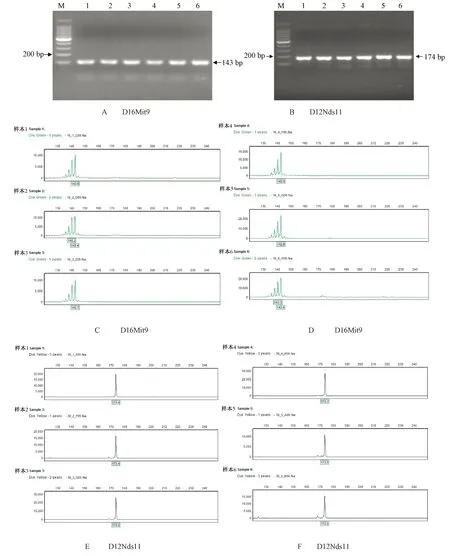
注:A:D16Mit9位點電泳結果;B:D12Nds11位點電泳結果;C:小鼠樣本1~3的D16Mit9位點測序結果;D:小鼠樣本4~6的D16Mit9位點測序結果;E:小鼠樣本1~3的D12Nds11位點測序結果;F:小鼠樣本4~6的D12Nds11位點測序結果。圖1 北京實驗室在D16Mit9和D12Nds11位點電泳結果圖和測序結果圖Note. A: Electrophoresis result of D16Mit9; B: Electrophoresis result of D12Nds11; C: Sequencing result of D16Mit9 in samples 1-3; D: Sequencing result of D16Mit9 in samples 4-6; E: Sequencing result of D12Nds11 in samples 1-3; F: Sequencing result of D12Nds11 in samples 4-6.Figure 1 Electrophoresis images and sequencing results of D16Mit9 and D12Nds11 in the Beijing laboratory
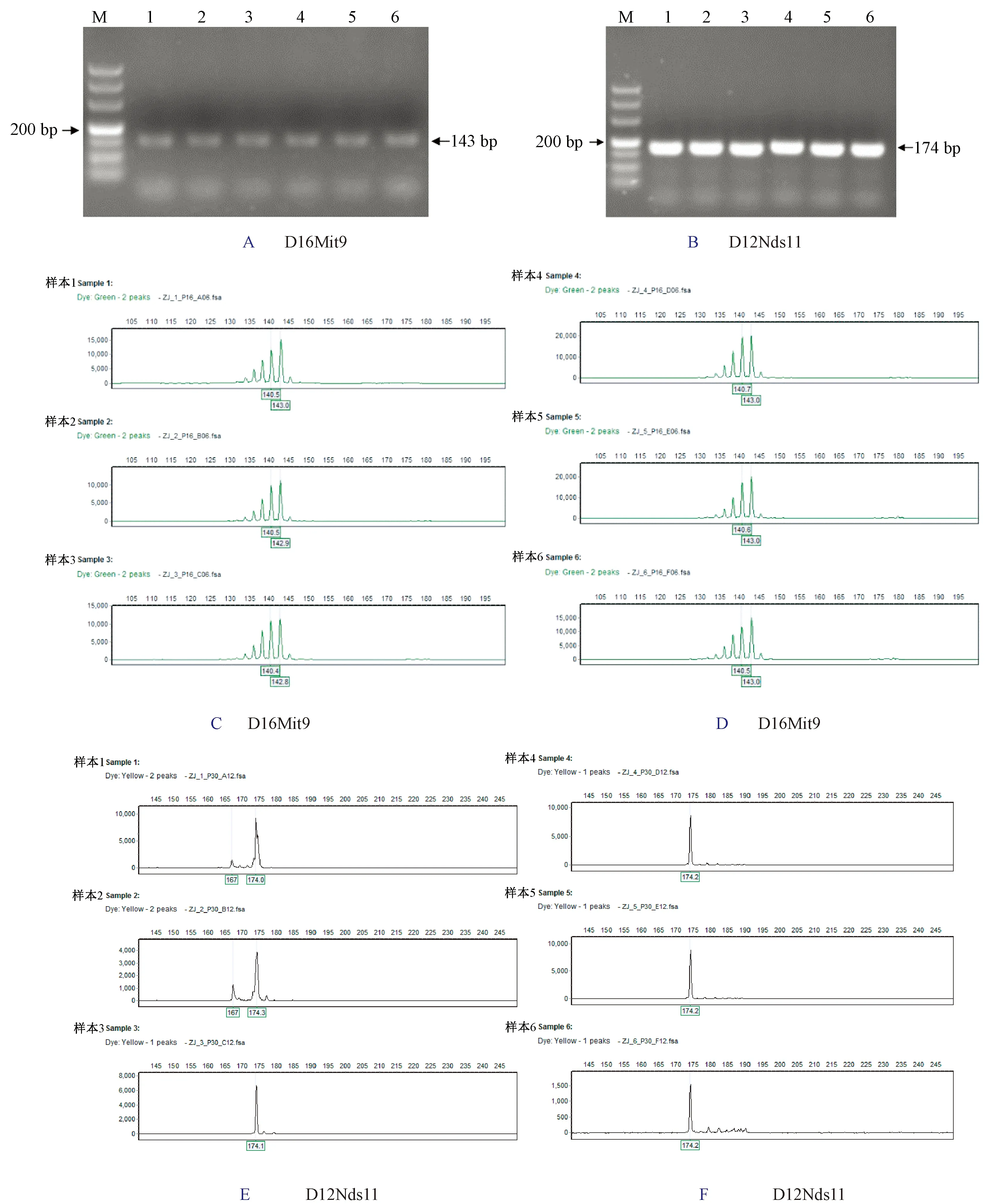
注:A:D16Mit9位點電泳結果;B:D12Nds11位點電泳結果;C:小鼠樣本1~3的D16Mit9位點測序結果;D:小鼠樣本4~6的D16Mit9位點測序結果;E:小鼠樣本1~3的D12Nds11位點測序結果;F:小鼠樣本4~6的D12Nds11位點測序結果。圖2 浙江實驗室在D16Mit9和D12Nds11位點電泳結果圖和測序結果圖Note. A: Electrophoresis result of D16Mit9; B: Electrophoresis result of D12Nds11; C: Sequencing result of D16Mit9 in samples 1-3; D: Sequencing result of D16Mit9 in samples 4-6; E: Sequencing result of D12Nds11 in samples 1-3; F: Sequencing result of D12Nds11 in samples 4-6.Figure 2 Electrophoresis images and sequencing results of D16Mit9 and D12Nds11 in the Zhejiang laboratory
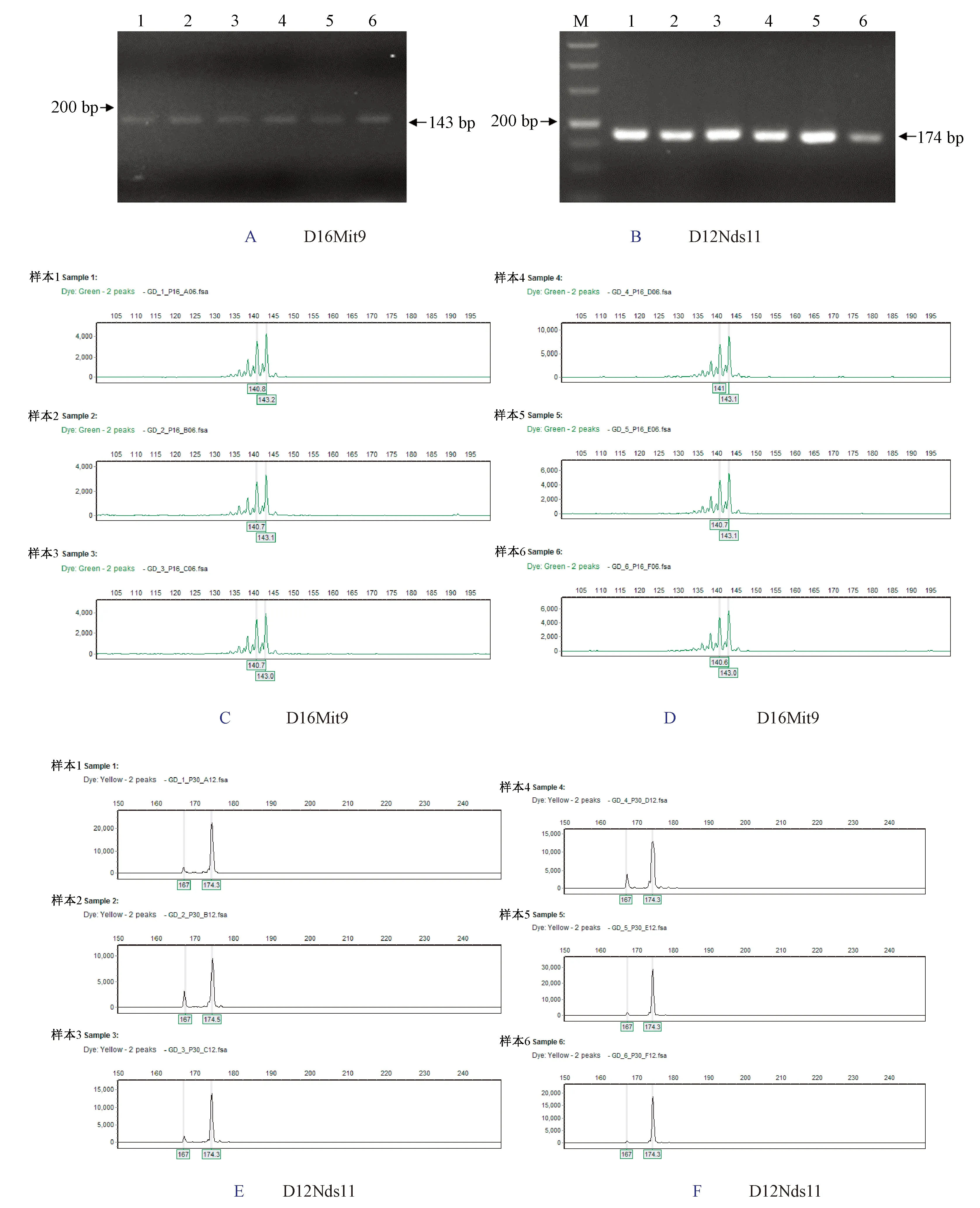
注:A:D16Mit9位點電泳結果;B:D12Nds11位點電泳結果;C:小鼠樣本1~3的D16Mit9位點測序結果;D:小鼠樣本4~6的D16Mit9位點測序結果;E:小鼠樣本1~3的D12Nds11位點測序結果;F:小鼠樣本4~6的D12Nds11位點測序結果。圖3 廣東實驗室在D16Mit9和D12Nds11位點電泳結果圖和測序結果圖Note. A: Electrophoresis result of D16Mit9; B: Electrophoresis result of D12Nds11; C: Sequencing result of D16Mit9 in samples 1-3; D: Sequencing result of D16Mit9 in samples 4-6; E: Sequencing result of D12Nds11 in samples 1-3; F: Sequencing result of D12Nds11 in samples 4-6.Figure 3 Electrophoresis images and sequencing results of D16Mit9 and D12Nds11 in the Guangdong laboratory

