補加碳源對采油菌株ZY-1生長及發酵液表面活性的影響
于亞男,王佳新,孫玉梅*
(1.大連工業大學 生物工程學院,遼寧 大連 116034;2.中國輕工業武漢設計工程有限責任公司,湖北 武漢 420100)
微生物采油(microbial enhanced oil recovery,MEOR)是通過向油藏注入微生物及營養源,或單獨注入營養物質激活內源微生物,使微生物快速生長繁殖和合成代謝產物來提高石油采收率[1]。期間,微生物及其代謝產物能改變原油組成及其黏度和流動性,增大油層壓力和掃油面積[2]。
碳源對MEOR有重要影響[3]。研究表明,補加糖類碳源可以促進采油微生物生長繁殖,降低原油利用率[4]。李清心等[5]以芽孢桿菌L-32利用原油產生的酸性代謝產物,降低原油黏度,補加葡萄糖會加快菌體生長,提高原油采收率。包木太等[6]利用5%淀粉水解液可以對油藏內源有益采油菌烴類氧化菌(hydrocarbon-oxidizing bacteria,HOB)有較好的激活效果,菌體能維持較長的平穩期并同時產酸和產表面活性物質,從而增加油層壓力,降低原油黏度以及原油/巖石體系界面張力,提高殘油采收率。于海威等[7]在45℃厭氧篩選的驅油菌株SF67可以利用原油快速生長,降解飽和烷烴,降低含蠟量及界面張力,促進原油采收。
深層油藏溫度較高,篩選耐高溫菌種及適宜營養尤為重要[8]。利用微生物產生的表面活性劑提高原油采收率有很好的應用前景[9]。前期研究發現芽孢桿菌屬耐高溫采油菌株ZY-1能產糖脂類陰離子表面活性劑[10]。本實驗主要研究該菌株利用不同碳源生長、產表面活性物質以及對不同碳源的利用進行比較分析,為深入研究和應用提供參考。
1 材料與方法
1.1 材料與試劑
1.1.1 實驗菌株
節桿菌屬(Arthrobacter sp.)菌株ZY-1:分離自遼河油田原油,在200 g/L甘油中于-80℃冰箱中保存。
1.1.2 化學試劑
木糖、葡萄糖、石油醚、環己烷(均為分析純):天津科密歐化學試劑有限公司;液體石蠟、淀粉(化學純):天津市博迪化工有限公司。
1.1.3 培養基
斜面培養基:牛肉膏5 g/L,NaCl 5 g/L,蛋白胨10 g/L,瓊脂20 g/L,蒸餾水1 L,pH值為7.0。
種子培養基:牛肉膏5 g/L,NaCl 5 g/L,蛋白胨10 g/L,蒸餾水1 L,pH值為7.0。
發酵培養基:Na2HPO41.5 g/L,KH2PO43.4 g/L,NaNO34 g/L,MgSO4·7H2O 0.2 g/L,酵母粉0.2 g/L,石蠟2 g/L,蒸餾水1 L,pH值為7.0。
培養基均在121℃條件下滅菌20 min。
1.2 儀器與設備
CR21G高速冰凍離心機:日本日立公司;WFJ 7200型可見光分光光度計:上海尤尼柯儀器有限公司;Jzhy1-180界面張力儀:承德大華試驗機有限公司;GC-8900氣相色譜儀:山東滕州經緯分析儀器有限責任公司。
1.3 方法
1.3.1 菌種活化及種子液的制備
將-80℃儲存的菌種接于斜面培養基,于60℃活化24 h,得活化菌種。在種子培養基中接入2環/100 mL活化菌種,在60℃培養24 h,得液體種子。
1.3.2 菌株對不同碳源的利用效果
分別在不同碳源(石蠟2 g/L、木糖2 g/L+石蠟2 g/L、葡萄糖2 g/L+石蠟2 g/L、淀粉2 g/L+石蠟2 g/L)的發酵培養基接入5%液體種子,60℃靜置培養7 d。每天定時取樣測定發酵液的菌體密度(OD600nm值),上清液的表面張力、乳化活性及石蠟的含量。
1.3.3 測定方法
菌體密度:根據濁度法測定[11]。
表面張力:以表面張力儀測定[12]。將棄油相發酵液3 000×g離心20 min,用表面張力儀測上清液表面張力。
乳化活性:在1.5 mL棄油相發酵液中加入1 mL石蠟,振蕩5 min后靜置24 h,測定乳化層和總液層高度[13-14]。乳化活性=乳化層高度/總液層高度×100%。
石蠟含量:采用氣相色譜法測定[15]。進樣室:280℃,火焰離子化檢測器(flame ionization,FID):300℃,初始柱溫:80℃,升溫速度:5℃/min升溫至200℃維持2 min;再以8℃/min升溫至280℃維持30 min。進樣量:0.2μL。
2 結果與分析
2.1 不同碳源對菌株生長的影響
由圖1可知,以石蠟為碳源時,菌株ZY-1在發酵0~3 d時生長速度快,發酵3 d時菌體密度OD600nm值為0.60,隨后急降至OD600nm值為0.41,發酵7 d后菌體密度升至OD600nm值為0.62;以木糖+石蠟為碳源時,菌株ZY-1在發酵1 d時菌體生長速度較快,隨后減慢,3 d后平穩上升,發酵7 d時菌體密度升至OD600nm值為0.77;以葡萄糖+石蠟、淀粉+石蠟為碳源時,菌株ZY-1在發酵1 d時菌體生長速度較快,隨后生長緩慢,發酵7 d后菌體密度分別為OD600nm值0.29、OD600nm值0.31,且菌體生長量始終低于以石蠟為碳源時。因此,以木糖+石蠟為碳源時有利于菌體生長。
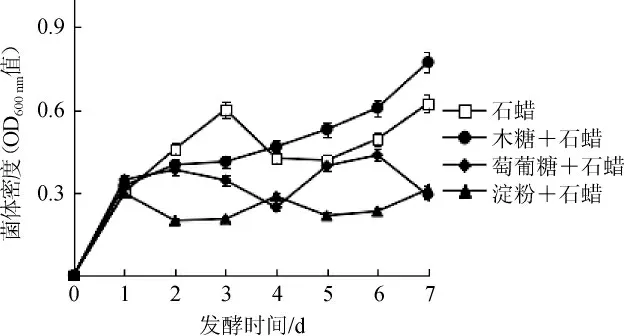
圖1 碳源對菌株生長的影響Fig.1 Effect of carbon sources on the strain growth
2.2 不同碳源對發酵液表面張力的影響
由圖2可知,以石蠟為碳源時,發酵液表面張力在發酵2 d時降55.45 mN/m,發酵2~3 d時上升至62.6 mN/m,發酵7 d時發酵液表面張力降至52.3 mN/m;以木糖+石蠟為培養基碳源時,發酵液在發酵2 d時表面張力快速下降,且整個發酵過程表面張力較低,在發酵7 d時發酵液表面張力降至50.45 mN/m;以葡萄糖+石蠟、淀粉+石蠟為碳源時,發酵液表面張力均在發酵3 d時降至最低,分別為45.9 mN/m、43.8 mN/m,發酵7 d時,表面張力分別降至49.5 mN/m、47.9 mN/m。因此,淀粉+石蠟為碳源時最利于發酵液表面張力的降低,效果最好。

圖2 碳源對發酵液表面張力的影響Fig.2 Effect of carbon sources on surface tension of fermentation broth
2.3 不同碳源對發酵液乳化活性的影響
由圖3可知,以石蠟為碳源時,發酵液乳化活性在發酵2 d時升至41.6%,發酵2~4 d時下降至14%,發酵7 d時發酵液乳化活性升至55.7%;以木糖+石蠟、淀粉+石蠟為培養基碳源時,發酵液乳化活性均在發酵2 d時快速上升,分別達到61.3%、63.3%,且整個發酵過程乳化活性較高,在發酵7 d時發酵液乳化活性分別達到50%和60%。以葡萄糖+石蠟為碳源時,發酵液乳化活性在發酵3 d時升至最高為63.3%,發酵7 d時乳化活性為46.6%。因此,以木糖+石蠟、淀粉+石蠟為碳源時更有利于發酵液乳化活性的升高。

圖3 碳源對發酵液乳化活性的影響Fig.3 Effect of carbon sources on emulsification of fermentation broth
2.4 不同碳源對發酵過程中石蠟消耗的影響
由圖4可知,菌株ZY-1以石蠟為碳源時,發酵0~3 d石蠟快速大量消耗,消耗了55%,發酵3~7 d消耗減慢,發酵7 d消耗石蠟72%,與菌體生長密切相關。在石蠟碳源培養基中外加糖類碳源,可以在發酵0~3 d明顯減慢對石蠟的消耗,其中木糖+石蠟碳源消耗石蠟41%,淀粉+石蠟消耗石蠟43%,葡萄糖+石蠟碳源消耗石蠟54%,發酵7 d分別消耗石蠟61%、77%、79%。因此,與葡萄糖和淀粉相比,木糖更有利于減慢石蠟的消耗。

圖4 碳源對發酵過程中石蠟含量的影響Fig.4 Effect of carbon sources on paraffin content during the fermentation
3 討論
耐高溫采油菌株ZY-1以石蠟為唯一碳源進行生長繁殖,產生的表面活性劑很少,加入糖類碳源可以促進產物生成,表現在發酵液表面張力更低,乳化活性更高。同菌屬菌株23-1產脂肽類陰離子表面活性劑,也有相同的實驗結果[17]。菌株ZY-1以木糖-石蠟為混合碳源在整個發酵過程比單獨石蠟碳源的石蠟消耗慢且少,木糖的存在可以降低石蠟的利用速度和利用量,說明與石蠟相比該菌株更易利用木糖生長。這與菌株Acinetobacter BHSN以木糖為碳源更有利于細胞生長與合成生物表面活性劑的結果相似,而與同菌株以葡萄糖為碳源加快細胞生長速度,但對促進生物表面活性劑合成效果不明顯的結果相反[18]。葡萄糖對提高伊朗油藏采收率作用顯著[19]。本研究石蠟分別與木糖、葡萄糖以及淀粉的混合碳源可不同程度的減慢菌株對石蠟的利用率,促進生物表面活性劑合成效果明顯,使發酵上清液表面張力降至更低,乳化活性更高。在菌株Geobacillus toebii R-32639的采油模型中添加淀粉等營養源,可使原油表面張力降低25.3%,改善原油的流動能力,提高采收率[20]。本研究混合碳源發酵液的表面張力較之降低幅度更大,減慢發酵過程對原油的消耗,故有利于石油采收。
4 結論
補加碳源與單一石蠟作為培養基碳源相比更有利于促進菌株代謝環境的表面張力降低以及乳化活性升高,其中木糖-石蠟碳源有利于促進細胞生長OD600nm值為0.77,減少了11%的石蠟消耗,并且表面張力降至最低49.5 mN/m,乳化活性高達61.3%。葡萄糖-石蠟以及淀粉-石蠟碳源不能明顯促進細胞生長,但在發酵前期能減慢對石蠟的利用,明顯促進生物表面活性劑的合成。在菌株ZY-1采油應用中,宜利用木糖促進合成生物表面活性劑,并減少短鏈烷烴的消耗,從而提高原油的采收率。添加葡萄糖和淀粉雖然不能明顯促進細胞生長,但由于其可以減慢對石蠟的消耗,并在一定程度上促進生物表面活性劑的產生,對微生物采油也具有一定的應用價值。

