胰島結合bFGF生物膠經腎被膜下移植逆轉小鼠糖尿病
朱群燕,蔣煊,鄭雅文,黃志偉,徐福遠,耿武軍,傅紅興,趙應征
(1.溫州醫科大學 藥學院,浙江 溫州 325035;2.溫州醫科大學附屬第一醫院 麻醉科,浙江 溫州325035)
胰島移植是目前臨床糖尿病治療領域中一種具有較大潛力的治療手段,盡管埃德蒙頓方案公布后,胰島移植取得了可觀的進展,但胰島需要量大、移植后微血管重建慢、胰島功能低下等問題仍然阻礙著胰島移植的大規模應用[1-4]。堿性成纖維細胞生長因子(basic fi broblast growth factor,bFGF)具有刺激血管新生、創傷愈合和組織再生等功能[5]。本實驗室前期已證明bFGF能夠促進胰島內部微血管重建,提高胰島體內活性和功能[6],但bFGF在體內半衰期短,單純bFGF培養液與胰島共移植的效果不理想。
重組人膠原蛋白(recombinant human collagen,RHC)是利用基因工程改性所得的一種III型膠原,該膠原能增強血管強度,為細胞提供養分,從而促進新血管的形成[7-8]。為提高胰島移植后療效、減少胰島用量,本研究基于實驗室前期基礎,選用bFGF結合不同濃度RHC與胰島共移植至同系糖尿病小鼠腎被膜下,并對術后胰島功能和組織學進行評價,為進一步研究降低胰島移植用量和提高移植效果奠定基礎。
1 材料和方法
1.1 材料
1.1.1 實驗動物:雄性Balb/C小鼠40只,6~8周齡,購自上海斯萊克實驗動物有限責任公司。
1.1.2 實驗試劑和器材:異氟烷(Baxter公司,美國);鏈脲佐菌素(STZ)、膠原酶V(sigma,USA);Ficoll-1077、Ficoll-1119、CMRL-1066、Hanks液(溫州市怡康細胞移植技術開發有限公司);胎牛血清(Gibco,Thermo Fisher Scientific);重組人膠原蛋白(江蘇江山聚源生物技術有限公司);堿性成纖維細胞生長因子(浙江格魯特生物科技有限公司);血糖儀(博士醫生,北京);恒溫水槽(DKZ-450B,上海森信實驗儀器有限公司);離心機(L500,上海利鑫堅離心機有限公司);體式顯微鏡(SDT-TL2,上海光泉科儀器有限公司)。
1.2 方法
1.2.1 糖尿病模型的建立:Balb/C小鼠造模前禁食12 h,不禁水,測定空腹血糖值和體重,腹腔注射STZ(55 mg/kg)。造模后第1、3、7天測定血糖值,血糖值≥22.2 mmol/L 視為糖尿病造模成功,可用于移植實驗。
1.2.2 小鼠胰島的分離:參考前期的實驗基礎[6,9-10],簡述如下:取Balb/C小鼠吸入過量異氟烷致死后,膽總管逆行灌注膠原酶V溶液2.5 mL(濃度為1 mg/mL),摘取胰腺至50 mL離心管中,(37±0.5)℃恒溫水消化至乳糜狀,冷Hanks液終止消化,并用Ficoll-1077和Ficoll-1119進行非連續密度梯度純化,在體視顯微鏡下進一步手工挑選。胰島用CMRL-1066培養基(含10% FBS和1%青霉素-鏈霉素)于37 ℃、5%CO2培養箱中培養6 h后進行移植。
1.2.3 胰島鑒定、活性測定和當量計算:采用常規的DTZ染色方法鑒定胰島,并用FD/PI染色液染色測定胰島活性[6]。參照Lembert等[11]方法,在倒置顯微鏡下記錄每個胰島的直徑,按照胰島當量表換算成相應直徑150 μm的胰島當量。
1.2.4 實驗分組及體外培養:將造模成功的小鼠隨機分成三組,分別為:(1)Free組(單純胰島移植組);(2)1 mg/mL RHC+60 ng/mL bFGF組(胰島移植液中含1 mg/mL RHC和60 ng/mL bFGF);(3)16 mg/mL RHC+60 ng/mL bFGF組(胰島移植液中含16 mg/mL RHC和60 ng/mL bFGF)。胰島基礎移植液與培養液一致,每只小鼠移植胰島當量為(200±50)IEQ。以正常Balb/C組(NOR組)、糖尿病小鼠未移植胰島組(DM組)為對照組。
1.2.5 小鼠腎被膜下移植:參照Zumda等[12]的研究。糖尿病小鼠持續吸入異氟烷麻醉后,剃去右側背部毛發并消毒,暴露腎臟。在體式顯微鏡下用注射器將含(200±50)IEQ胰島的混懸液推注至腎被膜下,棉簽壓迫止血,縫合傷口。皮下注射1 mL生理鹽水補液。每日早晚給予頭孢唑林鈉皮下注射50 μL(濃度50 mg/mL),持續1周。
1.2.6 移植后胰島功能和療效評價
(1)血糖和體重監測:每日觀察小鼠飲食、飲水和精神狀況,測量和記錄小鼠血糖和體重變化。連續兩次血糖超過16.7 mmol/L預示著小鼠重回高血糖狀態[13]。
(2)口服糖耐量試驗(OGTT):移植后第30天,將移植組、正常組(NOR組)和糖尿病未移植組(DM組)小鼠禁食過夜,不禁水。用超純水配制濃度為200 mg/mL的葡萄糖溶液,灌胃劑量為2 mg/g,測定各組小鼠灌胃前(0 min)和灌胃后20、40、60、90、120 min的血糖值。
(3)移植部位胰島的組織學評價:移植后第30天,取各移植組小鼠,持續異氟烷吸入麻醉,經心臟灌注生理鹽水后,取移植部位腎臟組織并固定于4%多聚甲醛中,進行HE、Insulin免疫組化染色和CD31免疫組化染色,觀察移植部位胰島的形態和新血管生成結果。
1.3 統計學分析
數據采用Graft pad 5統計學軟件進行處理,所有數據用(±s)表示,并采用成對樣品t檢驗進行統計學分析。P<0.05表示具有統計學意義。
2 實驗結果
2.1 小鼠胰島的分離和培養結果
經純化和手工挑選后的小鼠胰島純度為(96.4±2.6)%。培養6 h后,胰島外形完整、邊緣清晰,經FD/PI染色顯示,平均活性(90.1±3.5)%。
2.2 移植術后小鼠血糖和體重變化
16 mg/mL RHC+60 ng/mL bFGF組的小鼠胰島移植后血糖下降最快,與1 mg/mL RHC+60 ng/mL bFGF組均能維持正常血糖超過30 d;Free組胰島移植后血糖未能降至正常水平(見圖1A)。胰島移植治療結束后,Free組體重明顯降低[降低(-2.10±2.60)g],1 mg/mL RHC+60 ng/mL bFGF組[增加(3.36±0.78)g,P<0.05]和16 mg/mL RHC+60 ng/mL bFGF組[增加(3.04±1.01)g,P<0.05]小鼠體重則增加明顯(見圖1B)。
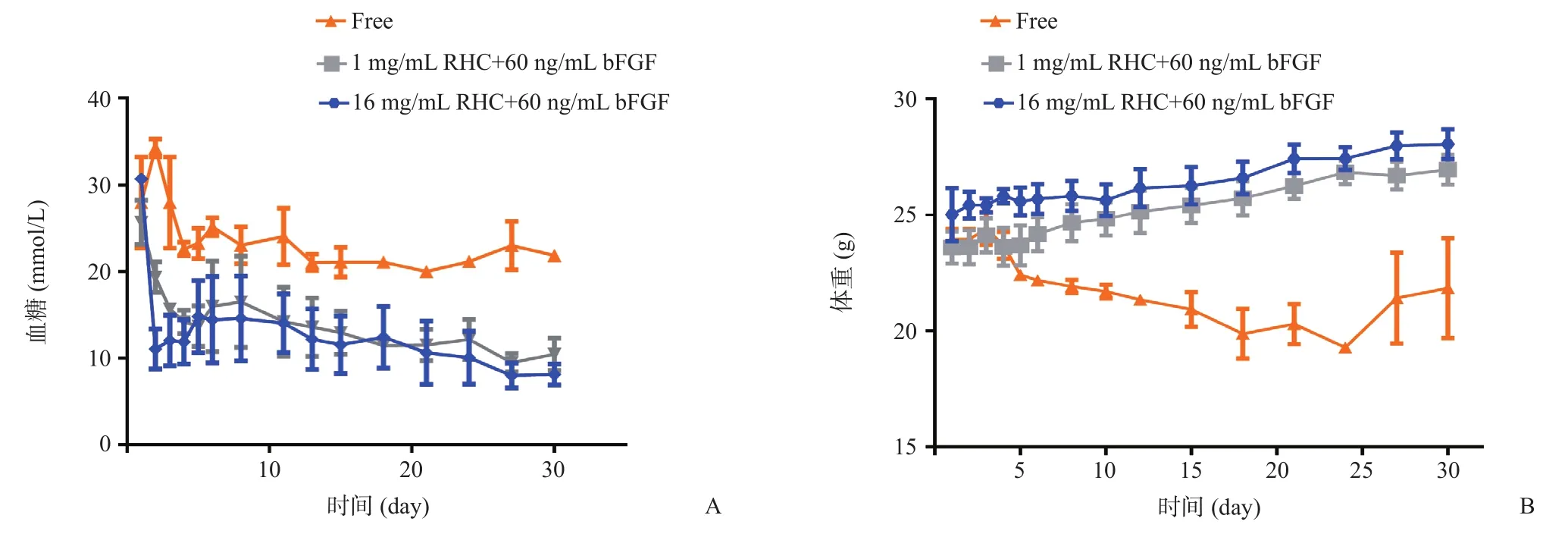
圖1 胰島移植后各組小鼠血糖(A)和體重(B)的變化結果
2.3 口服糖耐量試驗(OGTT)
如圖2所示,16 mg/mL RHC+60 ng/mL bFGF組小鼠的糖耐量曲線和NOR組相似,且120 min時血糖均恢復到基線水平;Free組和1 mg/mL RHC+60 ng/mL bFGF組小鼠在120 min時血糖均未能恢復到基線水平。

圖2 小鼠胰島移植后第30天糖耐量結果
2.4 移植后腎被膜下胰島的組織學評價
取胰島移植30 d后的小鼠腎組織進行HE、insulin素和CD31免疫組化染色,結果如圖3所示。
由移植部位含胰島組織的HE和insulin免疫熒光染色結果可見,各移植組腎被膜下的胰島組織形態完整,且能分泌胰島素(圖3A)。由移植部位胰島組織的CD31染色結果顯示,1 mg/mL RHC+60 ng/mL bFGF組和16 mg/mL RHC+60 ng/mL bFGF組CD31蛋白表達較多,說明新血管生成較多,而Free組CD31陽性表達較少,說明新生血管較少(圖3B)。
3 討論
目前,可供胰島移植用胰腺供體不足和胰島分離純化過程中造成的胰島內部微血管系統的破壞均制約著臨床胰島移植在糖尿病治療中的應用[6,14]。為了解決這些問題,國內外研究者進行了大量的探索,如構建三維多孔支架為胰島提供生存的空間[14]、添加生長因子類藥物促進受損微血管重建[6]、應用產氧微粒減少胰島中心壞死[15]等。本課題小組初步研究表明,全量胰島移植(400 IEQ)能有效控制糖尿病小鼠的血糖水平。本研究采用胰島聯合RHC和bFGF共移植,血糖監測結果顯示(200±50) IEQ的胰島亦能顯著降低血糖至正常水平,且與單純同當量胰島移植的小鼠降低水平的能力有明顯差異(P<0.01)。本研究亦發現,RHC-bFGF和胰島共移植組的新生血管數量明顯增加。
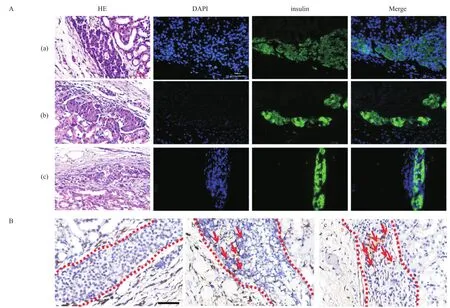
圖3 移植部位腎臟組織HE染色、Insulin免疫熒光染色和CD31免疫組化染色
本研究通過聯合應用RHC和bFGF,為胰島提供一個富含bFGF的類細胞外基質的微環境,能夠促進移植后胰島的微血管重建和提高胰島功能、降低維持正常血糖所需的胰島移植量,有助于緩解胰島移植中供體不足的難題。

