橋本氏甲狀腺炎患者氧化抗氧化失衡狀態的研究
楊建元,江學慶,楊永剛,韓永紅
(武漢市中心醫院甲狀腺乳腺外科,湖北武漢 430014 )
活性氧自由基是正常細胞新陳代謝的產物,低濃度的活性氧是細胞內的許多生化過程的必要條件,而過量的活性氧通過與蛋白質、脂質和DNA反應來抑制它們的正常功能引起細胞損傷[1-2]。在生理條件下,人血清紅細胞中存在的多種酶和非酶防御系統稱為抗氧化劑,以防止由活性氧積累引起的損傷。當活性氧的內源性產生與抗氧化防御機制之間發生不平衡即氧化應激時,導致促炎細胞因子的釋放增加以及酶功能改變引起炎癥和細胞損傷。因此,氧化應激被認為與幾種炎癥和免疫介導的疾病的發病機制有關,包括自身免疫性甲狀腺疾病(AITD)[3-4]。
甲狀腺功能亢進和甲狀腺功能減退已被認為與氧化應激相關。既往關于甲狀腺自身免疫性疾病患者氧化狀態的研究較少,對自身免疫過程本身的氧化/抗氧化系統的作用理解是局限的[5-7]。本研究旨在通過特異性血清檢測,如活性氧代謝物的衍生物(d-ROM)和生物抗氧化蛋白(BAP),以及高級糖化終產物(AGE)和高級氧化蛋白產品(AOPP)來檢測甲狀腺功能正常的橋本氏甲狀腺炎(HT)的氧化平衡變化,反映身體氧化水平的一般狀態。
1 資料與方法
1.1一般資料 選取2016年5月至2017年5月期間在本科治療的41例甲狀腺功能正常的HT患者,所有患者均簽署知情同意書并通過醫院倫理委員會審查。入組標準:(1)首次診斷為HT;(2)甲狀腺功能正常;(3)3個月內未口服影響甲狀腺功能藥物;(4)年齡>18歲。排除標準:(1)既往發現有甲狀腺疾病;(2)存在有嚴重心肺等器官的疾病;(3)惡性腫瘤患者;(4)伴隨有糖尿病、腎衰竭、自身免疫系統疾病、感染性或炎癥性疾病、甲狀腺疾病;(5)服用抗氧化劑、降壓降脂藥物以及補充維生素的患者;(4)未簽署知情同意書。每位入組的患者均符合納入標準及排除標準,有完善的病史和體格檢查。并同時選取同期的43名健康受試者進行對照分析。
1.2方法
1.2.1生化檢查 隔夜禁食后,從肘靜脈收集血樣。4 ℃離心10 min。立即測量葡萄糖、胰島素、血脂、肝功能和甲功能;其他測定的等分試樣儲存在-20 ℃。總體而言,研究參數的確定在血清收集后2個月內發生。使用常規方法的商業試劑盒測量血清空腹胰島素、葡萄糖、三酰甘油、總膽固醇、高密度脂蛋白(HDL-C)和低密度脂蛋白膽固醇(LDL-C)、谷草轉氨酶(AST)和谷丙轉氨酶(ALT)、同型半胱氨酸。通過電化學發光免疫測定(ECLIA),使用Elecsys的商業試劑盒測量血清促甲狀腺激素(TSH),游離甲狀腺素(FT4)和游離三碘甲狀腺原氨酸(FT3)水平,以及抗甲狀腺球蛋白(TgAb)和抗甲狀腺過氧化物酶(TPOAb)由羅氏診斷公司提供的1010/2010 e模塊化分析儀E170。 實驗室的參考范圍是:TSH 0.27~4.20 mIU/L;FT3 2.0~4.4 pg/mL;FT4 12.0~22.0 pmol/L;TgAb 0~4 IU/mL;TPOAb 0~10 IU/mL。所有樣品均在本院實驗室中心進行處理。
1.2.2氧化劑和抗氧化劑參數的測定 活性氧代謝物(ROM)通過Diacron(Grosseto,Italy)的試劑盒d-ROM測量。該測定法測量血清樣品中存在的氫過氧化物的濃度。使用Diacron(Grosseto,Italy)試劑盒測量生物抗氧化潛能(BAP)。AGEs的測定是基于分光熒光檢測。AOPPs的測定同樣運用分光光度檢測, AOPP的濃度用氯胺T單位(μmoleq Cl T/L)表示。超聲評估:使用7.5MHz線性換能器的超聲波檢查儀由同一位超聲科醫師進行檢查。甲狀腺異常超聲外觀,其特征在于彌漫性區域的回聲反射性降低,被認為是超聲診斷HT的重要標準。
2 結 果
2.1一般臨床資料對比分析 兩組在年齡和性別,主要營養和代謝等參數方面差異無統計學意義(P>0.05)。所有受試者在取樣時均為甲狀腺功能正常,但與對照組相比,HT患者的血清TSH水平仍顯著升高,差異有統計學意義(P<0.001),見表1。

表1 一般臨床資料對比分析
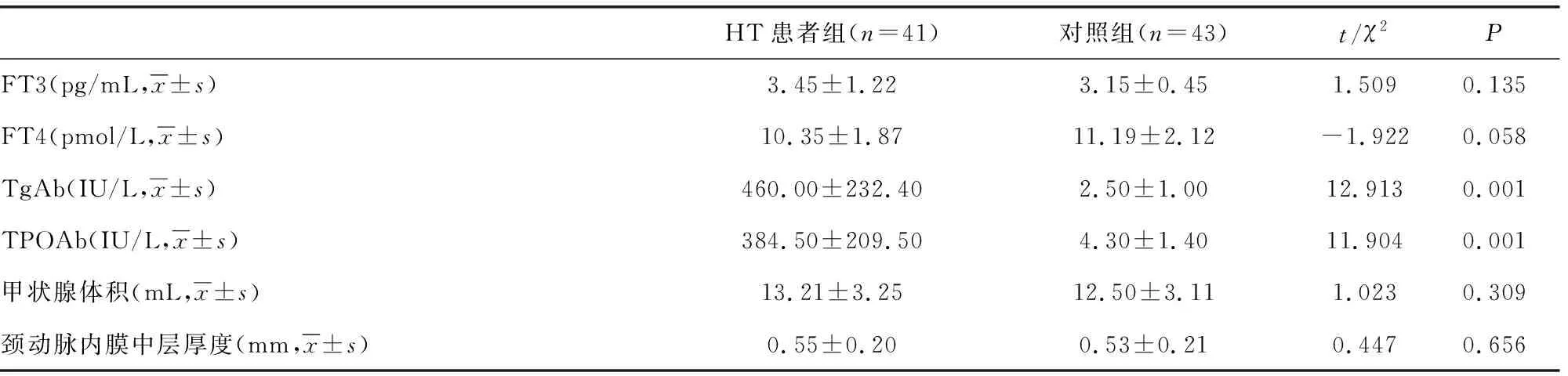
續表1 一般臨床資料對比分析
表2 氧化劑和抗氧化劑參數的評估
2.2氧化劑和抗氧化劑參數的評估 本研究中,通過d-ROM,BAP,AGEs和AOPP等評估氧化應激水平。與健康對照組相比,HT患者的d-ROM顯著升高(P=0.012),而BAP明顯降低(P<0.001)(表2)。兩個參數呈負相關(r=-0.868,P<0.001)(圖1),表明HT患者內源性自由基產生與抗氧化防御系統之間為失衡狀態。此外,HT患者的血清AGEs水平高于對照組(P=0.013),與BAP水平呈負相關(r=-0.949,P<0.001)(表2和圖2)。相反,HT患者和健康對照組之間的AOPP水平相似(P=0.214),并且與其他氧化應激標記物無關,差異無統計學意義(P>0.05)(表2)。
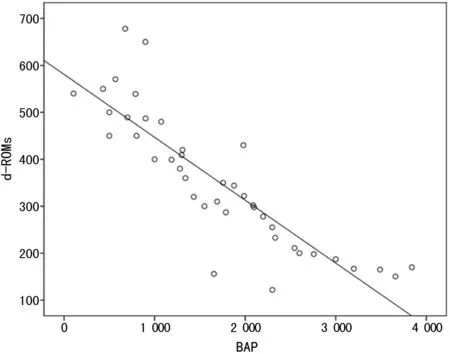
圖1 d-ROM和BAP相關性分析(r=-0.868,P<0.001)
2.3單變量及多變量分析結果 在單變量分析中,d-ROMs顯著有關的變量為血清TSH值(P=0.021)、TgAb(P<0.001),TPOAb(P<0.001),BAP顯著有關的變量為HDL-C(P=0.005),血清TSH值(P=0.033)、TgAb(P<0.001),TPOAb(P<0.001),AGEs顯著有關的變量為總膽固醇(P=0.012)和LDL-C(P=0.030)。在回歸模型中,AOPP與甲狀腺功能和自身免疫參數沒有顯著相關性。但是,在單變量分析中,AOPP水平與以下代謝參數相關:總膽固醇,LDL-C和HDL-C,三酰甘油,IMT(表3)。在多變量分析中,血清TPOAb陽性被發現是影響d-ROM、BAP水平、AGEs水平的主要獨立預測因子。此外HDL-C也是BAP水平的獨立預測因子(P=0.012,R2=2.354,95%CI:1.191~5.433),而LDL-C是AGEs水平的獨立預測因子(P=0.004,R2=1.102,95%CI:0.915~1.253)(表4)。
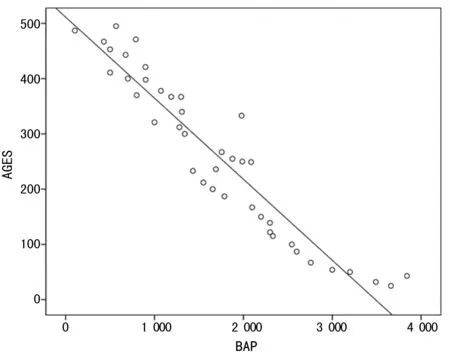
圖2 AGEs和BAP相關性分析(r=-0.949,P<0.001)表3 單變量P值分析
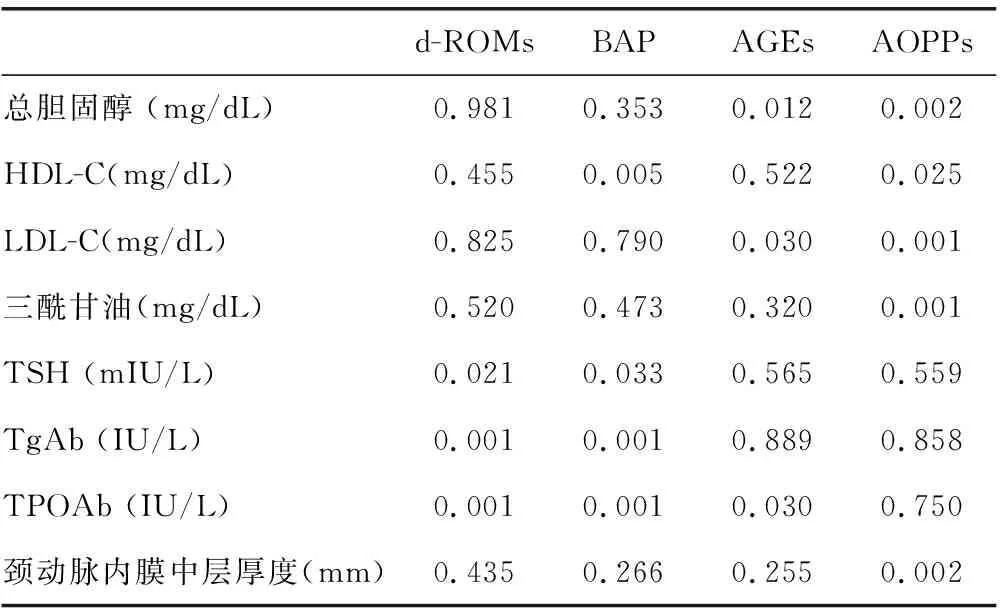
d-ROMsBAP AGEs AOPPs總膽固醇 (mg/dL)0.9810.3530.0120.002HDL-C(mg/dL)0.4550.0050.5220.025LDL-C(mg/dL)0.8250.7900.0300.001三酰甘油(mg/dL)0.5200.4730.3200.001TSH (mIU/L)0.0210.0330.5650.559TgAb (IU/L)0.0010.0010.8890.858TPOAb (IU/L)0.0010.0010.030 0.750頸動脈內膜中層厚度(mm)0.4350.2660.2550.002
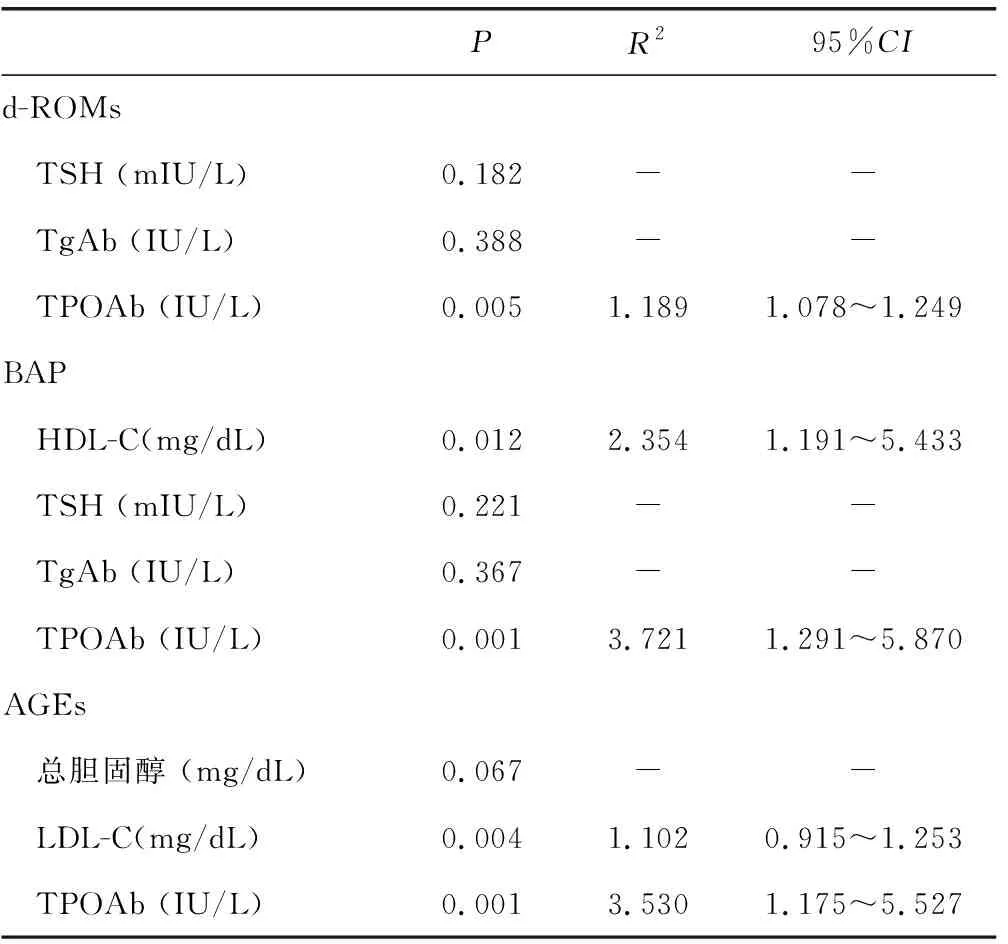
表4 多變量P值分析
注:-表示無數據
3 討 論
蛋白質構成活細胞的主要成分,其活性氧的結構修飾或脂質過氧化的終產物可導致細胞毒性和疾病發生,活性氧的形成與分解之間存在平衡,即所謂的“氧化還原穩態”。氧化應激是指體內氧化與抗氧化作用失衡,導致中性粒細胞炎性浸潤,蛋白酶分泌增加,破壞了體內氧化劑和抗氧化劑的平衡進而導致細胞損傷[8]。因此,氧化應激與幾種炎癥和免疫介導的疾病的發病機制有關,包括AITD。在AITD中,氧化應激的作用主要與甲狀腺功能障礙有關[3-4],主要是一方面增加線粒體呼吸和自由基生成,另一方面調節酶和非酶抗氧化劑(超氧化物歧化酶,過氧化氫酶,谷胱甘肽過氧化物酶和還原酶)的合成。此外,甲狀腺本身暴露于甲狀腺激素合成過程中連續產生H2O2引起長時間氧化應激[9]。并且還發現甲狀腺功能亢進和甲狀腺功能減退與增強的氧化應激相關,因為前者表現為自由基和氧化劑增加,后者降低抗氧化劑防御系統[10-11]。在此基礎上,提出了抗氧化補充劑是治療Graves′病的有效治療手段,并且認為在HT患者中同樣有效[12-13]。既往評估HT患者的氧化狀態的研究中,一項研究發現氧化劑顯著增加而抗氧化劑沒有顯著變化[14],另一項研究發現存在由氧化劑增加和抗氧化劑降低引起的氧化應激增加[15]。本研究評估了與健康受試者相比,甲狀腺功能正常的HT患者的氧化劑/抗氧化狀態,發現d-ROM顯著升高,BAP顯著降低,這與其他研究結果相同[15]。在HT患者中,血清抗氧化劑和氧化劑之間的失衡狀態,更趨向于氧化狀態,表明氧化應激可能是HT病理生理過程中的關鍵事件,與甲狀腺功能無關。
除了甲狀腺功能狀態外,本研究中的41例受試者在年齡、性別以及可能影響氧化劑/抗氧化劑平衡的主要代謝和人體測量參數方面也相似,甲狀腺自身抗體是唯一的顯著差異。因此,本研究認為,氧化應激增加主要與慢性自身免疫性炎癥相關,與甲狀腺激素水平的變化不相關。氧化應激的增加可能在甲狀腺自身免疫中起致病作用。自身免疫相關炎癥可能通過激活浸潤腺體的T和B淋巴細胞來促進甲狀腺組織中過量的ROS產生和增強氧化應激。研究證明活化的淋巴細胞釋放的Th1細胞因子誘導甲狀腺細胞產生ROS。并且活化的淋巴細胞本身也產生過量的ROS[16-17]。ROS的積累導致細胞的氧化損傷,從而引起凋亡,壞死和實質破壞的速率增加。此外,由于抗氧化潛力降低,抗氧化劑體系不足以抵抗ROS過度生產。
此外,氧化應激可能在自身免疫性疾病的發病中發揮作用。過量的ROS可能導致蛋白質、脂質和DNA的氧化修飾,其變得高度免疫原性,并可能作為新抗原,導致在遺傳易感個體中喪失自我耐受。有學者證實,HT患者中氧化應激失衡還表明環境因素與自身免疫性疾病之間的存在致病性聯系:由于環境因素(即碘過量、輻射、藥物、污染物)引起的ROS生成增加可能誘導組織蛋白質改變,或可能調節免疫系統的表達,影響自身免疫性疾病[18]。
本研究發現TPOAb存在是影響3個參數的主要獨立預測因子。在單因素分析中,TSH水平與氧化應激標志物顯著相關。但在多變量模型中,TSH并不作為發展氧化應激的獨立危險因素,證實了TPOAb的主要作用,即自身免疫。本研究還評估了AGEs和AOPP的血清水平。既往評估甲狀腺疾病氧化應激的研究中發現了不同參數,并產生了相互矛盾的結果[14-15,19]。AGE和AOPP通過蛋白質轉化形成的化合物,具有相似的形成機制和生物學作用,在炎癥過程和免疫失調時氧化應激和羰基應激導致AGE和AOPP等促炎癥代謝產物潴留,被認為是評估HT患者氧化應激的潛在新標記[20]。
AGEs由非酶糖化形成的異構活性化合物(例如戊糖胺、羧甲基賴氨酸和咪唑啉酮)組成。越來越多的證據表明,AGEs在涉及氧化應激和炎癥的其他疾病發揮作用,包括自身免疫性疾病[21-22]。AOPP是由氧化應激損傷的蛋白質(主要是白蛋白及其聚集體)組成。研究認為,AOPP和AGE是相對穩定的分子,可以通過快速和便宜的技術進行測量,成為監測氧化應激的合適標記[20-22]。本研究中,筆者發現HT患者的AGEs血清水平高于健康對照組,盡管患者的AOPP血清水平與對照組相似。這種不同結果很可能是由于病癥相關的特異性生物化學途徑(例如髓過氧化物酶途徑)的激活有關。在HT患者中,AGEs血清水平與血清抗氧化潛能(BAP)呈負相關,多變量分析與TPOAb陽性顯著相關。最后,本研究表明抗氧化劑補充可能有助于提供HT的保護。但還需要監測治療過程中的氧化應激參數,對抗氧化劑在HT患者中的治療作用做進一步研究。
4 結 論
HT患者的氧化劑增加,抗氧化劑降低,氧化/抗氧化平衡向氧化側移動。此外,HT患者中的AGEs血清水平的升高,有助于更好地界定這種自身免疫性疾病中的氧化還原穩態失調調節。AGE水平可用作HT的氧化應激的新的可靠生物標志物。

