負載型CoP NW/NF催化劑的制備及催化硼氫化鈉水解制氫性能研究
代一凡


摘要:以泡沫鎳為載體材料,采用化學氣相浴沉積法(CVD)制備了CoP NW/NF催化劑。采用能量色散X射線譜儀(EDS)、場發射掃描電子顯微鏡(SEM)、X 射線衍射(XRD)、化學吸附儀(BET)等手段對催化劑微觀物理結構進行表征,對產氫速率進行了測定。同時,考察了硼氫化鈉質量分數、反應溫度、氫氧化鈉質量分數、循環使用對催化劑性能的影響。研究表明:當硼氫化鈉質量分數為15%時,產氫速率高達 13393mL/(min·g)(30℃),此時催化劑性能最佳;反應溫度對產氫速率的影響較大,產氫速率與反應溫度基本呈正比;氫氧化鈉質量分數在20%時,產氫速率最高;該催化劑經過四次循環使用,活性仍保持在初始活性的 82.5%%,顯示此催化劑具有良好的穩定性,應用前景較好。
關鍵詞:CoP NW/NF催化劑;化學氣相浴沉積法;硼氫化鈉;水解制氫
由于可開采利用資源的逐漸減少和環境污染等問題[1-3]的日益嚴峻,迫切需要尋找一種儲量豐富的環保新能源。而氫氣作為高熱值能源(熱值120MJ·kg-1)[4],是石油熱值的3 倍,且燃燒后產物為水,是最能滿足社會經濟可持續發展及對環境友好的清潔新能源[5-7],因而其有效開發和利用成為新能源領域的熱點課題[8]。但氫氣的高效、安全存 儲或在溫和條件下快速制氫是氫能應用必須攻克 的關鍵技術.
近年來,制氫的方式多種多樣,可以通過化學方法對化合物進行重整、分解、光解、水解等途徑獲得[9-10],也可以通過電解水制氫,或者利用產氫微生物進行發酵,或光合作用來制得氫氣。在眾多制氫技術中,硼氫化鈉(NaBH4)水解制氫因儲氫密度高、產氫純度高、反應溫和、啟動快速、易于調控、安全性高、副產物可回收利用等突出的優勢[11],近年來備受關注,世界上許多研究 機構和公司都開展了對這一技術的研發工作。目前,用于硼氫化鈉水解制氫的催化劑主要有兩類:一 類是貴金屬催化劑,如:Pt、Ru、Pt - Ru/LiCoO2 ?[12-13]等;另一類是非貴金屬 催化劑,如 CoCl2、Ni - B、Co - B等[14],研究表明,貴金屬催化劑對硼氫化物水解有較好的催化活性,然而貴金屬價格昂貴,資源稀缺限制了其廣泛使用,而過渡金屬催化劑對硼氫化物水解有較好的催化活性,且不使用任何 貴金屬,成本低廉[15],因此研究開發高性能的廉價實用催化劑具有重要的現實意義和研究價值[16-17]。
本研究以泡沫鎳為載體,采用化學氣相浴沉積方法制備了負載型 CoP 催化劑,并借助XRD、SEM、EDS、ICP、XPS 等表 征手段,分析了CoP NW/NF催化劑在 NaBH4 水解制氫過程中微觀結構和表面組分的變化,研究了反應溫度、硼氫化鈉濃度、反 應 pH、催化劑循環使用素對其催化效率 的影響。剖析了催化劑在循環使用過程中的性能穩定的原因。
1實驗部分
1.1實驗試劑
泡沫鎳,400 g /m2,深圳海波綠色公司;硝酸鈷水合物(Co(NO3)2·6H2O,99%);氟化銨(NH4F,99%),;尿素;硼氫 化 鈉(NaBH4,99%)氫 氧 化 鈉(NaOH,97%),麥克林試劑公司;乙醇(CH3CH2OH,99%);鹽酸(HCl,36%),北京化工廠。實驗過程中所用 均為去離子水。
1.2 CoP NW/NF 催化劑的制備
采用化學氣相浴沉積(CUT),以硼氫化鈉為還原劑制備 CoP NW/NF催化劑,制備過程如下:
1.2.1實驗選用泡沫鎳為催化劑載體.剪取尺寸為 50 mm(L)× 20 mm(W)× 1.4 mm(H)的泡沫鎳片用濃度為3mol/L稀鹽酸超聲預處理,再用去離子水洗滌后烘干。稱量六水合硝酸鈷(Co(NO)3·6H2O)0.5948g、氟化銨(NH4F)0.186g、尿素(CO(NH2)2)0.75g溶于35ml水中,在充分攪拌后,將溶液轉移到聚四氟乙烯反應釜里,隨后將泡沫鎳傾斜放入,將反應釜放入鼓風干燥箱中(設置溫度為120°C設置時間8h)。
1.2.2磷化
取出反應釜中已吸附納米線的泡沫鎳超聲預處理,將其與已稱量的1.5g次磷酸鈉放入瓷舟中。將瓷舟放入管式爐通入N2(氣體流動速度為35mol/L)做保護氣,通過化學氣相浴沉積法(CVD)磷化,煅燒300℃,2h。
1.3泡沫鎳載?CoP催化劑的表征
用德國布魯克公司的 Bruker D8 X 射線衍射儀對樣品進行物相分析,入射光源為 CuKα 射線(λ=0.154 18 nm)連續掃描掃描速度 10(° /min)得XRD圖(圖2a);用掃描電子顯微鏡(SEM,日本日立公司的 HITACHI S -4800),加速電壓 5 kV對樣品進行形貌分 析(圖1);用透射電子顯微鏡日立H-8100觀察(TEM)圖像(圖2b、);用場發射掃描電子顯微鏡(EDX)(Nova Nano SEM 450,荷蘭產)分析樣品的元素成份(圖2c、d)。
(此處是否需要補充物相分析及表面形貌分析?)
1.4 產氫速率的測定
催化劑對硼氫化鈉產氫速率的測定通過排水法收集氣體得到。該反應的方程式為 BH - 4 + 2H2O = BO - 2 + 4H2↑
為了確保測試數據的準確性,每個條件下的測試均重復 3 次,產氫速率通過單位時間內每 克Co 產 生的氫氣體積計算,即對測量得到的氣體體積與時 間的坐標圖進行線性擬合,得到的斜率除以催化劑 中 Co 的質量,產氫速率的單位為 mL /(min·g)。本 文所使用的 CoP NW/NF?催化劑為片狀結構,平均每片質 量約 45 mg,包括泡沫鎳、金屬 ?Co 以及少量雜質的 質量。在穩定性循環測試的實驗過程中,由于存在 催化劑少量脫落的現象,質量會有 1 ~ 2 mg 的偏差。
2.硼氫化鈉水解反應的影響因素
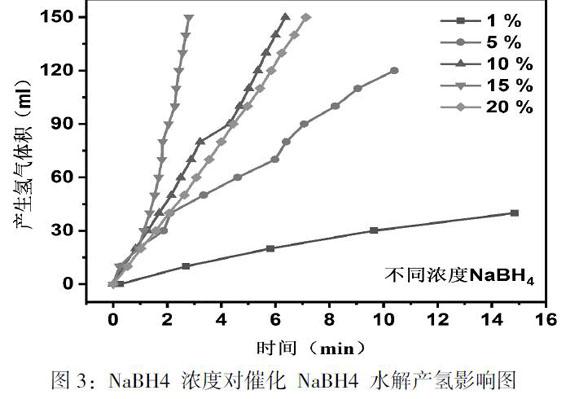
2.1 ?NaBH4濃度對催化 NaBH4 水解產氫的影響
首先固定反應溫度為30℃NaOH質量分數為 5%,催化劑的加熱時間為8h,考察不同質量分數的NaBH4(1%、5%、10%、15%、20%)對水解速率的影響。具體結果如圖3所示。
當硼氫化鈉質量分數為1%時,對應體系的 HGR 為 860mL/(min·g),說明在這個較低的反應物質量分數下,催化劑尚存在未被利用的活性區域[14-17]。當 NaBH4 質量分數分別為 5%、10%、15%時,對應體系的 HGR 分別為 4545mL/(min·g)、5890mL/(min·g)、13393mL/(min·g),由此可見,當其質量分數在此范圍增加時,HGR數值有明顯提升,說明此范圍內增加反應物 濃度對 NaBH4 水解過程有促進作用。而當 NaBH4 質量分數增加至為 20%時,對應體系的 HGR則 為 5257mL/(min·g),此時 HGR值明顯低于質量分數為15%的值。之所以幅度下降,研究發現是由于液體黏度大、離子擴散阻力大、反應副產物吸附累積等問題的存在所導致,按照這一趨勢,繼續增加 NaBH4 質量分數也很難提升水解產氫速率[14-17]。綜上研究發現,當 NaBH4 質量分數為 15%,體系的 HGR 最高,催化劑性能最佳。所以,在后續的研究中,我們一直選用質量分數為15%的硼氫化鈉。
2.2 ?Na OH濃度對催化 NaBH4 水解產氫的影響
固定硼氫化鈉質量分數為15%、的 20 mL 水溶液,反應溫度為30℃、催化劑的加熱時間為8h。不斷調整NaOH質量分數,使其分別為0%、1%、5%、10%、15%、20%、25%、30%,研究其濃度變化對水解速率的影響,具體結果如圖 4所示。
當氫氧化鈉質量分數為0%和1%時,對應體系的 HGR 分別為 1176mL/(min·g)和1644mL/(min·g),此時反應速率極低。當 Na OH質量分數分別提升至 5%、10%、15%、20%時,對應體系的 HGR 分別為 9415mL/(min·g)、4880mL/(min·g)、9954mL/(min·g)、37500mL/(min·g);當 NaOH?質量分數為 25% 和30%時,對應體系的 HGR 分別為 35714mL/(min·g)、31250mL/(min·g)。研究發現:在一定可控條件下,雖存在一定誤差,但產氫氯基本上隨 NaOH濃度的增加而提升。而當 NaOH?質量分數增加至 25% 及和30%時,此時 HGR值有所降低,表明產氫速率減小。之所以會呈現下降趨勢,是由于NaOH濃度過高時會增加溶液黏度,在一定程度上抑制 NaBH4水解,降低產氫速率。綜上研究發現:當Na OH質量分數為20%時,產氫速率最高。所以,在后續的研究中,我們一直使用此濃度的Na OH溶液進行實驗。
2.3反應溫度對催化 NaBH4 水解產氫的影響
圖5 展示了不同反應溫度(30℃、40℃、50℃、60℃)對體系 HGR 的影響。研究中,我們對數據點進行線性擬合得到,在反應溫度分別為30℃、40℃、50℃、60℃時,體系的 HGR 分別為 4196mL/(min·g)、6445mL/(min·g)、15873mL/(min·g)、56085mL/(min·g),由圖 5 可知:隨著溫度升高,NaBH4催化水解反應速率增加,反應溫度為60 ℃ 時的反應速率比 30 ℃ 時產氫速率將近增 加 12 倍。由此可見,隨著反應溫度的提高,單位時間內氫氣的生成量明顯提升,表明反應溫度對 NaBH4水解反應的影響十分顯著,升高溫度有利于促進 NaBH4 水解速率,這與文獻中的 結果一致。
2.4催化劑穩定性的測試
催化劑的穩定性是衡量催化劑性能的重要因素之一。圖 6 是CoP NW/NF?催化 NaBH4 水解制氫第1至4次循環催化后的催化行為對比圖。從圖中明顯看出,經過 四次循環使用后,CoP NW/NF的催化活性略有衰減,氫氣的總產量沒有發生較大變化,催化劑的催化活性沒有明顯下降,仍保留了相當于第一次 ?82.5%催 化 活 性。研究發現化學氣相浴沉積方法制備的CoP NW/NF催化劑中,載體與 Cop 之間有更強的相互作用而使得后者結合緊密,分散良好,不易流失,催化劑整體上具有較好的穩定性。
這說明CoP NW/NF?作 NaBH4水解制氫的催化劑有著較好的穩定性和循環使用的性能。
3 結論
(1)采用化學氣相浴沉積法成功制備了催化劑CoP NW/NF,并用于 硼氫化鈉水解制氫反應。
(2)考察硼氫化鈉質量分數對 NaBH4 溶液水解制氫的影響,研究表明:在一定范圍內增加反應物濃度對 NaBH4 水解過程有促進作用。但濃度過高時,會因為液體黏度大、離子擴散阻力大、反應副產物吸附累積等問題而降低產氫速率。當 NaBH4 質量分數為 15%,體系的 HGR 最高,催化劑性能最佳。此外,還考察了反應溫度和NaOH濃度變化對催化劑活性的影響,研究表明:體系溫度與產氫速率呈正相關;而NaOH濃度對產氫速率的影響為在一定可控條件下,產氫氯基本上隨 NaOH濃度的增加而提升,但濃度過高時會增加溶液黏度,在一定程度上抑制 NaBH4水解,降低產氫速率。
(3)對CoP NW/NF催化劑循環使用四次,測試結果表明:催化劑活性仍保持在初始活性的 82.5%%,表明載體與 Cop 之間有更強的相互作用而使得后者結合緊密,分散良好,不易流失,因而此催化劑具有較強的穩定性,應用前景較好。
參考文獻
[1]PANWAR N L,KAUSHIK S C,KOTHARI S. Role of renewable energy sources in environmental protection:A revierw[J]. Renew Sust Energ Rev,2011,15(3):1513 - 1524.
[2]ZHANG X,WEI Z H,GUO Q J,et al. Kinetics of sodium borohydride hydrolysis catalyzed via carbon nanosheets supported Co/Zr [J]. J Power Source,2013,231(1):190 - 196.
[3]DUBEY P K,SINHA A S K,TALAPATRA S,et al. Hydrogen generation by water electrolysis using carbon nanotube anode[J]. Int J Hydrogen Energy,2010,35(9):3945 - 3950
[4]JIANG H L,XU Q. Catalytic hydrolysis of ammonia borane for chemical hydrogen storage[J]. Catal Today,2011,170(1):56 - 63.
[5]楊蘭,羅威,程功臻. 氨硼烷水解制氫的研究進展[J]. 大學化學,2014,29(6):1 - 10.
[6]GHOSH T K,PRELAS M A. Energy Resources and Systems:Renewable Resources(Volume 2)[M]. Columbia:Springer,2011:495-629.
[7]LU J,ZAHEDI A,YANG C S,et al. Building the hydrogen economy in China:Drivers,resources and technologies[J]. Renew Sust Energ Rev,2013(23):543 - 556.
[8] Marrero-Alfonso E Y,Beaird A M,Davis T A,et al. Ind.Eng. Chem. Res.,2009,48(3):3703-3712
[9] 吳川,張華民.化學制氫技術研究進展 [ J] .化學進展,2005,17(3):423-428.
[10] 周潔,鄭穎平,謝吉虹.制氫技術研究進展及燃料電池中的應 用前景[ J] .化工時刊,2007,21(5):71-75.
[11] Eberle U,Felderhoff M,Schuth F. Angew. Chem. Int. Ed.,2009,48(36):6608-6630
[12]Li Y H,Zhang Q,Zhang N W,Zhu L H,Zheng J B,Chen B H. Ru-RuO2/C as an efficient catalyst for the sodium borohydride hydrolysis to hydrogen [J]. International Journal of Hydrogen Energy,2013,38(30):13360-13367
[13]Su Runhua(蘇潤華),Xiao Hui(肖慧),Lin Jianbiao(林堅標). Hydrogen generation from hydrolysis of sodium borohydride with platinum catalysts loaded on nickel foam [J]. Chinese Journal of Power Sources(電源技術),2010,34(9):919-923
[14]Xu D Y,Wang H Z,Guo Q J,Ji S F. Catalytic behavior of carbon supported Ni-B,Co-B and Co-Ni-B in hydrogen generation by hydrolysis of KBH4 [J]. Fuel Processing Technology,2011,92(8):1606-1610
[15]Tian H J,Guo Q J,Xu D Y. Hydrogen generation from catalytic hydrolysis of alkaline sodium borohydride solution using attapulgite clay-supported Co-B catalyst [J]. Journal of Power Sources,2010,195(8):2136-2142
[16] Huang X K,Wu D F,Cheng D J. Porous Co2P nanowires as high efficient bifunctional catalysts for 4-nitrophenol reduction and sodium borohydride hydrolysis [J]. J Colloid Interf Sci,2017,507:429-436.
[17] Wei Y S,Huang X K,Wang J Y,et al. Synthesis of bifunctional non-noble monolithic catalyst Co -W-P/carbon cloth for sodium borohydride hydrolysis and reduction of 4-nitrophenol[J]. Int J Hydrogen Energ,2017,42(41):25860-25868.
[18]Wei Y S,Wang R,Meng L Y,et al. Hydrogen generation from alkaline NaBH4 solution using a dandelion-like Co -Mo -B catalyst supported on carbon cloth[J]. Int J Hydrogen Energ,2017,42(15):9945-9951.
[19]王濤,張熙貴,李巨峰,等.硼氫化鈉水解制氫的研究[J].燃料化 學學報,2004,32(6):723-728.
[20]朱秋 靈,司 崇 殿,高 洪 濤.鈷催化硼氫化 鈉水解制氫研究 [J].電源技術,2011,35(1):55-58

