Akt對IL-1β誘導神經干細胞分化為多巴胺能神經元的作用
種 堔, 董美希, 劉 瑩, 范國兵, 張敏娜, 王光輝, 吳景龍
帕金森病(parkinson’s disease,PD)為ROS氧化應激損傷和炎癥因子的釋放等選擇性的造成中腦部位多巴胺能神經元變性喪失的一種神經退行性疾病。臨床治療常用左旋多巴、苯海索等藥物,不良反應較重且需長期服藥。利用干細胞增殖、定向分化和趨化性遷移等生物學屬性[1~3],有望分化形成多巴胺能神經元,取代帕金森病等神經退行性疾病變性、壞死的神經元。相關研究發現胚胎干細胞、骨髓間充質干細胞、臍帶間充質干細胞、神經干細胞和腎上腺髓質嗜鉻細胞瘤來源的未分化型PC12細胞等神經元前體細胞都具備多巴胺能神經元分化潛能[4~8],分化為成體細胞參與替代和修復受損的神經組織。誘導分子及其信號通路對分化細胞的表型作用是探索以上各類干細胞分化機制的關鍵,目前這方面報道較少。本研究通過IL-1β對大鼠神經干細胞(neutral stem cells,NSCs)誘導分化,探尋蛋白激酶B/Akt信號通路磷酸化與NSCs分化為多巴胺能神經元表型的關系。
1 材料和方法
1.1 實驗動物、試劑、主要儀器和圖像分析軟件 新生24 h Wistar大鼠培養自濟寧醫學院實驗動物中心,動物處置符合相關倫理學要求,實驗動物使用許可證編號SYXK(魯)20180002。細胞培養基DMEM/F12(1∶1)和B27神經細胞生長添加劑、青霉素及鏈霉素(Gibco 公司,美國),胎牛血清FBS(四季青公司,杭州)、EGF、IL-1β和bFGF(Peproetch 公司,美國),多聚賴氨酸和胰蛋白酶、TH(tyrosine hydroxylase) 抗體(Sigma 公司,美國),βⅢ-Tubulin(human) mAb(TU-20)來自Alexis公司,anti-phospho-Akt抗體、NSE Antibody(PA1-21081)、GFAP抗體、大鼠來源的nestin抗體來自Cruz Biotechnology公司,圖像分析軟件Motic Digital Class 1.1 /Motic Images Advanced 3.1來自美國Motic公司、解剖顯微鏡、IX71相差顯微鏡來自Olympus公司。
1.2 實驗方法
1.2.1 NSCs原代培養 清潔級24 h新生幼鼠斷頸法處死后消毒15 min。無菌操作沿顱骨縫剪開 “人”字形切口,取腦組織約5 mm×5 mm×5 mm大小(中腦腹側部位),D-Hanks 液浸洗后轉移到預冷D-Hanks 液內,分離腦膜,充分游離腦膜附著血管。D-Hanks 液再次浸洗3~5次。胰酶經5%CO237 ℃恒溫條件下消化15 min,輕柔吹打300次,400目濾網濾過后收集濾液離心鏡下計數后接種至無血清細胞培養基DMEM/F12、B27添加物、表皮細胞生長因子(EGF)、青霉素鏈霉素培養液內,接種密度1×105個/ml,培養條件為37 ℃ 5%CO295%飽和濕度恒溫培養。每3~4 d換液1次,每7 d計數傳代1次。
1.2.2 NSCs生物學屬性鑒定 nestin蛋白檢測:細胞離心機涂片后4%多聚甲醛固定30 min,行細胞免疫熒光檢測。nestin抗體工作液濃度為1∶800,封片后在熒光顯微鏡下觀察和拍照。分化能力檢測:1×105/ml接種至無血清細胞培養基DMEM/F12、B27添加物,特別加入10% FBS,分化7 d后行4%多聚甲醛固定30 min,細胞免學檢測GFAP和NSE。
1.2.3 IL-β誘導NSCs分化與免疫學檢測 取第3代培養細胞以1×105/ml密度接種48孔板內,每孔1 ml。設立10%FBS對照組,實驗組分別為A組IL-1β 40 pg/ml、B組80 pg/ml、C組120 pg/ml和D組160 pg/ml。至3.5 d半量換液,分化7 d后中止誘導,重復3組。分化7 d后中止誘導后免疫熒光檢測,隨機取6個視野,統計βⅢ-tubulin和TH表達。陽性率計算方法為細胞陽性率=陽性細胞數/DAPI陽性細胞數,重復3次實驗,取平均值記錄。圖像分析軟件Motic Digital Class 1.1 /Motic Images Advanced 3.1測量多巴胺能神經元突起,隨機記錄熒光顯微鏡高倍鏡視野突起總長度數值。
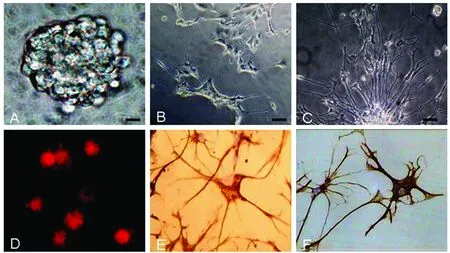
1.2.4 免疫印跡分析 濃度設置為120 pg/ml IL-β誘導NSCs 60 min、120 min、180 min和240 min。10%FBS誘導組為對照。終止誘導后,裂解液RIP 1 ml和PMSF10 μl分解分化細胞,超聲粉碎離心取上清液,加入蛋白上樣緩沖液,100 ℃10 min后,取10 g加載到10%的SDS-PAGE凝膠進行電泳,電泳分離結束后將蛋白轉至PVDF膜,時間90 min,5%脫脂奶粉封閉60 min,加入山羊抗鼠二抗與辣根過氧化物酶室溫下孵育,2 h后加入抗磷酸化Akt抗體(1∶20000),條件為4 ℃過夜,隔日取出,室溫放置60 min,TBST沖洗膜3次,ECL暗室曝光,軟件掃碼條帶灰度。β-actin 為內參,計算磷酸化的蛋白激酶B/Akt表達情況。
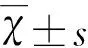
2 結 果
2.1 NSCs培養和鑒定 原代培養細胞經24 h形成神經球群落,如圖1A所示,每個神經球約有30~60個橢圓形或圓形分化細胞聚集形成;制成單細胞懸液,進行免疫熒光染色,nestin蛋白在細胞質中表達,如圖1D所示胞漿呈鮮紅熒光者即為陽性細胞;血清分化后如圖1B所示,細胞發出2~5個突起,隨時間增加,長度延長,末端見樹突棘;誘導72 h如圖1C所示突起之間連接成網狀。細胞鋪片免疫學檢測如圖1E和1F所示,NSE和GFAP在分化細胞中表達。
2.2 IL-1β誘導NSCs分化 設置10%FBS 為對照組、實驗組分A組IL-1β 40 pg/ml、B組IL-1β 80pg/ml、C組IL-1β 120 pg/ml和D組IL-1β 160 pg/ml,誘導14 d后檢測β-tubulinⅢ表達、TH的表達和神經突起長度,結果(見表1)。
2.3 IL-1β對NSCs分化過程Akt磷酸化的影響 設置IL-1β 120 pg/ml為實驗組進行誘導神經干細胞,10%FBS為對照組。實驗各組分別取60 min、120 min、180 min和240 min 四個誘導時間段,Western blot分析結果顯示實驗各組與10%FBS對照組比較,Akt磷酸化水平升高的時間為誘導60 min(P<0.01)、120 min(P<0.01)和180 min(P<0.05),誘導240 min時AKT磷酸化水平二者相比差異不明顯(P>0.05)(見圖2)。
A:細胞克隆增殖聚集形成神經球(×400);B:10%FBS 24 h神經突起開始出現(×100);C:10%FBS 72 h神經突起延長并且相互連接形成突觸狀結構(×100)D:免疫熒光顯示神經球細胞Nestin表達(SP×400);E:免疫細胞化學顯示分化細胞NSE表達(SP×400);F:免疫細胞化學顯示分化細胞GFAP表達(SP×400)
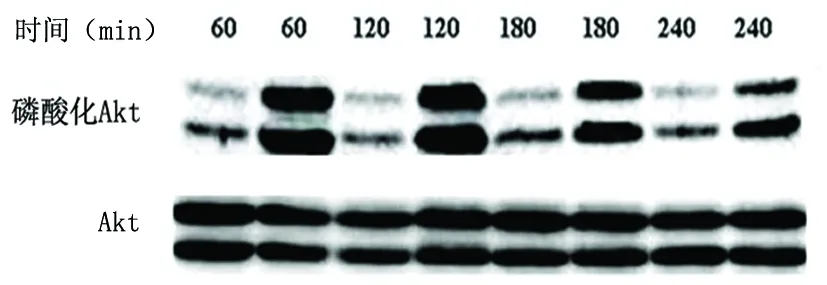
IL-1β120 pg/ml誘導NSCs后分化細胞半定量分析磷酸化Akt表達結果,與10%FBS對照組比較P<0.01(60 min),P<0.01(120 min),P<0.05(180 min),P>0.05(240 min)
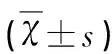
表1 NSCs誘導分化結果
3 討 論
從神經系統胚胎發育過程的相關研究中發現中腦多巴胺能經元神經元的分化過程涉及多種信號通道及細胞外信號分子、調控蛋白分子以及相關基因。Shabana[9]和Vukasin等[10]研究發現骨形成蛋白BMP/SMADs途徑激活后的神經干細胞進一步通過調節MSX1/2基因和SHH基因的表達,使多巴胺能神經元的分化表型明顯增加。另據研究顯示大腦發育形成過程中,來源于不同部位的神經前體細胞基因表型有所差異,GABA能神經元主要表達在前腦部位,而中腦是以多巴胺能神經元明顯占優勢,這種調控可能與鋅蛋白ZINC1和ZINC2參與分化平衡調控相關[11]。Varshneyd等[12]通過動物實驗研究發現雌激素受體β(ER-β)誘導神經前體細胞發育為多巴胺能神經元過程中通過Notch信號的激活發揮了關鍵作用,其研究結果表明激素及其受體參與了神經元的遷移和分化表型調控。各種細胞外信號分子的誘導下,尤其在低氧環境下,多巴胺能神經元表型分化相關編碼基因被激活,膠質細胞源性神經營養因子(glial cell derived neurotrophic factor,GDNF)、白細胞介素、腦源性神經營養因子(brain derived neuotrophic factors,BDNF)為NSCs分化為多巴胺能神經元提供體外分化信號[13~15]。本實驗中培養神經干細胞原代取材于幼鼠中腦部位,通過神經球懸浮法培養和及時傳代獲得有效的增殖細胞群落。中腦神經元分化過程中借助鋅蛋白ZINC1和ZINC2等參與表型分化平衡調控,保證了多巴胺能神經元基因表型的優勢。IL-1β作為信號分子誘導神經干細胞分化過程中神經細胞標志物β-tubulinⅢ蛋白表達以及酪氨酸羥化酶TH分化細胞(多巴胺能神經元)表達增加,進一步研究發現巴胺能神經元突起的長度隨著IL-1β濃度增加而上增加,呈現濃度依賴性。本實驗證實IL-1β是NSCs向多巴胺能神經元表型分化過程中關鍵的細胞外信號分子。
Akt作為一種靶蛋白(絲氨酸/蘇氨酸蛋白激酶)位于PI3K(磷酸肌醇3激酶)下游,構成PI3K/Akt信號傳導通路的關鍵部分,包含氨基PH 結構域(位于末端)、調節結構域(位于碳末端)和催化結構域(中心位置,絲氨酸/蘇氨酸)三部分。Akt根據結構和功能的差異分為Akt1、Akt2和Akt3 3種不同功能亞型,Akt1控制細胞增殖,Akt2與細胞遷移相關,Akt3決定細胞分化表型。Akt經磷酸化修飾后被激活后,繼而呈現瀑布式激活下游級聯信號系統以及多個靶分子位點,主要包括核轉錄因子NF-κB、caspase以及促凋亡蛋白Bad等,增強細胞代謝、促進增殖發育、抑制細胞凋亡程序的激活等生理作用[16~18]。研究表明缺氧條件下、BDNF腦源性神經營養因子和血管源性神經營養因子等細胞因子通過磷酸化激活PI3K/Akt信號通路介導了NSCs自我復制增殖和神經元方向的定向分化[19,20]。本實驗研究發現中IL-1β誘導后Akt 的磷酸化水平顯著升高,尤其是誘導后60 min 和120 min 磷酸化水平明顯升高,過后隨著時間延長表達水平降低。本研究提示Akt 磷酸化修飾可能參與細胞外信號分子IL-1β對NSCs分化調節過程,通過上調磷酸化Akt的表達促進NSCs向多巴胺能神經元表型轉化。

