miRNA-126對非小細胞肺癌細胞功能的影響及相關機制研究
郭金云,王玉偉,孫偉民,潘瑩,姜匯涓
肺癌是臨床上常見的惡性腫瘤,具有較高的發病率和死亡率,近年來呈上升趨勢,其中非小細胞肺癌占肺癌的80%~85%,嚴重危害著人們的身體健康[1]。對肺癌患者來說,早期診斷比較困難,一旦確診已經處于晚期。故靈敏度和特異度較高的診斷標志物對診斷肺癌至關重要。miRNA是一種小分子RNA,屬于內源性的非編碼單鏈,大量實驗表明,miRNA在腫瘤的發生和發展中,發揮著重要作用,參與細胞的增殖、凋亡、遷移以及侵襲等,起著癌基因以及抑癌基因的效果[2-3]。研究發現,肺癌組織以及癌旁組織中miRNA-126表達異常,miRNA在肺癌細胞中轉染后,明顯抑制了細胞的增殖能力。因此,研究其相關作用機制,對肺癌患者的早期診斷、早期治療都有著重要意義。現探討miRNA-126對非小細胞肺癌細胞功能的影響及相關機制,報道如下。
1 材料與方法
1.1 材料 (1)細胞:非小細胞肺癌A549細胞購于武漢博士德生物工程有限公司,miRNA-126引物購于Invitrogen公司。(2)主要試劑:羊抗鼠EGFR、AKT、mTOR抗體(武漢博士德生物工程有限公司提供);DMSO溶液、PBS緩沖液、胰蛋白酶(均由Selleck公司提供),MTT試劑盒、DAB顯色試劑盒(北京中杉金橋生物技術有限公司提供)。(3)儀器設備:DMi8倒置熒光顯微鏡(德國徠卡)、酶標儀(美國伯騰儀器公司)、離心機、流式細胞儀(均購自美國Invitrogen公司)。
1.2 實驗方法 2015年3—5月在遼寧省葫蘆島市中心醫院實驗室進行實驗。
1.2.1 細胞培養: 將凍存的非小細胞肺癌A549細胞取出后,快速地采用40℃的溫度火浴,迅速搖晃均勻至融化,加入2 ml的培養基(10%PBS,10%~15%胎牛血清56 ml,1% 雙抗(青鏈霉素)5.56 ml,RPMI-1640培養基500 ml),1 000 r/min 離心5 min棄上清液,使用完全培養液重懸,之后進行傳代至培養瓶中,培養基加至5 ml,在CO2培養箱中培養(濕度飽和95%,溫度37℃,CO2濃度5%),第2天換液,當培養瓶中細胞融合率達到80%~90%進行傳代。
1.2.2 細胞轉染: 分組依據是轉染不同類型的質粒,分為空白對照組和miRNA-126轉染組。空白對照組加入PBS溶液1 μl和DMSO 1 μl。miRNA-126轉染組操作:培養瓶中細胞融合率近75%時,胰酶消化,新鮮培養基終止消化后,細胞計數法測量消化后培養瓶中細胞密度后,每六孔板中種植約4×105個細胞,加新鮮培養基至3 ml;37℃、5%CO2培養箱中孵育至細胞融合率近40%~80%;取質粒DNA 1.5 μg溶于不含血清及雙抗的培養基100 μl中,混勻后離心至EP管底;再加入PolyFect Reagent 12 μl至EP管中,上下顛倒5次,混勻;室溫靜置5~10 min,促進轉染復合物形成;吸去六孔板中的培養基,加入新鮮完全培養基3 ml,完全培養基(含血清及雙抗)600 μl加入含轉染復合體的EP管中,上下顛倒2次,再加至六孔板中,水平搖晃促使轉染復合物均勻分布;培養24h后常規換液,繼續培養24 h后倒置熒光顯微鏡下觀察GFP類的熒光亮度,收集細胞提取RNA進行轉染效率鑒定。采用流式細胞儀得出轉染效率最高的質粒組及空載組稀釋液1 ml,接種于10 mm2培養皿中,每孔加入嘌呤霉素(100 μg/ml)40 μl,常規培養3 d后棄培養液,將經過篩選的剩下的細胞消化并稀釋后接種到24孔板中,建立穩定轉染的miRNA-126組。
1.2.3 RT-PCR檢測非小細胞肺癌細胞中miRNA-126基因的表達: 采用熒光定量RT-PCR技術進行檢測,嚴格按照定量PCR儀的操作說明書進行。首先加入稀釋10倍的PCR緩沖液2.5 μl,然后加入MgCl2溶液1.5 μl以及上游引物和下游引物0.5 μl,最后加水配成混合溶液總體積為25 μl。將混合溶液25 μl放置在94℃、55℃,72℃環境中各1 min,3 min一個循環,連續進行30個循環,72℃環境中反應延長5 min,重復最少3次。觀察時間定位24、48和72 h,采用2-△△Ct方法計算miRNA-126基因的表達水平。
1.2.4 MTT比色法檢測非小細胞肺癌細胞增殖能力: 將進行培養后的細胞制成細胞懸液,然后接種于96孔的培養板中,在每一個孔均加入細胞懸液90 μl,觀察時間定位24 h、48 h和72 h,每一個細胞組分別設置2個復孔,空白對照組孔中加不含細胞的培養基。參照組細胞在每孔中加入培養液10 μl,然后按照3個不同時間進行細胞培養。待所有細胞組培養到相應的時間后,在每孔中加入MTT 20 μl繼續孵育4 h,將孔上的上清液仔細吸取,然后在孔中加入DMSO 150 μl,振蕩10 s,采用酶標儀測定波長為570 mm的細胞組OD值,按照腫瘤細胞增殖率計算公式:增殖率=(細胞組OD值/參照值-1)×100%,對非小細胞肺癌A549細胞增殖率進行計算。
1.2.5 流式細胞儀檢測非小細胞肺癌細胞凋亡: 將2組細胞傳代到2孔板中,置于溫度為37℃,濃度為5%二氧化碳的飽和濕度環境下培養24、48和72 h,加入濃度為0.25%胰蛋白酶進行消化,用離心機以2 000 r/min 速度離心5 min后收取細胞,然后使用PBS緩沖液洗滌3 min,重復洗滌2次,再次用離心后收集細胞,加入1MlPI染液,在避光常溫環境中放置1 h后,然后用特異熒光標記后,在鞘液包裹下高速流動,流動期間會發射出光子,嚴格按照流式細胞儀檢測,利用發光信號測量儀檢測光子數值,到達檢測細胞凋亡的目的。
1.2.6 Transwell檢測非小細胞肺癌細胞侵襲能力: 將非小細胞肺癌A549細胞轉染48 h之后,使用Transwell試劑盒觀察細胞侵襲能力。每組選3個復孔,先用胰酶消化細胞,之后使用PBS緩沖液清洗1~2次,用10 g/L的BSA重懸細胞,將細胞密度調整至1×105個/ml,取細胞懸液150 μl加入到Transwell小室中,培養24 h,之后乙醇固定5 min,使用結晶紫溶液染色30 min,在倒置顯微鏡下觀察計數穿膜細胞。
1.2.7 倒置顯微鏡觀察非小細胞肺癌細胞遷移能力: 將非小細胞肺癌A549細胞接種到18孔板中,將細胞增長到90%時,使用100 μl的槍頭,垂直劃出3條直線。之后經過PBS緩沖液進行清洗2~3次,分別加入0.5%的血清培養基,觀察24 h之后,使用倒置顯微鏡觀察各組細胞的遷移變化。
1.2.8 倒置顯微鏡觀察非小細胞肺癌細胞形態: 將非小細胞肺癌細胞傳代到6孔板中,加入25%的胰蛋白酶,消化5 min后,用離心機以2 000 r/min的速度離心5 min后取上清液,用37℃的PBS緩沖液洗滌3 min,重復2次后,再次用離心機以2 000 r/min的速度離心5 min后取上清液,接著加入濃度為95%的4℃乙醇,放置15 min,用離心機以1 000 r/min的轉速分離,去除上清液,PBS重懸細胞,將細胞密度調至為(0.5~2.0)×106/ml,去除細胞懸液后加入2 μl的Hoechst33258染液進行染色10 min,最后置于載玻片上,加上蓋玻片,采用倒置顯微鏡對細胞形態進行觀察。
1.2.9 Western Blot檢測非小細胞肺癌細胞中相關表皮生長因子受體(EGFR)、AKT、哺乳動物雷帕霉素靶蛋白(mTOR)表達: 將采集到的細胞,使用PBS緩沖液清洗3遍以上,分離緩沖液,加入IP細胞裂解液,進行裂解35 min,將雙蒸水浸泡過的細胞置于EP管中保存,溫度為5℃,使用離心機1 000 r/min速度離心20 min,分離上層血清,提取血漿,在-80℃環境中保存、待用。通過SDS-PAGE凝膠進行電泳,加入適量濃縮的SDS-PAGE蛋白緩沖液15 min;100 V,電泳10 min,結束之后,將電轉膜浸泡在10%牛奶中,在37℃環境下的搖床上封閉1.5 h;與一抗結合,加入TBST稀釋按(1∶1 000)稀釋一抗,在4℃的環境下孵育過夜保存;第2天用TBST緩沖液清洗,與二抗結合在室溫下孵育1 h,再次用TBST緩沖液清洗反復清洗。最后將其僅在底物溶液中進行顯色,采用BCA法測定蛋白濃度,嚴格按照BCA蛋白定量試劑盒操作說明書進行,分析灰度值,目的蛋白條帶灰度值/內參條帶灰度值=目的蛋白相對表達量。
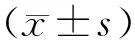
2 結 果
2.1 miRNA-126相對表達量比較 miRNA-126轉染組miRNA-126水平顯著高于空白對照組 (P<0.01);空白對照組24 h、48 h、72 h的miRNA-126的相對表達量差異無統計學意義(P>0.05);miRNA-126轉染組72 h的miRNA-126相對表達量顯著高于48 h和24 h,差異均有統計學意義(P<0.01),見表1。
2.2 細胞增殖率和凋亡率比較 miRNA-126轉染組細胞增殖率顯著低于空白對照組,凋亡率顯著高于空白對照組,差異均有統計學意義(P<0.01);miRNA-126轉染組72 h的細胞增殖率顯著低于48 h和24 h,miRNA-126轉染組72 h的細胞凋亡率顯著高于48 h和24 h,差異有統計學意義(P<0.01),見表2。

表1 2組各時點miRNA-126相對表達量的比較
2.3 細胞侵襲、遷移能力比較 miRNA-126轉染組劃痕寬度寬于空白對照組,侵襲細胞數顯著低于空白對照組,差異均有統計學意義(P<0.01),見圖1(插頁Ⅱ)。經過miRNA-126刺激后,非小細胞肺癌細胞體外遷移能力發生變化,遷移的細胞個數顯著減少,劃痕面積減少,見圖2(插頁Ⅱ)。經過miRNA-126刺激后,非小細胞肺癌細胞體外侵襲能力發生變化,侵襲的細胞個數顯著減少。說明,miRNA-126可以抑制非小細胞肺癌細胞侵襲和遷移。見表3。
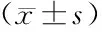
表3 2組細胞侵襲、遷移能力的比較
2.4 EGFR、AKT、mTOR表達的比較 miRNA-126轉染組EGFR、AKT、mTOR表達量顯著低于空白對照組,差異有統計學意義(P<0.01),見表4。
3 討 論
肺癌的主要類型是非小細胞肺癌,其特點是在發病早期診斷率較低,一旦發現,多數患者已經處于Ⅲ~Ⅳ期,導致患者病死率極高[4-6],研究顯示,肺癌發病的機制尚未明確,但發病原因很多[7]。在治療早期肺癌最有效的方案是做到早發現、早治療,同時還可以提高患者的存活時間,但是就我國治療肺癌的情況來看,費用較高、難度大、治療的時間較長,操作也復雜[8-10]。非小細胞肺癌診斷金標準是對惡性細胞進行病理診斷,主要采取侵入性診斷方式,包括支氣管鏡、肺穿刺以及開胸手術等[11]。對于早期階段的肺癌患者主要采取胸部X線和CT掃描,但是檢出率較低,輻射對患者的危害也較大,通過痰細胞學檢測和灌洗支氣管肺泡篩查非小細胞肺癌,并不是十分有效[12]。血清標志物檢測的敏感度和特異度不太高,但是miRNA對于早期的非小細胞肺癌診斷帶來了希望。

表4 2組EGFR、AKT、mTOR的表達比較
微小核糖核酸(miRNA)由眾多的小RNA組成,主要作用是促進細胞的增長、增殖和凋亡,促進從細胞到組織再到器官的轉變和形成,以及對人身體的生長發育起到重要的作用[13]。隨著醫學研究的不斷深入,大量專家學者發現miRNA不僅在人體生理過程中發揮作用,而且在眾多疾病的發展中也起到了重要作用,例如癌癥的擴散和轉移都與miRNA有著緊密的聯系。大量研究顯示[14-15],肺癌腫瘤的分化、轉移、侵襲與miRNA的異常表達有密切聯系,比如miRNA21在肺癌患者體內顯示高表達,并且與淋巴結的轉移和腫瘤的發展有關;miRNA141表達異常會對肺癌的癌細胞增殖和轉移產生影響。
miRNA-126主要存在于EGFL7基因的啟動內含子中,其高甲基化會影響miRNA-126的表達水平,但是過表達的miRNA-126或者對ADAM9抑制表達,都會下調EGFR/AKT信號,影響活化[16]。從而達到抑制癌細胞體外遷移的作用。現在臨床上,對于miRNA-126在非小細胞肺癌中的作用機制相關研究少,數據顯示[17-18],miRNA-126對SLC7A5進行靶向作用,對H69細胞G1期具有延遲的效果,起到抑制癌細胞的作用;miRNA-126對Crk蛋白的水平表達有介導作用,
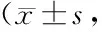
表2 2組各時間段細胞增殖率及凋亡率的比較%)
對肺癌細胞的侵襲和遷移起到抑制效果。有學者認為[19],miRNA-126通過影響VEGF水平表達,抑制細胞增殖。本結果顯示,通過轉染miRNA-126,在非小細胞肺癌中顯示表達過量,影響非小細胞肺癌細胞的增殖、遷移和侵襲等,并且起到了顯著的抑制效果。
非小細胞肺癌的浸潤及轉移是一個復雜的、多步驟的、多個相關基因共同參與的過程。表皮生長因子(EGFR)是一種與細胞增殖和信號傳導有關的受體,在惡性腫瘤細胞中,EGFR發揮著重要的作用,影響腫瘤細胞的增殖、凋亡,有助于新生血管的形成,細胞運動能力得到顯著提高[20-22]。如果EGFR表達異常或者發生突變,都會導致癌癥的發生。EGFR作為一種跨膜糖蛋白,其具有配體介導酪氨酸激酶活性的多功能作用。EGF與EFGR高親和力結合一起作用,EGFR被磷酸化會發生級聯放大反應,下游相關的信號通路會被激活,其中包括和磷脂酰肌醇有關的PI3K/Akt通路,在細胞內的信號轉導中直接參與,在細胞的增殖和分化中具有重要意義。AKT是一種臨床上較為常見的絲/蘇氨酸蛋白激酶,P-AKT則是磷酸化的AKT,P-AKT具有一定的生物學活性,因為其蛋白產物與蛋白激酶A、蛋白激酶C具有高度的同源性,所以臨床上又稱之為蛋白激酶B(PKB)[23-25]。P-AKT能夠通過對人體各種下游分子產生作用,從而調控細胞周期,促進細胞的增殖,抑制細胞的凋亡,進而對腫瘤的生物學進展產生影響[26]。EGFR主要的下游信號有PI3K/AKT、STAT3等,研究顯示,EGFR在肺癌中過表達的發生率在37%~60%,與患者的分期有關,分期越晚,EGFR表達越高,說明其與肺癌的發展有緊密聯系[27]。哺乳動物雷帕霉素靶蛋白(mTOR)屬于Akt的下游信號因子,在調控PI3K和蛋白激酶B(PI3K/Akt)過程中發揮著關鍵性的作用[28]。本結果顯示非小細胞肺癌經過miRNA-126轉染,EGFR、AKT、mTOR的表達水平顯著降低。EGFR、AKT、mTOR途徑在非小細胞肺癌細胞增殖、凋亡、侵襲以及遷移過程中,發揮著重要的功能。分析可能原因:EGFR表達上調且發生激活就會形成pEGFR,會造成mTOR被激活。mTOR是PI3K/Akt信號通路的直接作用底物,起到的主要作用是對細胞營養能力以及氧化有關信息進行整合,調控細胞生長,是蛋白合成的關鍵性調控點。在細胞組織中EGFR表達上調,p-Akt也隨之上調,通路活性升高;當EGFR表達下調時,其通路的活性隨之降低。EGFR是Akt下游的作用底物,當mTOR活性發生變化,Akt也隨之改變[29]。在一定的環境下,通過激活EGFR/AKT/mTOR信號通路對細胞的生長和抑制起到調控的作用,成為分子變阻器,促進細胞基質的相互作用,促進產生活性氧,最終的結果是影響非小細胞肺癌細胞功能[30]。
綜上所述,轉染的miRNA-126通過調控EGFR、AKT、mTOR表達,抑制非小細胞肺癌細胞增殖、凋亡、侵襲以及遷移能力,為非小細胞肺癌患者臨床治療提供理論依據。
利益沖突:無
作者貢獻聲明
郭金云、王玉偉:設計研究方案,論文撰寫;孫偉民、潘瑩、姜匯涓:實施研究過程,資料搜集整理

