蛋白和肽類物質跨血腦屏障轉運研究進展
解一舟,李玉珍,朱 慧,李宏強
(北京建生藥業有限公司,北京 100039)
近幾十年來,隨著人類平均壽命的增加及生活習慣、生活環境改變等因素,人類神經系統疾病的患病率正在逐年升高[1],根據國內流行病學統計分析,我國顱內腫瘤的患病率為32/10萬人,平均年發病率為66/10萬人,并呈逐年上升的趨勢[2-3]。從理論上講,藥物要首先應能通過血腦屏障(blood-brain barrier, BBB)并在中樞神經系統(central nervous system, CNS)中達到一定的血藥濃度,才能發揮一定的作用。在Kastin證明促腎上腺皮質激素(adrenocorticotropic hormone, ACTH)等肽類物質可完整穿越BBB之前,學術界普遍認為肽類物質不能穿越BBB,隨著BBB研究的不斷深入,越來越多的可跨BBB轉運的肽類物質被報道[4]。一些具有脂溶性、一定分子量及特定電荷的小分子物質能夠直接從血液擴散穿越BBB進入CNS,極大部分的大分子物質,如重組蛋白等均難以通過擴散的途徑穿越BBB[5]。目前已知的跨BBB轉運的機制主要包括以下幾種:(1)水溶性小分子及其他生命活動所必需的的營養類物質,如氨基酸、葡萄糖等,通過血管內皮細胞血管腔面與基底側上的轉運受體穿越BBB;(2)多肽或蛋白類物質可以通過吸附介導轉運、受體介導轉運或載體介導轉運等途徑實現跨BBB轉運;(3)小分子量脂溶性物質可經被動擴散途徑跨BBB轉運進入腦內[4]。盡管經過了數十年的研究,如何使藥物高效地穿越BBB依然是治療CNS疾病的藥物研發的難點。由于BBB結構的復雜性,通常需要建立體外模型來開展諸如藥物跨BBB轉運等研究,文中也會介紹主流的模型及裝置,如Transwell裝置、NV生物反應器等,同時也比較了它們的優缺點及應用,便于根據不同研究目的選擇合適的模型或裝置。
肽(peptide)是α-氨基酸以肽鍵連接在一起而形成的化合物,通常指的是100個氨基酸以下的大分子物質,多肽通常也是蛋白質水解的中間產物。在哺乳動物體中,肽類物質主要由外周臟器或CNS產生,如胰島素(insulin)、胰高血糖素(glucagon)可調節血糖濃度,神經肽作為CNS的遞質在大腦的不同部位發揮著不同的生理作用,如痛覺、睡眠、情緒、學習、攝食、痛覺等均有調節作用,另外,神經系統本身的分化和發育也受神經肽的調節。
1 已發現的可通過BBB的多肽或蛋白類物質
1.1 神經營養因子
神經營養因子(neurotrophin, NT)對CNS的創傷性、退化性和缺血性疾病均具有治療潛力,如NGF、NT-3、NT-4/5及腦源性神經營養因子(brain derived neurotrophic factor, BDNF)均可被選擇性地輸送至腦內[5],而另外某些神經營養因子卻不能跨BBB轉運,如人類膠質細胞衍生神經營養因子(human glia-derived neurotrophic factors)等[6]。
1.2 神經營養肽
上表皮生長因子(epidermal growth factor, EGF)[7]神經生長因子(nerve growth factor, NGF)、的胰島素樣生長因子(insulin-like growth factor, IGF)[8]等神經營養多肽(neurotrophic peptides)可通過飽和運輸系統穿越BBB,堿性成纖維母細胞生長因子(basic fibroblast growth factor)可能通過吸附胞吞的作用跨BBB轉運[9]。EGF是通過結合一個170 kD的酪氨酸特異性蛋白激酶(tyrosine-specific protein kinase)來向腦內運輸的[10]。
1.3 細胞因子
細胞因子(cytokine)具有調節固有免疫和適應性免疫、細胞生長以及損傷組織修復等多種功能。白血病抑制因子(leukemia inhibitory factor)通過飽和轉運系統或原位腦灌注跨BBB轉運至腦內[11],可以改變NT-3的表達、減少少突細胞的死亡,也可用于改善盧伽雷病的癥狀[12]。
1.4 作用于攝食行為的多肽
一般情況下,瘦素(leptin, LP)會被完全轉移至大腦中,此類多肽是LP作用的主要受體。其在下丘腦的核團上高度表達,而這些核團具有調節攝食與體重的功能,在一些外周組織如心、肺、淋巴結中也有表達。短受體在多種外周器官中選擇性地表達[13]。這類多肽在體內表達最廣泛,其他多肽如胰肽(pancreatic polypeptide)、促腎上腺皮質激素釋放激素(corticotropin releasing hormone, CRF)是通過飽和轉運系統轉運[14],甘丙肽樣肽(galanin-like peptide)[15]、食欲肽A(orexin-A)[16]等都是通過非飽和途徑轉運的。
1.5 阿片肽
阿片肽是免疫系統中重要的調節因子,它幾乎作用于所有的免疫活性細胞,對不同亞類的細胞作用卻不盡相同,阿片肽可能是應激引起免疫調節的介質。阿片肽、甲硫腦啡肽都是通過肽傳輸系統-1(peptide transport system-1)轉運的[17],也可以通過改變化合物的理化性質來實現跨BBB轉運[18]。
1.6 激素或其他蛋白
CRF是通過飽和轉運系統來影響垂體及下丘腦產生腦內啡的[19],在大腦中存在一個胰島素(insulin)的飽和轉運系統,受體相關蛋白(receptor-associated protein)也可以透過BBB轉運至腦組織。抗原結合片段(fragment of antibody binding,FAB)、單克隆抗體(monoclonal antibody,MAb)、IgG、白蛋白(albumin)、P-糖蛋白(P-glycoprotein)、腦啡肽、糖肽等蛋白也可通過改變BBB通透性或化合物的理化性質來實現跨BBB轉運[20]。
2 多肽類物質的轉移機制
外周注射入血的多肽類物質透過BBB的機制主要是不飽和的跨膜擴散,如δ-促睡眠肽(delta-sleep-inducing peptide,DSIP)及其類似物、類固醇類等藥物,跨BBB轉運能力主要取決于藥物的脂溶性[5]。隨著研究的不斷深入,越來越多的實驗數據證明,較脂溶性,氫鍵鍵能對多肽類物質透過BBB的影響更大[21],同一種多肽,氫鍵構象的改變可引起氫鍵鍵能的改變[22],所以親水性較強的DSPI也能跨BBB轉運。某些多肽如亮氨酸腦啡肽、精氨酸加壓素、黃體生成素釋放激素等還可以通過飽和轉運系統來透過BBB,這種機制被稱為肽轉運系統[23],在BBB中,區域差異(大腦的不同區域)也會影響到的肽或蛋白質向腦內的傳輸[24]。大多數親水性多肽的擴散能力是有限的,然而,選擇性飽和轉運系統通常能夠更高效的運輸一些親水性多肽[14],轉運機制又可細分為吸附介導轉運、受體介導轉運、載體介導轉運等多種形式,吸附介導轉運中的胞吞作用的強弱與多肽的帶正電部分和帶負電的細胞膜表面之間的靜電作用大小有關[25]。吸附介導轉運易受到聚L-賴氨酸、丹酰尸胺、魚精蛋白[26]等的抑制。受體介導轉運具有更高的親和力及底物特異性,但是傳輸能力較吸附介導轉運低[13]。載體介導轉運運輸能力的強弱與具有交叉抑制活性的結構性配體有關[14]。此外,依附于蛋白上的IGF及其聚合物也會影響多肽跨BBB轉運的能力[6]。大腦內不同區域的酶活力是不盡相同的,這就為我們提供了一種通過調節進入大腦不同區域物質的量來調節多肽類物質穿越BBB的方法[27]。通常情況下,可能只有很少量的肽類物質可以跨BBB轉運至CNS內,但足以引起一定的生理反應。
3 改變大分子肽類藥物跨BBB能力的途徑
多肽或蛋白類藥物在CNS疾病的治療中具有一定的意義,經常會因BBB的屏障作用難以在腦內達到有效血藥濃度而影響藥物的療效。因此,提高藥物穿越BBB的能力顯得尤為重要。
3.1 滲透性BBB開放
最直接的方法就是對BBB進行可逆性的開放[28],最常用的方法是在頸動脈注射如甘露醇、阿拉伯糖等高滲溶液(即滲透性休克),能使伊文思藍跨BBB轉運并對腦組織進行染色,1988年Neuwelt等通過滲透性開放BBB的實驗證明了FAB或MAb均可以通過此方法進入腦組織,但同時,這種非特異性的方法也會讓一些有害物質進入到腦內[20]。
3.2 改變藥物的理化性質
多肽類物質跨BBB轉運的能力與多肽的親脂性、分子大小、氫鍵鍵能等有關。一般來說,親脂性越強,穿透能力也越強,氫鍵鍵能越低,穿透能力越強,因此,可以通過改變多肽的物理化學性質來提高多肽類藥物通過BBB的能力。一系列實驗證明降低氫鍵鍵能可以提高P-糖蛋白(P-glycoprotein)的跨BBB轉運量[29],糖基化的方法可提高阿片肽跨BBB轉運的量以期增加藥效[30]、腦啡肽、糖肽、阿片肽等通過聚乙二醇化[18]的方法可提高其跨BBB轉運的能力,神經生長因子(nerve growth factor, NGF)和IgG糖基化后的跨BBB能力均有明顯提高[21],胰島素(insulin)、白蛋白(albumin)、IgG經聚酰胺修飾后跨BBB的轉運能力會大大增強[31],脂質體、免疫脂質體的應用也是這一想法的延伸。另外,腦毛細血管內皮帶有負電荷,因此可以使多肽帶正電荷以提高其跨BBB能力,總之,在改變多肽的物理化學性質的同時要保留或增強其療效,需要進行更加深入的研究。
3.3 借助藥物轉運載體
將多肽與特殊的載體結合,可以提高其跨BBB轉運的能力。最近十幾年,陸續有文獻報道,用腺相關病毒,逆轉錄病毒,單純皰疹病毒以及牛痘病毒等作為載體CNS疾病,如神經退行性疾病、腫瘤及中風[32],在此過程中用甘露醇打開BBB通道以增加轉運的量[33],病毒載體與神經營養蛋白相結合可以促進背根神經軸突到脊髓等細胞定位再生,如NT-3可借助腺病毒作為載體提高轉運能力[34]。轉鐵蛋白、低密度脂蛋白、胰島素等及其受體、抗體也可以作為多肽類藥物跨BBB的轉運載體[26, 35],此外,如陽離子化的人血清白蛋白 (human serum albumin)[36]、轉鐵蛋白的單克隆抗體OX26[37]都可以作為良好的腦藥物轉運載體,最新的研究發現細胞穿透肽(cell penetrating peptides, CPP)、蛋白質轉導域(protein transduction domain, PTD)能促進細胞對其所攜帶的各種物質的攝取[38],因此將多肽類藥物制成納米顆粒并且通過與CPP或PTD的結合達到跨BBB轉運的目的成為了一個研究熱點。
4 血腦屏障體外模型及體外裝置
BBB的結構十分復雜,因此其通透性的研究常常借助體外模型來實現。通過查閱文獻,可以將體外模型大致劃分為靜態模型和動態模型兩種類型,這兩種類型又可以細分為不同的類型。
4.1 靜態模型
靜態模型根據所培養細胞種類的不同,大致可分為單層模型及共培養模型[39],因其不能模擬在體內環境下血液流動產生的切應力,故其更適用于研究信號通路、轉運動力學、高分子篩以及結合親和力的測量、細胞與細胞間、細胞與內環境間的相互作用等的研究,其突出的優點為操作簡單。
4.1.1 單層模型
將單一類型的內皮細胞[40]如腦微血管細胞(brain microvascular endothelial cells, BMEC),培養于Transwell膜上所構建的BBB模型,基本可模擬BBB功能,牛、豬等大型動物細胞比大鼠更適合建立體外BBB模型[41]。單層模型根據培養細胞來源的不同主要有腦微血管碎段模型[41]、MDCK細胞模型[42]、永生化細胞模型[43]、原代BMEC模型等。單層模型的關鍵是要對細胞進行純化,常見的純化方法有篩網過濾、差速貼壁及搖床振搖[44]、免疫磁珠純化、Percoll離心純化等[45]。
4.1.2 共培養模型
為避免單獨培養的細胞喪失BBB的活性,加入其他細胞尤其是星形膠質細胞能更好地模擬在體環境[46]。下面以三種共培養模型舉例:(1)微血管內皮細胞+星形膠質細胞共培養模型,其表現型較單層模型更接近于體內生理狀態[47],因此能較好地模擬在體環境,是目前應用最廣泛的模型。(2)腦微血管內皮細胞+星形膠質細胞+周細胞共培養模型,由于加入了周細胞,較前一種模型可更好地模擬在體狀態,通過測量上皮電阻(trans-epithelial electric resistance, TEER)、熒光素鈉通透性、堿性磷酸酶及γ-谷氨酰轉肽酶的表達等來評價屏障功能[48]。(3)原代培養腦微血管內皮細胞+周細胞模型,此模型缺少星形膠質細胞的功能支持,較少使用,可用于研究兩種細胞間的相互作用。此外,BMEC還可以與神經元或其他細胞共培養制備BBB模型,如由BMEC與膠質細胞、海馬神經元共培養制備而成的靜態三維模型可用于藥物篩選。
4.2 動態模型
在體內正常生理狀態下,血流流動產生切應力,能夠影響內皮細胞的屏障功能,降低單層腦微血管內皮細胞對藥物的滲透率。下面介紹三種常見的能夠模擬切應力的BBB體外模型:(1)錐板裝置模型,利用圓錐旋轉來產生一定的切應力[49],切應力受角速度和錐角大小的影響。(2)體外BBB動力學模型,模型中的中空纖維膜可產生一定的切應力,同時模型中也可以共培養其他類型的細胞,用輸氣管系統實現氣體交換來維持微環境的穩定,可用于研究各種CNS疾病的病理生理學,如腦缺血再灌注損傷和癲癇等的改變[50]。(3)三維動力學模型,該模型用變速泵輸入液體產生切應力,切應力的產生裝置由兩個互相垂直的中空纖維管組成,多孔膜內外兩側接種細胞并放置多個Ag/AgCl電極[51],輸氣管實現O2和CO2交換。其為轉運遷移實驗的首選,也可應用于神經血管的研究、BBB內信號傳導的研究[52]。
除以上所介紹的模型外,很多學者基于細胞層面進行BBB體外模型裝置的研發,以期在體外條件下再現BBB的結構、功能和特性,常見BBB體外模型優缺點及其應用詳見表1。
5 總結
外周與大腦的大部分交流要依賴BBB。隨著神經科學、遺傳工程技術、多肽蛋白分子三維結構預測及多肽蛋白分子相互作用研究的不斷深入,將會有更多的治療CNS疾病的多肽或蛋白類物質將被發現并開發成可用于臨床的藥物。每年有上千種具有生物活性的多肽類物質從動物或細菌中被提取出來,天然多肽又可以通過基因工程、酶工程、糖基化、納米化等方法進行修飾或克隆,從而獲得更多的應用,因此,為增強多肽類藥物跨BBB轉運的能力,對藥物進行必要的化學修飾將成為一個研發的熱點,相信在不久的將來,將會有更多的多肽類神經系統藥物及給藥、釋藥系統被開發出來并用于臨床實踐。
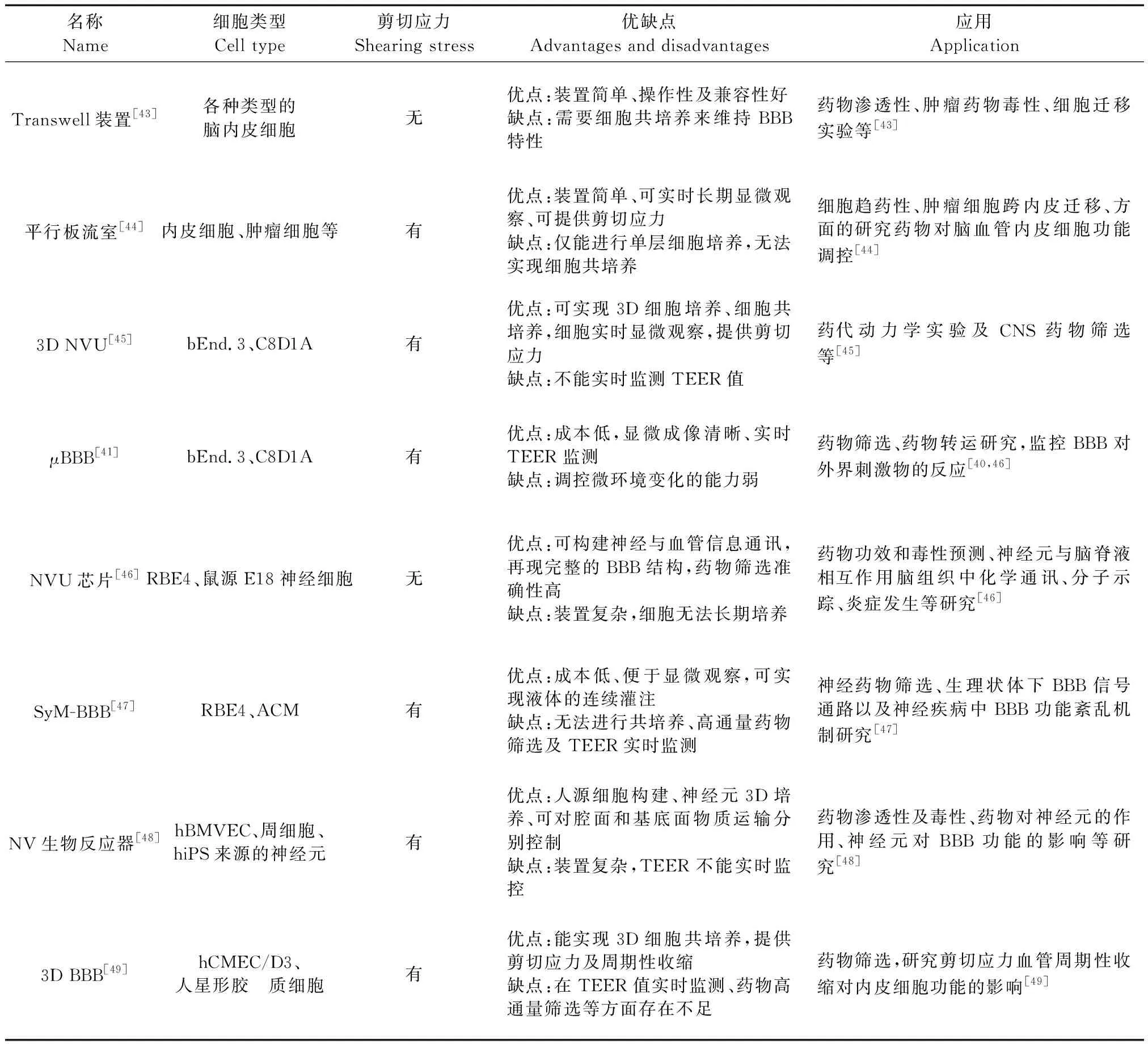
表1 BBB體外模型裝置優缺點及其應用[53]Table 1 Advantages and disadvantages of BBB models in vitro and their application

