凡納濱對蝦養殖親本群體遺傳多樣性分析
陳錦豪,鄭錦濱,王攀攀,李天驕,毛 勇,2*,蘇永全,王 軍
(1.廈門大學海洋與地球學院,福建 廈門 361102; 2.廈門大學近海海洋環境科學國家重點實驗室,福建 廈門 361102)
凡納濱對蝦(Litopenaeusvannamei),亦稱南美白對蝦、太平洋白對蝦,原產于中、南美的秘魯北部至墨西哥太平洋沿岸,但在厄瓜多爾沿岸分布尤為集中[1]。凡納濱對蝦是一種熱帶蝦,具有生長快、抗病力強、適應性強、殼薄肉嫩,味道鮮美等特點,在對蝦業養殖中占有重要地位,在我國南北方沿海地區廣泛養殖[2]。但近年來,一方面養殖環境不斷惡化,對蝦病害頻繁暴發;另一方面隨著養殖規模的擴大,對蝦親本來源選擇過于盲目,甚至從養殖池里直接選用,造成對蝦群體遺傳多樣性降低、近交衰退等,導致對蝦生產降低,嚴重影響今后對蝦優良種質的保護和利用以及生產的發展[3-6]。
微衛星(Microsatellite),亦稱簡單序列重復(Simple sequence repeat,SSR)、短串聯重復(Short tandem repeat,STR),是指以1~6個堿基為重復核心的串聯重復DNA序列,分布于生物體的整個基因組[7-8]。作為迅速發展的DNA分子標記技術之一,微衛星具有數量多、多態性豐富、重復性好、易操作、呈共顯性遺傳、在真核生物基因組中分布的隨機性等特點,故其已被廣泛應用于對蝦群體遺傳學方面的研究[9-13]。
廈門對蝦種苗產業鏈因獨特的地理位置、便捷的交通、對臺合作的先天優勢而聚集了技術、資金和市場等要素。據數據資料顯示,2014年廈門海洋經濟占據了全市GDP總值的1/8,總產值2045.9億元,同比增長10.2%,其中,廈門市對蝦種苗產業在廈門乃至福建省的海洋產業中占據重要的地位,特別是廈門市凡納濱對蝦種苗產業。作為我國蝦苗的集約地,廈門市翔安區擁有數百個對蝦種苗場,出產著全國近40%的蝦苗,也曾一度占據我國對蝦年育苗量的60%以上,至今依然在全國對蝦產業鏈的種苗環節中占據著不可替代的重要地位。
然而,隨著對蝦市場需求量的增大,種苗培育技術也隨之變化。一方面,高溫、高密度、高抗生素的“三高”養殖模式成為普遍形式,這就導致蝦苗繁育過程中經常出現營養不均衡、養殖環境惡化、病害暴發頻繁等問題;另一方面,在集約化苗種培育技術已達峰值的背景下,有些育苗場為了進一步降低成本,對種蝦不經選育,長期近交。近交衰退的潛在風險導致蝦苗出現生長緩慢、參差不齊、抵抗力差等現象,直接影響了種苗質量和健康。為了解析廈門市凡納濱對蝦“土苗”(大多經養殖的商品成蝦、經篩選以備作親本所產生的子一代苗種)親蝦群體的遺傳背景,了解“土苗”種質資源現狀,明確近交程度,本研究運用微衛星技術,選用8對多態性較好的微衛星引物,分別對從廈門市5個對蝦育苗場選取5個來源的凡納濱對蝦“土苗”親蝦群體的遺傳多樣性進行分析比較,從分子水平上了解其遺傳背景,為該地區凡納濱對蝦種質資源的提純、保優、復壯及遺傳選育提供背景資料和建議。
1 材料與方法
1.1 實驗材料
本研究考察了廈門市凡納濱對蝦傳統育苗模式下的親本來源,所選定的5個凡納濱對蝦的親本分別來自于詔安、海南、漳浦、東山等地的對蝦養殖池。由于這些傳統育苗場沒有規范的苗種生產記錄,也無明晰的選育技術路線,親本來源普遍存在種源不明、種質混雜等情況,本文通過調查走訪了解到育苗場親蝦的采集地、親本來源等信息(表1)。5個凡納濱對蝦親蝦群體樣品分別于2016年11月—2017年3月期間采自福建廈門翔安區不同育苗場,每個群體30尾[體重(122.05±13.70)mm、體長(21.8±8.62)g],編號ZhaoAn1、HaiNan、ZhaoAn2、ZhangPu、DongShan(ZA1、HN、ZA2、ZP、DS)。樣品運送到實驗室后,用剪刀取對蝦背部肌肉置于無水乙醇中,-20℃保存待用。
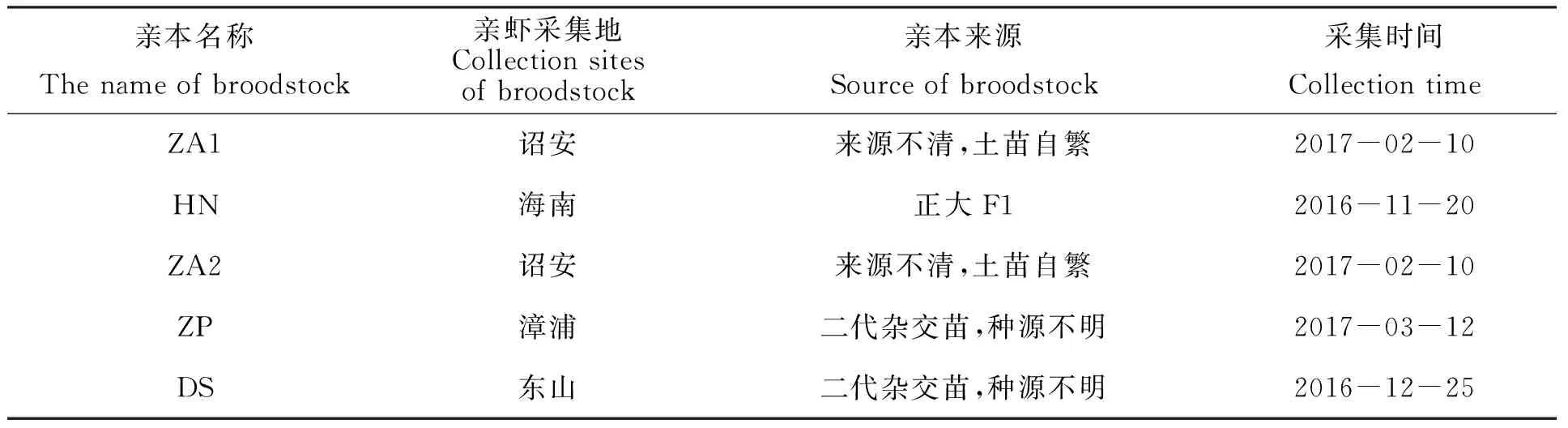
表1 凡納濱對蝦親蝦采集地及親本來源
1.2 實驗方法
1.2.1 基因組DNA的提取
實驗采用異硫氰酸胍法提取凡納濱對蝦基因組DNA[14],使用1%的瓊脂糖凝膠電泳與Q5000超微量紫外分光光度計(美國Quawell)進行基因組DNA質量及濃度的檢測。
1.2.2 微衛星引物篩選
選用8對多態性較高、特異性強且重復性好的微衛星引物[15-16](表2)進行等位基因的擴增,在引物5’末端設計添加不同類型的特異性熒光標記(FAM或ROX),熒光標記引物由上海生工生物工程股份有限公司合成。
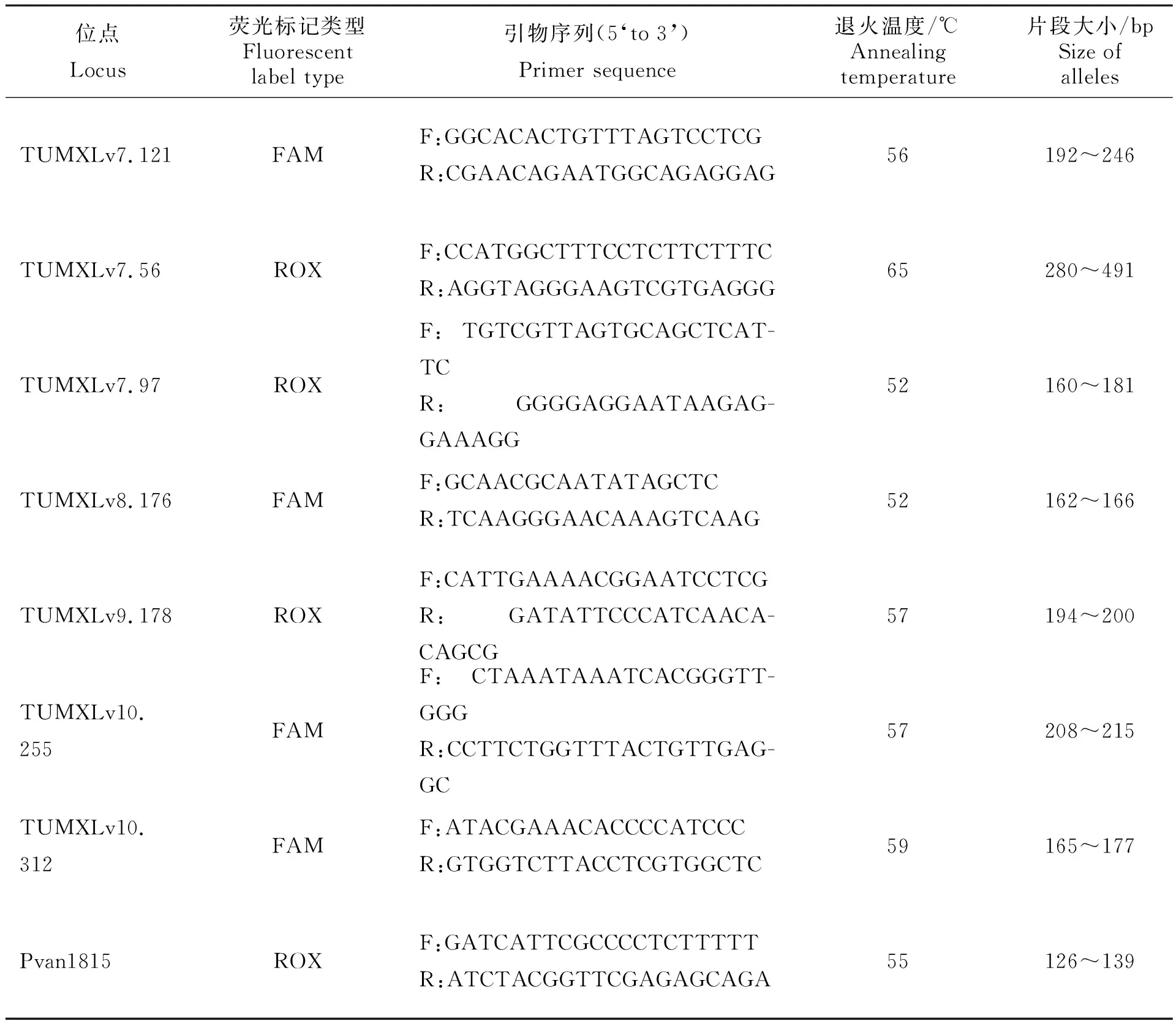
表2 凡納濱對蝦8對微衛星引物信息
1.2.3 PCR反應體系
PCR反應體系包括:10×PCR緩沖液2.5 μL、dNTPs(2.5 μM)1.6 μL、正向引物(10 μM)0.5 μL、反向引物(10 μM)0.5 μL、模板DNA(100~120 ng/μL)1 μL、TaqDNA聚合酶(5 U/μL)0.3 μL、滅菌的去離子水(ddH2O)18.6 μL。反應條件:94℃ 4 min,94℃ 30 s,(57±6)℃ 30 s,72℃ 45 s,循環 30次,72℃ 10 min,16℃ 90 min。使用1.0%瓊脂糖凝膠電泳對PCR產物進行檢測,將片段大小與預測相一致的PCR產物送上海生工生物工程有限公司進行簡單重復序列(SSR)分型分析。
1.3 數據處理與分析
等位基因數(Na)、有效等位基因數(Ne)、觀測雜合度(Ho)、期望雜合度(He)由PopGene3.2軟件計算完成。根據等位基因的頻率,運用PIC_CALC0.6軟件計算各群體各位點的多態信息含量(PIC)。利用Arlequin3.5進行近交系數(Fis)、Harde-Weinberg(H-W)平衡檢驗(P值)、分子變異分析(AMOVA)、遺傳分化指數(Fst)以及基于Fst的Slatkin’s遺傳距離的計算。運用MEGA4.0軟件,根據5個凡納濱對蝦群體間的遺傳距離,構建UPGMA聚類圖。
2 結果
2.1 群體遺傳多樣性分析
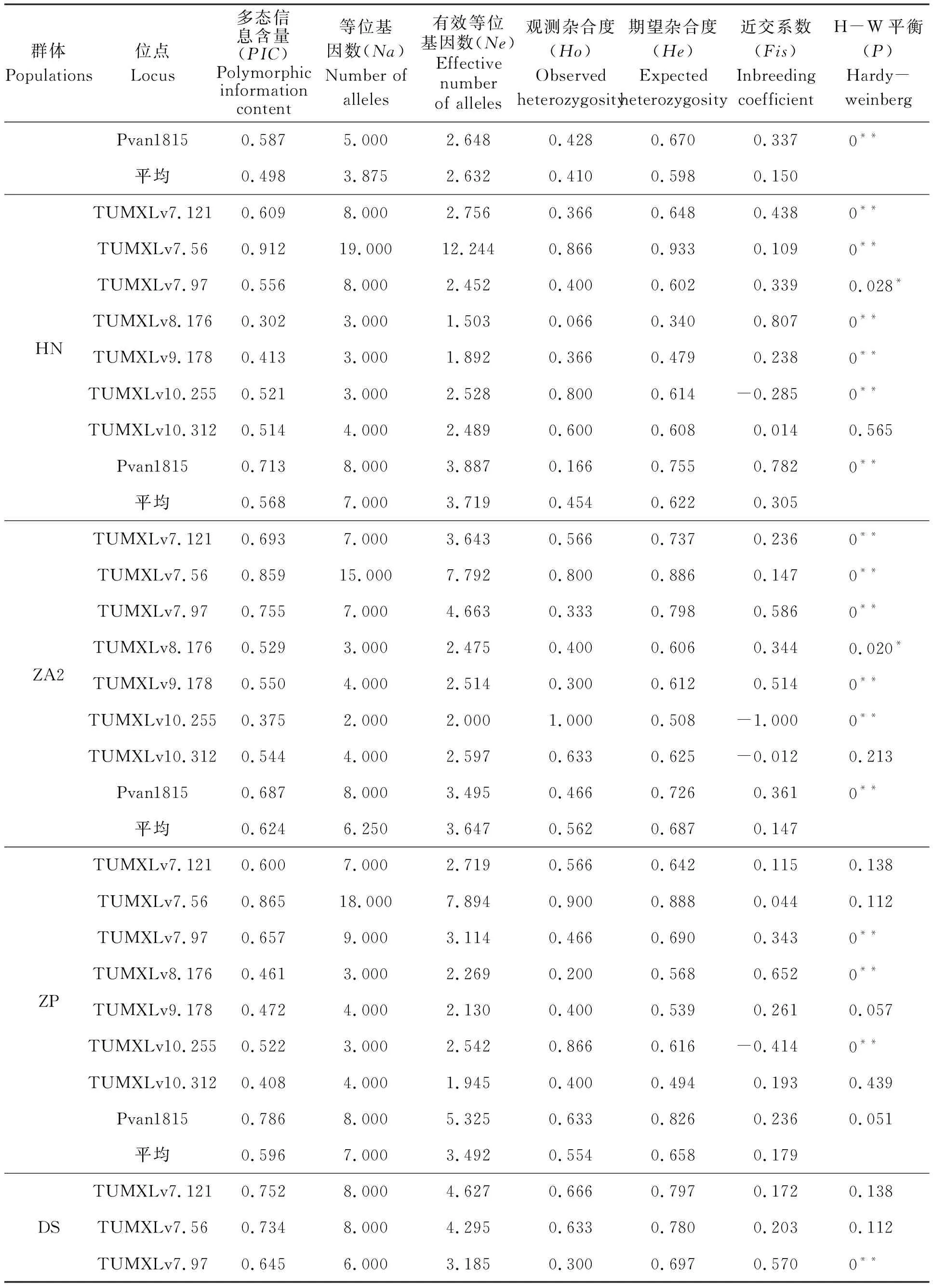
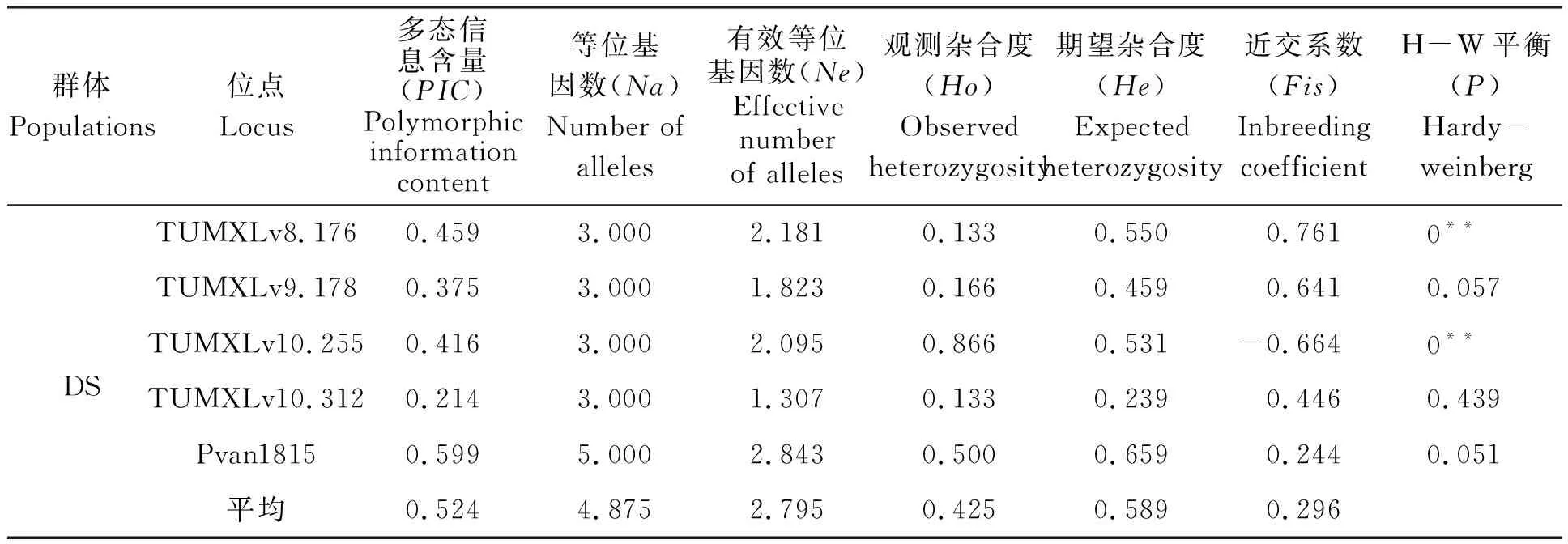
本實驗中所用的8對微衛星引物在5個凡納濱對蝦親蝦群體中共檢測到75個等位基因,8個位點平均等位基因數(Na)為9.375,其中,位點TUMXLv7.56最多,共有25個,TUMXLv8.176最少,僅有3個(表3);5個群體在8個微衛星位點上的平均等位基因數(Na)為3.875~7.000,其中ZA1群體最低(3.875),HN群體和ZP群體最高(7.000);平均有效等位基因數(Ne)為2.632~3.719,其中ZA1群體最低(2.632),HN群體最高(3.719)(表4)。
在5個群體中,8個位點的PIC值在0.450~0.918之間,平均PIC值為0.639,其中最高為TUMXLv7.56(0.918),最低為TUMXLv8.176(0.450)(表3);在5個群體中,各群體的平均PIC值范圍在0.498~0.624,其中ZA2群體最高(0.624),ZA1群體最低(0.498);除位點TUMXLv10.312在DS群體中的PIC值低于0.250,其余位點的PIC值均大于0.250(0.280~0.913)(表4)。
5個群體的平均觀測雜合度(Ho)為0.410~0.562,其中ZA1群體最低(0.410),ZA2群體最高(0.562);平均期望雜合度(He)為0.589~0.687,其中DS群體最低(0.589),ZA2群體最高(0.687)(表4)。平均觀測雜合度均比平均期望雜合度要小,表明各群體中普遍存在著雜合子缺失的情況。各群體的平均近交系數(Fis)均為正值(0.147~0.305)(表4),且除位點TUMXLv10.255外,其余7個位點平均近交系數(Fis)均為正值(表3),說明5個凡納濱對蝦群體近交程度較高,雜合子缺失較為嚴重。
通過對5個群體8個位點上的H-W平衡遺傳檢測,發現40個數據(5個群體×8個位點)中只有14個符合H-W平衡(P>0.05),有26個位點由于不同程度的雜合子缺失(Fis>0)導致不符合H-W平衡(P<0.05);在5個群體中,除ZP、DS群體外,群體ZA1、HN、ZA2在多個位點上都顯著偏離H-W平衡(P<0.05)(表4)。
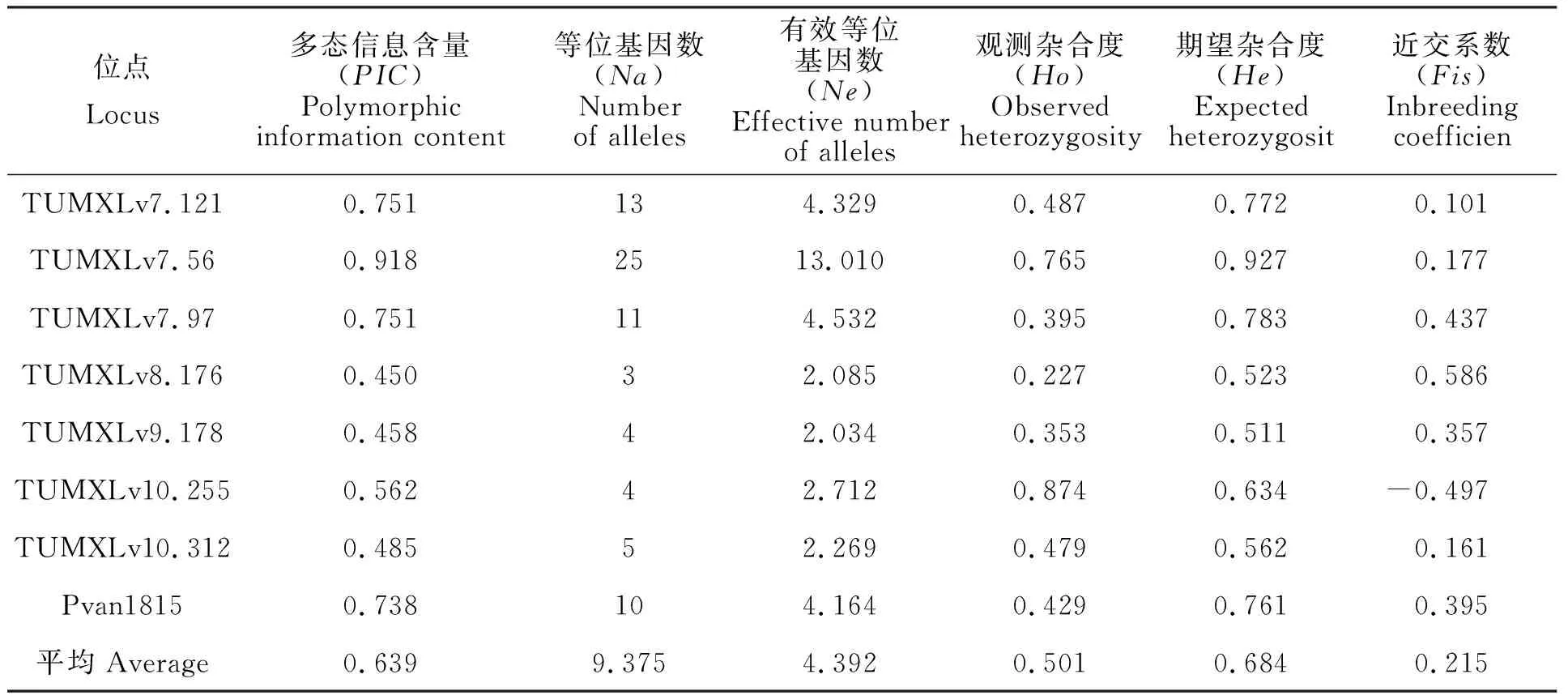
表3 8對微衛星位點在5個凡納濱對蝦親本群體上的遺傳特性
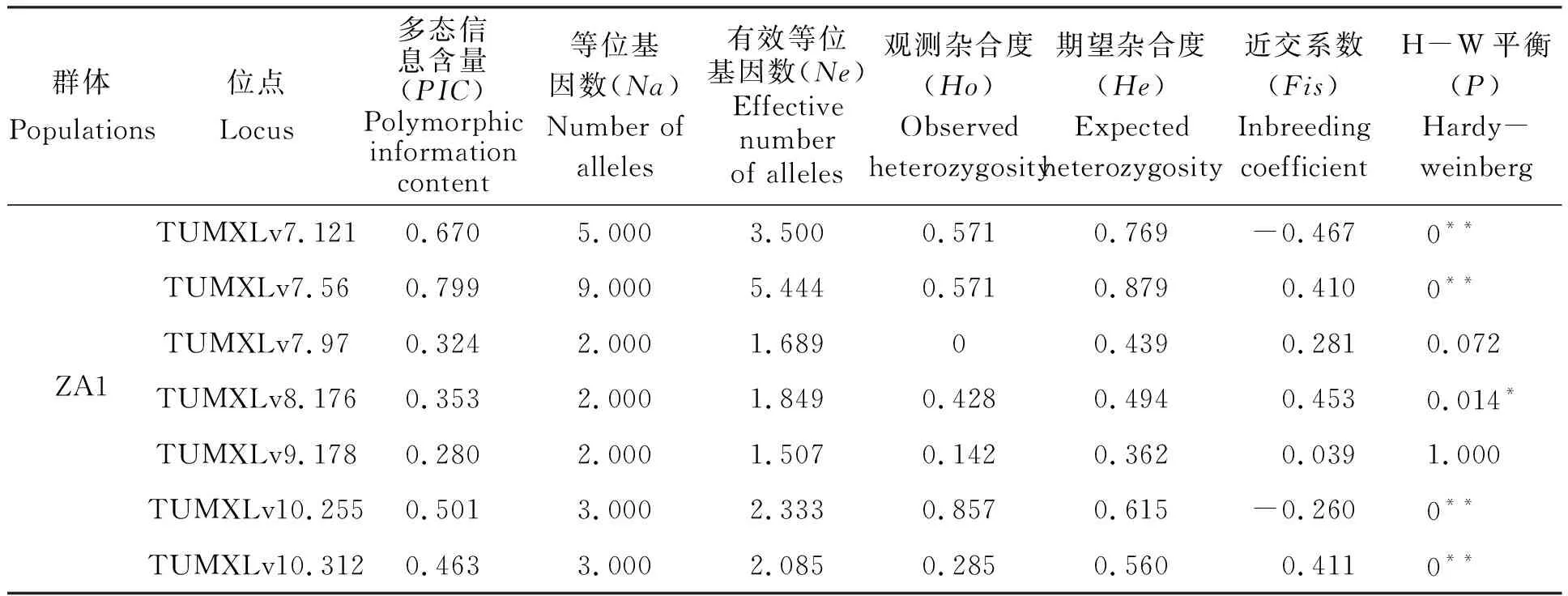
表4 5個凡納濱對蝦親本群體在8對微衛星位點上的遺傳特性
續表4
續表4
注:*為顯著偏離H-W平衡,P<0.05;**為極顯著偏離H-W平衡,P<0.01。
Notes:*was significant deviation from H-W balance,P<0.05;**was significantly deviated from H-W balance,P<0.01.
2.2 群體遺傳變異與聚類分析
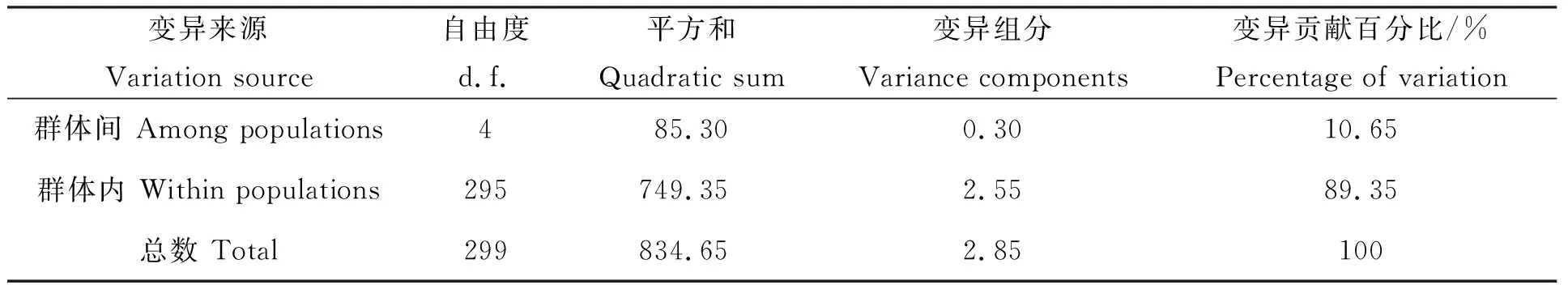
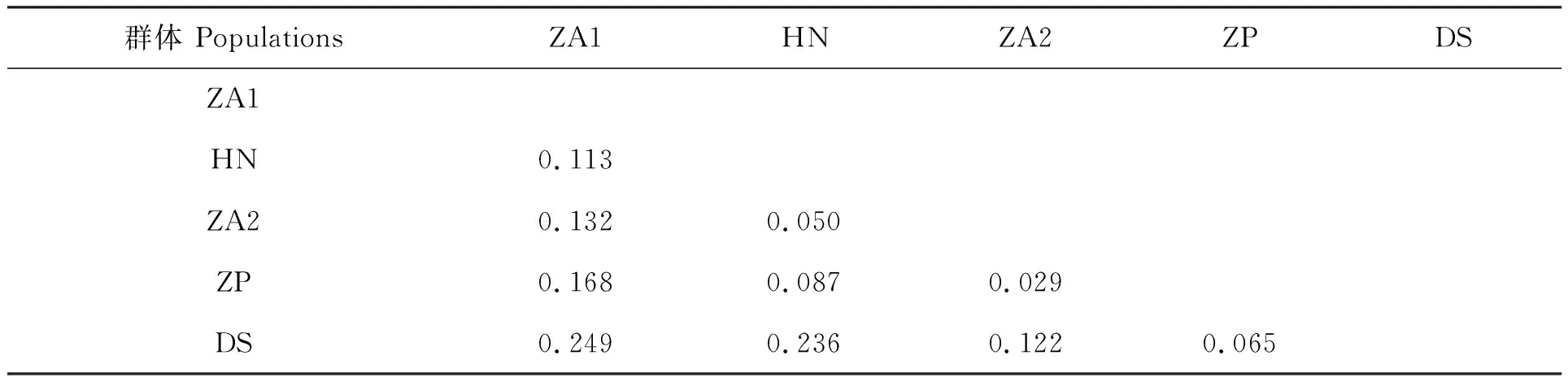
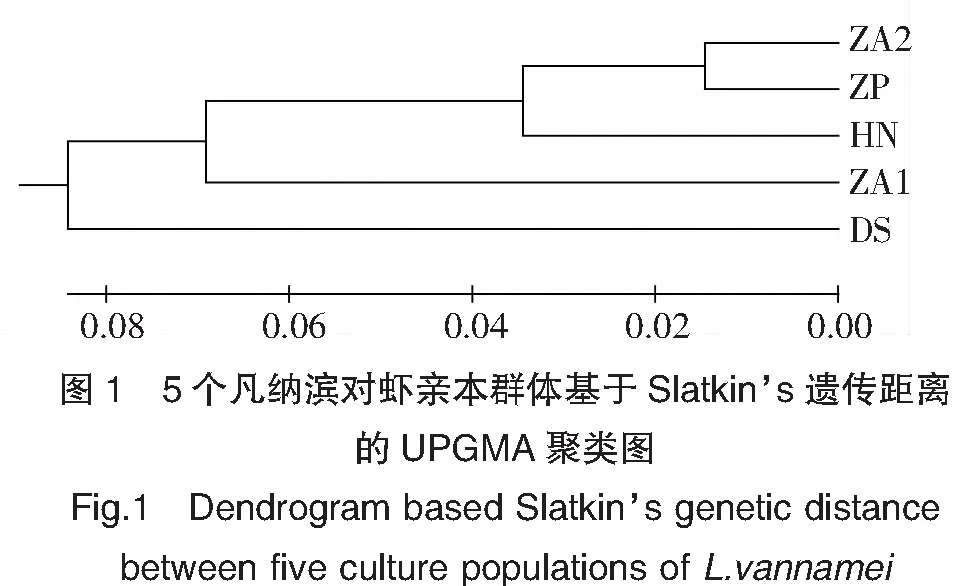
對5個凡納濱對蝦群體間遺傳分化水平進行檢測,各群體間的遺傳分化指數(Fst)在0.028~0.199之間(表5)。分析表明,ZA2群體和ZP群體間的Fst最小(0.028),群體遺傳分化最弱;ZA1群體和DS群體間的Fst最大(0.199),遺傳分化最顯著;除ZA2群體與ZP群體,HN群體與ZA2群體屬于輕度遺傳分化(0 表5 5個凡納濱對蝦親本群體間的遺傳分化指數Fst 對5個凡納濱對蝦親蝦群體的AMOVA分析顯示,只有10.65%的遺傳變異來自于群體間,而89.35%的遺傳變異來自于群體內,表明群體內的遺傳變異貢獻率要明顯大于群體間(表6)。 表6 5個凡納濱對蝦親本群體分子變異(AMOVA)分析 基于群體間遺傳分化指數計算5個凡納濱對蝦親蝦群體間的Slatkin’s遺傳距離(表7),結果顯示各群體間的遺傳距離在0.029~0.249之間,其中,ZA2群體和ZP群體的遺傳距離最小(0.029),ZA1群體和DS群體間的遺傳距離最大(0.249)。根據遺傳距離進行的UPGMA聚類分析結果表明(圖1),DS群體與其余4個群體親緣關系均較遠,ZA2群體與ZP群體親緣關系最近,它們首先聚為一支,接著分別再與HN群體、ZA1群體、DS群體聚為一支。 表7 5個凡納濱對蝦親本群體Slatkin’s遺傳距離 多態信息含量(PIC)是表示微衛星DNA變異程度高低的一個指標。根據Botstein等[17]首先提出的PIC劃分規則,本實驗中五個群體的平均PIC在0.498~0.624之間,除了位點TUMXLv10.312在DS群體上表現出低度多態性(PIC<0.25),其余位點均屬中度或高度多態性(PIC>0.25),所以僅從PIC值來看,這五個群體的遺傳多樣性較高。根據Barker[18]的報道,微衛星位點含有4個或4個以上的等位基因對于物種的遺傳進化具有一定程度的貢獻。本實驗中8個微衛星位點上的等位基因數在3~25個,與Tassanakajon等[19]結果相似。其中有7個位點的等位基因數為4個或4個以上,表明用這幾個位點對凡納濱對蝦進行微衛星標記遺傳多樣性分析效果較好。但各位點有效等位基因數在2.034~13.010之間,除位點TUMXLv7.56有效等位基因數最高外(13.010),其余位點有效等位基因數均小于5,可能是由于部分位點存在較多的無效等位基因從而高估了PIC值,造成群體遺傳多樣性水平虛高。 H-W平衡檢驗結果表明,除了ZP群體與DS群體有5個位點符合H-W遺傳平衡外,其余幾個群體都有至少6個位點顯著偏離平衡(P<0.05),在總共40個數據中(5個群體×8個位點),共有26個偏離了H-W遺傳平衡,說明絕大部分群體都存在著不同程度雜合子缺失的情況。可能是由于無效等位基因的存在[20]以及凡納濱對蝦親本選擇過于盲目,并且后代長期近交,從而導致個體間近親交配率逐漸提高,造成群體雜合子缺失嚴重,群體遺傳結構已經較為脆弱。 統計分析結果顯示,5個凡納濱對蝦群體的平均Ho和平均He分別在0.410~0.562和0.589~0.687之間,ZA1群體在TUMXLv7.97位點上的Ho為0,表明ZA1群體在該位點上的等位基因幾乎都為純合子,且除位點TUMXLv10.255外,其余位點觀測雜合度均小于期望雜合度,表明這5個群體普遍存在著雜合子缺失的現象,這與Jimenez等[21]關于太平洋凡納濱對蝦群體遺傳結構的研究結果一致,雜合子缺失現象在Xu等[22]與Supungul等[23]對斑節對蝦(Penaeusmonodon)的研究中也有發現。楊銳等[24]研究發現,雜合子缺失將導致純合子增加,提高有害等位基因純合的幾率,近交衰退幾率升高,從而降低物種對環境變化的適應性。本研究結果顯示,除位點TUMXLv10.255(Fis=-0.497)外,其余位點的平均Fis均為正值,這與童馨等[25]所研究的凡納濱對蝦養殖群體(-0.166 遺傳分化指數(Fst)是衡量群體間遺傳分化程度的重要指標,其劃分規則為0~0.05表示群體間分化較弱,0.05~0.15表示分化中等,0.15~0.25表示分化大,大于0.25表示分化極大[28]。本實驗中5個凡納濱對蝦群體間的遺傳分化指數(Fst)在0.028~0.199之間。分析結果表明,除了HN群體與ZA2群體(Fst=0.047)、ZA2群體與ZP群體(Fst=0.028)間的遺傳分化較弱(0 群體間的遺傳關系一般以基于通過等位基因頻率計算而得的遺傳距離來體現。Crawford等[29]認為由微衛星計算得出的遺傳距離更能反映種群分化時間的長短,能客觀地反映群體間的遺傳和分化。分析本研究中基于Fst的各群體間Slatkin’s遺傳距離,結果顯示,各群體間的遺傳距離在0.029~0.249之間,表明5個群體之間的遺傳差異較小。這提示在凡納濱對蝦苗種培育中,親本的選擇需要考慮遺傳距離這一指標,它反映的是不同品種進化上的關系;選擇遺傳距離大且性狀良好的群體進行雜交育種,發揮雜種優勢,有利于種質的提高以及后代各種優良性狀的產生與新品種的培育[30],進而推動凡納濱對蝦養殖產業的發展。 由于市場需求增大而導致的苗種培育方式的改變以及苗種培育企業普遍缺少對蝦育種技術的專業指導,使得廈門市凡納濱對蝦親蝦群體近親交配嚴重,近交衰退現象明顯。經過多代的近親交配后,有害等位基因純合比例不斷升高,加上養殖過程中大量抗生素的使用,使得蝦苗普遍較為脆弱,造成對蝦種苗品質下降,嚴重阻礙了凡納濱對蝦養殖產業的發展。同時,由于我國的優良親蝦基本被國外進口的種蝦壟斷,導致廈門市龐大的對蝦種苗產業鏈因缺少穩定的種源供應造成無序發展亂象,而且種源混雜現象十分突出,國內外的種質、一代二代的蝦苗、優劣種齊聚廈門,良莠不齊、摻假現象也時有發生。因此在生產中應明確對蝦種質來源,科學規范苗種培育流程,國內各苗種培育企業和相關科研單位可進行聯合雜交育種,選用性狀良好的親本個體,利用雜交優勢,改善后代的遺傳多樣性水平,提高后代優良經濟性狀的比例,這對于廈門市對蝦新品種的培育乃至國內凡納濱對蝦種苗產業的發展具有重要意義。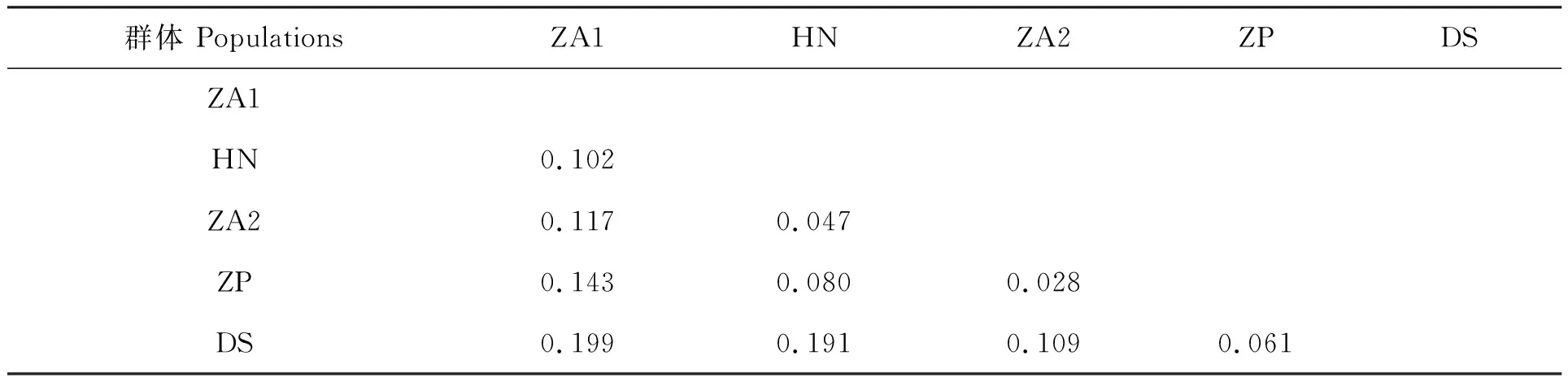
3 討論
3.1 凡納濱對蝦群體的遺傳多樣性
3.2 凡納濱對蝦群體間的遺傳差異
4 結論

