臨床藥師參與1例膽道感染繼發腹膜炎患者抗感染治療的病例分析
梁瑜,孟真,李祥鵬,倉懷芹,隋忠國
(1.青島大學附屬醫院藥學部,山東 青島 266003;2.青島大學附屬醫院介入科,山東 青島 266003)
隨著臨床藥學工作的不斷開展深入,臨床藥師參與用藥方案設計,糾正臨床不合理治療方案,提供用藥建議,成為臨床藥師工作最核心的內容[1]。本文以1例膽道惡性梗阻合并膽道感染、繼發急性腹膜炎患者為例,分析患者的抗感染治療方案及藥學監護點,探討臨床藥師參與藥物治療過程中的作用,并為臨床合理用藥提供一定參考。
1 病例資料
患者,男,62歲,因“皮膚、鞏膜黃染2月”于2017-5-23入院。患者5年前因“胃竇分化腺癌”行“姑息性遠端胃近全切除術”,術后行多周期化放療。1年前行正電子發射計算機斷層顯像(PET-CT)示肝門胰頭區、腹腔腸系膜上靜脈旁、腹主動脈與下腔靜脈周圍多個增大淋巴結,考慮腫瘤復發轉移。2月前出現皮膚、鞏膜黃染,監測癌胚抗原(CEA)升高、肝功能受損明顯,上腹部增強CT提示壺腹周圍改變及肝臟低密度影、腹膜后多發腫大淋巴結影、腹腔積液,遂暫停化療,為進一步診治收住消化內科。入院診斷:①梗阻性黃疸;②胃竇低分化腺癌,術后二次復發多周期治療后;③肝膿腫引流術后;④胃術后。
既往史:否認肝炎、結核、瘧疾病史,否認高血壓、心臟病史,否認糖尿病、腦血管疾病、精神疾病史,5年前因肝膿腫行引流術,否認食物藥物過敏史,預防接種史不詳。
2 抗感染治療經過
患者因腫瘤轉移壓迫壺腹部導致膽道梗阻,于2017-5-26(入院第4天)行經皮肝穿刺膽管引流術(percutaneous transhepatic cholangio-drainages,PTCD),術后患者出現發熱,體溫38.2 ℃,WBC 9.53×109/L,N% 85.2%,使用美洛西林鈉舒巴坦鈉抗感染治療。第11日患者無發熱,行經皮肝穿刺膽道支架植入術。第15天患者再次出現發熱,體溫38.8 ℃,WBC 12.8×109/L,N% 92.4%,引流管滲出液較多,醫師考慮不除外引流管部分脫出,急行腹部立位平片檢查,期間因患者不慎導致引流管完全脫出,暫將引流切口縫合,擇日行第二次膽道支架植入術。第17天患者訴全腹疼痛,以下腹為著,伴腹脹,伴發熱,伴畏寒、寒戰,查體:體溫38.5 ℃,腹壁柔韌,拒按,全腹壓痛及反跳痛,移動性濁音陽性,腸鳴音未聞及,醫師診斷急性腹膜炎,調整抗感染治療方案為莫西沙星聯合頭孢哌酮舒巴坦,并行B超引導下腹水穿刺引流、送細菌培養。第20天患者仍有發熱,體溫38 ℃,腹部壓痛較前稍有好轉。第23天腹水培養示屎腸球菌(氨基糖苷類高水平耐藥,HLAR),臨床藥師會診建議使用萬古霉素500 mg,q8 h抗球菌治療,停莫西沙星。第28天患者低熱,腹部無明顯疼痛,腹瀉5次,為稀水樣便,查體:體溫37.3 ℃,腹壁柔軟,無明顯壓痛及反跳痛,腸鳴音可聞及。復查WBC 9.7×109/L,N% 77.1%,大便菌群分析示球桿菌比例倒置,醫師考慮目前抗感染治療有效,暫不調整治療方案,并加用蒙脫石散止瀉,同時為避免靜脈用藥對外周血管刺激,行B超引導下經外周靜脈穿刺中心靜脈(PICC)置管。第31天患者仍有低熱,腹脹,腹瀉9次,臨床藥師會診考慮患者為抗生素相關性腹瀉,建議調整治療方案為美羅培南0.5 g,q6 h聯合萬古霉素抗感染治療,并再次行腹水穿刺引流、送細菌培養,同時加用益生菌制劑調節腸道菌群。第35天患者腹瀉好轉,體溫再次升高至39 ℃,腹水培養示白假絲酵母菌,臨床藥師考慮不除外萬古霉素引起藥物熱可能,建議停用萬古霉素,加用氟康唑首劑400 mg后每天200 mg,qd維持治療。第39天患者體溫再次出現波動,復查WBC 9.6×109/L,N% 76.4%,并送檢血培養,同時再次行腹水穿刺引流、送細菌培養。第42天血培養示銅綠假單胞菌,腹水培養陰性,臨床藥師建議停用美羅培南換用哌拉西林他唑巴坦抗感染治療,同時拔除PICC置管。第49天患者體溫、血象復常,停用抗菌藥物,轉外科繼續治療。
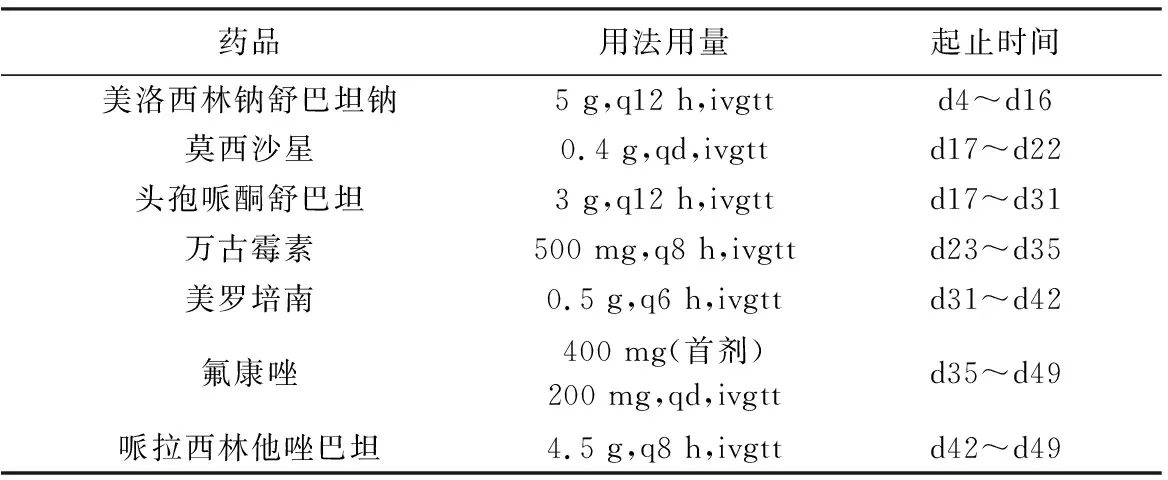
表1 住院期間患者使用的抗菌藥物
3 討論
3.1 抗感染治療評價
3.1.1 經驗性治療 膽道感染是惡性梗阻性黃疸患者PTCD術后少見而又嚴重的并發癥之一,如未能及時控制,可能會威脅患者生命。彭波等[2]研究發現,PTCD術后膽管炎病原菌多來自腸道,其中G-性菌占86%,并可能出現超廣譜β-內酰胺酶(ESBLs)陽性的大腸埃希菌。該患者初始選用美洛西林鈉舒巴坦鈉,可覆蓋多數產β-內酰胺酶的腸桿菌、厭氧菌等細菌,初期感染控制效果尚可。但是,隨著膽道外引流管留置時間的延長,導致膽道暴露于腸道消化液的時間延長,增加腸道細菌反流并定植于膽道,加之廣譜抗生素的長期使用,發生耐藥菌感染的風險將大大增加。孟慶玲等[3]研究提示,膽道惡性梗阻患者由于病程長、免疫力低以及長期使用廣譜抗生素,腸球菌感染率及多重細菌感染率明顯升高。因此,患者第15天出現發熱,血象等炎性指標升高,膽道外引流不通暢,美洛西林鈉舒巴坦鈉已使用12 d,應警惕耐藥腸球菌感染的可能。
第17天患者因引流管脫落繼發急性腹膜炎,醫師考慮膽道病原菌侵入腹水繁殖引起,遂調整抗感染治療方案為莫西沙星聯合頭孢哌酮舒巴坦。莫西沙星是第四代氟喹諾酮類抗菌藥物,對G+、G-性菌及厭氧菌具有抗菌活性,能夠覆蓋腹腔感染的常見病原菌。但是,近年來腸球菌對莫西沙星的耐藥率呈上升趨勢,特別是屎腸球菌耐藥率高達85.5%[4],對于存在耐藥腸球菌感染可能的患者,經驗性抗球菌治療時,推薦使用萬古霉素。此外,《產超廣譜β-內酰胺酶腸桿菌科細菌感染應對策略專家共識》[5]指出,產ESBLs菌株對不同的復合制劑敏感性存在較大差異,對頭孢哌酮舒巴坦和哌拉西林他唑巴坦敏感率達80%以上,推薦二者用于輕中度感染的治療。本例患者存在腫瘤病史、廣譜抗生素使用以及侵入性診療操作等危險因素,導致多種細菌混合感染引起繼發性急性腹膜炎,且存在耐藥性菌株及產ESBLs菌株的可能,分析該患者調整后的抗感染方案,莫西沙星對于腸球菌的經驗性治療效果不佳,而頭孢哌酮舒巴坦對可能出現ESBLs陽性的大腸埃希菌的經驗性治療效果尚可。
3.1.2 目標性治療 腸球菌是臨床較常見的一類條件致病菌,近年來由于抗菌藥物的廣泛應用,使腸球菌尤其是耐藥腸球菌引起的醫院感染逐漸上升,成為醫院感染的主要病原菌之一。而在耐藥菌株中氨基糖苷類高水平耐藥(HLAR)菌株占了較大的比例。李紅玉等[6]報道HLAR屎腸球菌對β-內酰胺類、喹諾酮類抗生素的耐藥率在85%以上,明顯高于糞腸球菌的10%以下。萬古霉素、替考拉寧及利奈唑胺是當前治療HLAR感染較好的抗菌藥物。第23天患者腹水培養出HLAR屎腸球菌,藥敏試驗僅對萬古霉素、替考拉寧、利奈唑胺、替加環素敏感。萬古霉素廣泛分布在組織及體液中,尤其在腹水中分布良好,因此,臨床藥師選用萬古霉素進行目標性治療。成人患者萬古霉素的建議起始量為每次15~20 mg·kg-1,q 8~12 h使用。根據該患者的年齡、體重、肝腎功能、腹水量以及細菌的最小抑菌濃度(MIC)值,臨床藥師建議萬古霉素500 mg,q8 h,并在第4劑給藥前30 min測定其谷濃度為13.60 μg·mL-1,維持在推薦谷濃度10~15 μg·mL-1之內,治療13 d后腹水培養未見腸球菌。
假絲酵母菌亦屬于條件致病菌,當機體的免疫力低下或受損時,可侵襲機體,造成多部位的感染。腫瘤患者由于細胞的免疫功能降低,放化療后導致白細胞數量逐漸減少,同時應用廣譜抗菌藥物和激素,因此極易發生真菌感染,其中以白色假絲酵母菌最為常見[7]。本例腫瘤患者機體抵抗力弱、營養狀況較差,入院后使用多種廣譜抗生素長達1月后,再次出現發熱,應警惕真菌感染的可能。第35天患者腹水培養示敏感的白假絲酵母菌,由于氟康唑的組織穿透力強,可在機體內廣泛分布,腹腔液的濃度約為血藥濃度的1~2倍,因此,臨床藥師會診建議給予氟康唑首劑400 mg迅速達到穩態血藥濃度,繼以200 mg,qd劑量維持治療,治療14 d后腹水培養轉陰。
導管相關性感染為PICC置管發生率較高的并發癥之一,嚴重者可引起患者敗血癥或全身感染性疾病。PICC作為一種有創的侵入性操作,成為院內感染常見菌入侵的門戶。銅綠假單胞菌易在潮濕環境中生存與繁殖,廣泛定植于醫院環境內。本例患者PICC置管10余天,機體免疫功能差,同時合并重癥感染,容易受到條件致病菌的侵襲。第42天患者血培養示敏感的銅綠假單胞菌,臨床藥師選用哌拉西林他唑巴坦4.5 g,q8 h抗感染治療,同時拔除PICC置管減少危險因素,經治療后患者感染癥狀、實驗室檢查明顯好轉。
3.2 抗感染藥學監護
3.2.1 抗生素相關性腹瀉 由于抗生素的應用引起菌群失調而導致抗生素相關性腹瀉(antibiotic associated diarrhea,AAD)并不鮮見,國內外統計資料顯示,幾乎所有抗生素均可誘發AAD。較易引起ADD的抗生素依次為半合成青霉素或加酶抑制劑、第三代頭孢菌素類、青霉素、克林霉素、碳青霉烯類、頭孢二代、喹諾酮類。抗生素使用療程越長,AAD發生率也越高[8]。本例患者入院后相繼使用美洛西林鈉舒巴坦鈉和頭孢哌酮舒巴坦,二者均為引起AAD發生率較高的抗生素,且用藥療程近1月,入院第28天患者出現腹瀉,大便菌群分析示球菌和桿菌比例失調,明顯提示AAD的發生。第31天患者腹瀉加重,臨床藥師會診考慮AAD患者多為單純性腹瀉,通過停藥及調整腸道菌群等藥物治療大多可治愈,因此建議停用頭孢哌酮舒巴坦,并加用活菌制劑調節腸道菌群。3 d后患者腹瀉緩解。由于患者仍有腹膜炎,需經驗覆蓋產ESBLs的G-桿菌,臨床藥師選用了AAD發生率相對較低的美羅培南,并囑醫師密切關注患者腹瀉情況。
3.2.2 藥物熱 藥物熱是臨床常見的藥物不良反應之一,尤其以抗生素導致的最為常見。典型的藥物熱出現于用藥后第7~10天,多數患者僅表現為發熱,而無其他癥狀,一般情況良好。萬古霉素引起藥物熱不良反應的報道較為少見,究其原因,可能與診斷困難有關[9]。本例患者應用萬古霉素約9 d(入院第31天)后,體溫控制尚可,第35天體溫再次升至39 ℃,臨床藥師會診追問病史,患者訴近3 d靜滴萬古霉素后發熱明顯。臨床藥師考慮萬古霉素用藥時間與再次發熱時間基本一致,萬古霉素引起藥物熱的可能性不除外,但是由于該患者合并細菌、真菌感染,停用萬古霉素后患者仍有發熱,因此不能明確判斷萬古霉素是否引起藥物熱。但是,萬古霉素致藥物熱不良反應是藥學監護的要點,治療過程中應予以警惕,以便及時發現并給予處置,避免不良反應導致住院時間延長,減少患者痛苦。
4 體會
隨著醫療技術的不斷發展,危重癥患者的救治在住院患者中占的比例越來越大。這些患者通常病情復雜兇險,合并使用多種藥物,治療過程中需要醫師、護士及藥師的共同參與。作為醫療團隊的一員,臨床藥師充分運用藥學知識,分析藥物治療方案,提供合理用藥建議,密切監護藥物不良反應,與醫師及時溝通、調整用藥,提高了醫療質量,體現了臨床藥師在藥物治療實踐中的重要作用,保證了患者安全、有效、合理地使用藥物。

