帶銹青銅文物材料在環境模擬介質中的電化學腐蝕行為
, , ,, , ,
(1. 華東理工大學,上海 200237; 2. 上海博物館,上海 200050)
我國歷史源遠流長,文物種類繁多。其中,青銅文物以其精美的銘文圖案和獨特的造型聞名于世,是我國重要的歷史文化遺產。考古出土的青銅文物是歷史信息的重要載體,因此,對青銅文物的保護具有十分重要的歷史意義。青銅文物出土后的保存環境復雜多樣,大氣中的氧氣(CO2)、二氧化碳(CO2)、污染物(如SO2和NOx)、濕度、溫度以及海洋大氣環境中的氯化鈉(NaCl)等鹽類都是引起青銅腐蝕的因素。空氣中的Cl-和SO2均會與金屬反應,在青銅文物表面產生有害銹,加快青銅文物的粉化潰爛[1],并且Cl-和SO2含量越高,金屬腐蝕越嚴重[2-3],且它們對金屬的腐蝕有協同作用[4-5]。
青銅文物表面一般都附著了大量的腐蝕產物,可分為有害銹和無害銹。無害銹質地比較堅硬,可以保護青銅不再遭受進一步的腐蝕,主要成分是氧化亞銅(Cu2O)。有害銹會使青銅文物粉化,縮短其壽命,主要成分是氯化亞銅(CuCl)和堿式氯化銅[Cu2(OH)3Cl]等[6]。現有青銅腐蝕研究主要是針對裸青銅,對帶銹青銅的相關研究較少,但帶銹青銅比裸青銅更接近實際青銅文物。故本工作制備了3種帶銹青銅試樣用以替代青銅文物,研究了其在不同腐蝕介質中的電化學行為,并與裸青銅進行了比較,分析不同銹層在不同環境模擬介質中的腐蝕規律。
1 試驗
1.1 腐蝕介質
腐蝕介質有3種:大氣環境模擬液,根據文獻[7]制備,主要成分為0.028 mol/L NaCl+0.01 mol/L Na2SO4+0.016 mol/L NaHCO3;海洋環境模擬液,根據文獻[8]制備,主要成分為0.07 mol/L NaCl+大氣環境模擬液;SO2環境模擬液,根據文獻[8]制備,主要成分為0.07 mol/L Na2SO3+大氣環境模擬液。
1.2 帶銹青銅制備
1.3 電化學測試
采用電化學法研究4種青銅試樣(裸青銅和3種帶銹青銅)在3種腐蝕介質中的腐蝕行為。 電化學測試在PARSTAT 2273型電化學工作站上采用三電極體系進行。工作電極是青銅電極,參比電極為217型飽和甘汞電極(SCE),輔助電極為鉑絲電極。電化學阻抗譜(EIS)測試在開路下進行,頻率范圍為5 mHz~95 kHz,擾動電位為10 mV。
2 結果與討論
2.1 銹層表面形貌及成分
圖1是4種青銅的掃描電鏡圖(SEM),表1是其能譜(EDS)分析結果[11]。
由圖1可見:裸青銅表面平整光滑,有砂紙打磨后的劃痕;帶Cu2O銹青銅表面比裸青銅粗糙一些,且表面分布有較均勻的立方體銹層;帶CuCl銹青銅表面疏松,銹層分布不均勻,有較大的孔隙;帶混合銹青銅的銹層較為均勻,但有一些較大的顆粒存在。由表1可知,制成的各銹層成分較為理想,混合銹中包含CuCl、Cu2O、Cu2Cl(OH)3、Cu2CO3(OH)2、Cu4SO4(OH)6等成分[12]。

(a) 裸青銅(b) 帶Cu2O銹青銅 (c) 帶CuCl銹青銅(d) 帶混合銹青銅圖1 4種青銅的表面形貌Fig. 1 Surface morphology of 4 kinds of bronze:(a) bare bronze; (b) bronze with Cu2O; (c) bronze with CuCl; (d) bronze with mixed patina
%
2.2 在大氣環境模擬液中的電化學腐蝕行為
開路電位(OCP)體現了金屬的熱力學穩定性,可用于研究金屬腐蝕的機理[13]。當OCP往正向移動時表示金屬鈍化,金屬表面生成氧化膜,腐蝕傾向變小;當OCP往負向移動時表示金屬活化,表面氧化膜溶解腐蝕傾向變大。
由圖2可知:在大氣環境模擬液中,裸青銅的開路電位隨浸泡時間的推移而緩慢降低,這是由于裸青銅與腐蝕介質接觸后,在空氣中形成的表面氧化膜與腐蝕介質反應,導致腐蝕電位下降;浸泡初期,

圖2 大氣環境模擬液中4種青銅的開路電位隨浸泡時間的變化曲線Fig. 2 Curves of open circuit potential vs time for 4 kinds of bronze in atmospheric environment simulation solution
帶CuCl銹青銅的開路電位下降速率比裸青銅的快很多,這是由于CuCl銹結構疏松,腐蝕介質易于穿過銹層接觸基體,從而腐蝕傾向增大,而后在青銅基體表面形成鈍化膜,當鈍化膜均勻覆蓋在青銅表面后,電位趨于穩定;帶Cu2O銹和帶混合銹青銅的開路電位隨時間變化都比較穩定。
在大氣環境模擬液中穩定后即浸泡3 600 s后,4種青銅的開路電位大小順序為:帶Cu2O銹青銅(0.115 V)>帶CuCl銹青銅(0.095 V)>帶混合銹青銅(0.083 V)>裸青銅(-0.022 V)。這表明裸青銅在大氣環境模擬液中的腐蝕傾向最大,帶Cu2O銹青銅的最小。
第二,涉及漢民族獨特文化的謎語。如前所述,有些傳統的文化現象在逐步消亡,年輕人對其日益陌生,包含此類文化現象的謎語,猜度起來就相當困難了。如謎底為“日”字的字謎:
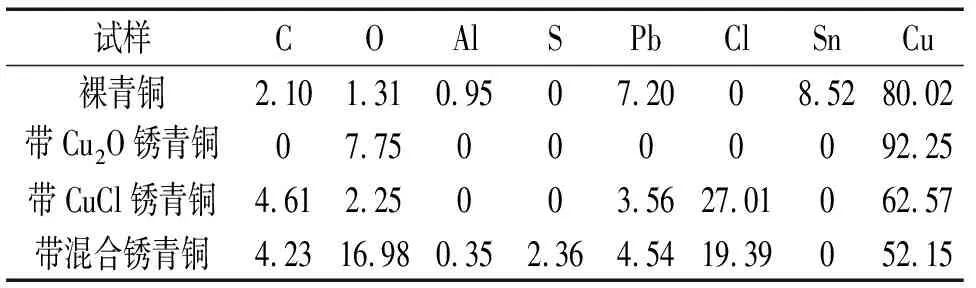
圖3是3種帶銹青銅與裸青銅在大氣環境模擬液中浸泡1 h和48 h時電化學阻抗譜的對比。圖4是用于擬合電化學阻抗譜的等效電路圖,擬合得到的參數見表2。圖中,Rs是溶液電阻;Rct是電荷轉移電阻;Rf是膜電阻;Zw是韋伯阻抗;電極界面雙電層電容與理想電容有一定的偏離,即“彌散效應”,且這種“彌散效應”不可忽略[14],因此,Cf、Cdl分別是膜電容和雙電層電容,nf和ndl分別是Cf、Cdl對應的離散系數。
裸青銅、帶Cu2O銹青銅和帶混合銹青銅浸泡1 h和48 h時的阻抗譜分別用圖4(a)和圖4(b)所示的等效電路擬合,帶CuCl銹青銅浸泡1 h和48 h的阻抗譜用圖4(c)所示的等效電路擬合。另外,表2中的Rp代表極化電阻,是體系中Rf與Rct之和[15],可用來表征金屬的耐蝕性[16-17]。

(a) 帶Cu2O銹青銅(b) 帶CuCl銹青銅(c) 帶混合銹青銅圖3 3種帶銹青銅與裸青銅在大氣環境模擬液中浸泡1 h和48 h時電化學阻抗譜的對比Fig. 3 EIS comparison of 3 kinds of patinaed bronze with bare bronze in atmospheric environment simulation solution for 1 h and 48 h: (a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina

(a) 等效電路一(b) 等效電路二(c) 等效電路三圖4 電化學阻抗譜等效電路Fig. 4 Equivalent electrical circuits of No. 1 (a), No. 2 (b) and No. 3 (c) for EIS fitting

試樣浸泡時間/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青銅18.1---117.80.753 8710.008 13 871488.4104.30.69994428.90.694 3600.006 35 354帶Cu2O銹青銅114.9---57.70.682 9220.000 72 9224811.135.60.744 540283.10.599 4170.002 313 957帶CuCl銹青銅114.762.30.330.438.60.701 743-1 743488.390.20.821 539101.20.3825 560-27 099帶混合銹青銅110.6---31.70.633 5800.000 43 5804812.247.10.872 316344.30.583 7070.006 66 023
由圖3(a)可見:在大氣模擬液中浸泡1 h時,在裸青銅和帶Cu2O銹青銅電化學阻抗譜的高頻區均出現一個容抗弧,這是電化學法拉第過程;低頻區均有一條擴散尾弧,表現為具有擴散特征的Warburg阻抗,表明此時腐蝕反應速率快,電子傳遞過程快,反應由氧的擴散過程控制[18]。一般來說,高頻區代表沉積膜的響應,中頻區代表基體的法拉第響應,低頻區代表腐蝕產物、氯離子或者氧的擴散響應[19]。由表2可見:在浸泡1 h時,裸青銅的極化電阻大于帶Cu2O銹青銅的,說明此時裸青銅的耐蝕性好于帶Cu2O銹青銅的。這可能是由于帶Cu2O銹青銅的表面不均勻處發生腐蝕,成為腐蝕微電池的陽極,反應見式(1)[20],反應生成的Cu4SO4(OH)6溶解度更小,并使環境呈一定的堿性,因此腐蝕速率減小。而裸青銅表面發生的腐蝕反應如式(2)~(3)所示[21],CuCl2-又通過與氧反應產生OH-,更多的CO2溶解在溶液中形成CO32-,與Cu2(OH)3Cl反應生成化學勢上更加穩定的Cu2(OH)2CO3。由圖3(a)和表2還可見:浸泡48 h時,在裸青銅和帶Cu2O銹青銅電化學阻抗譜的中高頻區都出現了兩個容抗弧耦合的現象,說明腐蝕產物正慢慢沉積于青銅表面;與裸青銅相比,帶Cu2O銹青銅的極化電阻更大,這可能是因為其生成的Cu4SO4(OH)6更加均勻穩定引起的。

Cu4SO4(OH)6+2OH-
(1)

(2)

(3)
由圖3(b)可見:在大氣模擬液中浸泡1 h時,帶CuCl銹青銅的阻抗譜沒有出現擴散尾弧,反應主要受電化學活化控制。這可能是由于CuCl銹結構疏松,基體與腐蝕介質接觸面積大,使氧擴散加速所致。電荷轉移電阻與腐蝕速率呈反比關系[21],在浸泡1 h時,帶CuCl銹青銅的電荷轉移電阻小于裸青銅的,表明腐蝕初期帶CuCl銹青銅的耐蝕性比裸青銅的差。其原因有多方面:首先CuCl與腐蝕介質(Cl-)發生反應生成CuCl2-和CuCl3-,即CuCl被絡合而溶解;其次,CuCl可以與O2和H2O發生反應生成CuCl2·3Cu(OH)2和HCl,HCl中的H+對基體進一步腐蝕生成CuCl,CuCl可再次與Cl-反應生成CuCl2·3Cu(OH)2,最終導致青銅器基體被破壞。由圖3(b)和表2還可見:浸泡時間延長至48 h時,帶CuCl銹青銅的容抗弧半徑增大,表明其表面腐蝕產物隨浸泡時間的延長逐步增厚;帶CuCl銹青銅的電荷轉移電阻大于裸青銅的,說明浸泡48 h時帶CuCl銹青銅的耐蝕性比裸青銅的好。這可能是由于CuCl銹結構疏松,腐蝕性介質通過CuCl銹層與CuCl2-反應生成Cu2(OH)2CO3的速率更快,減緩了基體的腐蝕。
由圖3(c)可見:帶混合銹青銅在大氣模擬液中浸泡1 h和48 h時的阻抗譜與裸青銅的相似。由表2可見:在浸泡1 h時,帶混合銹青銅的極化電阻略小于裸青銅的,說明帶混合銹青銅的腐蝕速率更快;浸泡48 h時,帶混合銹青銅的極化電阻增大,腐蝕速率降低,這是因為此時混合銹與腐蝕介質發生反應,生成更穩定的腐蝕產物。
另外,在浸泡48 h時,4種青銅的極化電阻比浸泡1 h時的大,這表明隨著浸泡時間的延長,4種青銅的腐蝕均減緩。
2.3 在海洋環境模擬液中的電化學腐蝕行為
由圖5可見:在海洋環境模擬液中,帶混合銹青銅和裸青銅的開路電位變化趨勢相似,表現為先急劇升高然后趨于穩定,剛浸入海洋環境模擬液中時,這2種青銅表面被迅速氧化,因此開路電位出現急劇升高,待氧化膜覆蓋青銅表面后,開路電位就趨于穩定了;帶Cu2O銹青銅的開路電位隨浸泡時間的波動不大,這可能是由于Cu2O的氧化膜較為致密;帶CuCl銹青銅的開路電位隨浸泡時間延長緩慢下降,說明腐蝕介質穿過酥松的銹層腐蝕基體,但反應相對緩慢。

圖5 海洋環境模擬液中4種青銅的開路電位隨浸泡時間的變化曲線Fig. 5 Curves of open circuit potential vs time for 4 kinds of bronze in marine environment simulation solution
在海洋環境模擬液中穩定后即浸泡3 600 s后, 4種青銅開路電位大小順序為:帶Cu2O銹青銅(0.012 V)>帶CuCl銹青銅(-0.034 V)>帶混合銹(-0.044 V)>裸青銅(-0.072 V)。結果表明,裸青銅的腐蝕傾向最大,帶Cu2O銹青銅的最小,與大氣環境模擬液中呈現的規律相同。同時,與大氣環境模擬液中的開路電位相比,海洋環境模擬液中的開路電位均出現負移,說明在海洋環境模擬液中4種青銅的腐蝕傾向比在大氣環境模擬液中的更大。
圖6是3種帶銹青銅與裸青銅在海洋環境模擬液中浸泡1 h和48 h時電化學阻抗譜的對比。采用圖4(a)和圖4(b)所示等效電路對裸青銅、帶Cu2O銹青銅和帶CuCl銹青銅浸泡1 h和48 h時的阻抗譜時進行擬合,采用圖4(b)所示的等效電路對帶混合銹銹青銅浸泡1 h和48 h時的阻抗譜進行擬合。表3是4種青銅在海洋環境模擬液中阻抗譜的擬合參數。
由圖6(a)可見:在海洋環境模擬液中浸泡1 h時,裸青銅和帶Cu2O銹青銅阻抗譜的高頻區均出現了一個容抗弧,在低頻區均出現擴散尾弧。由表3可見:在浸泡1 h時,裸青銅的極化電阻略小于帶Cu2O銹青銅的;當浸泡時間延長到48 h時,這2種青銅的膜電阻均增大,但裸青銅膜電阻的增大幅度更大,說明隨著浸泡時間的延長,裸青銅更耐腐蝕,但兩者相差不大。由前文可知,在腐蝕初期裸青銅也會生成Cu2O、H+和含氯化合物,一部分Cu2O生成Cu4SO4(OH)6,但在高含量Cl-環境中,隨著H+的生成,另一部分Cu2O會產生CuCl2·3Cu(OH)2,如式(4)所示,使青銅發生粉化。

CuCl2·3Cu(OH)2
(4)
由圖6(b)可見:與浸泡1 h時比,浸泡48 h時帶CuCl銹青銅的容抗弧半徑基本不變,腐蝕速率基本不變,同時低頻區也出現了擴散尾弧,此時反應主要由擴散控制;浸泡1 h時,帶CuCl銹青銅的電荷轉移電阻略小于裸青銅的,表明帶CuCl銹青銅更易被腐蝕,這主要由于在高含量Cl-環境中,CuCl極易發生反應,如式(3)和式(5)所示,而CuCl4-具有很強的氧化性,會破壞青銅基體,見式(6),如此循環往復,從而產生更多的CuCl2·3Cu(OH)2,使青銅基體遭到嚴重破壞。

(a) 帶Cu2O銹青銅(b) 帶CuCl銹青銅(c) 帶混合銹青銅圖6 3種帶銹青銅與裸青銅在海洋環境模擬液中浸泡1 h和48 h時電化學阻抗譜的對比Fig. 6 EIS comparison of 3 kinds of patinated bronze with bare bronze in marine environment simulation solution:(a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina
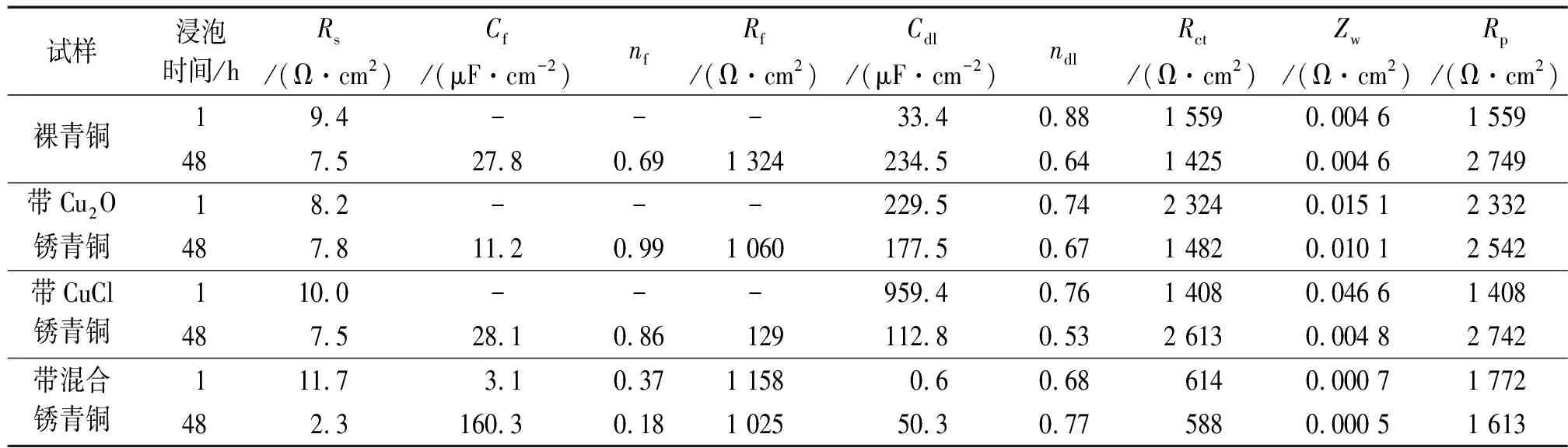
試樣浸泡時間/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青銅19.4---33.40.881 5590.004 61 559487.527.80.691 324234.50.641 4250.004 62 749帶Cu2O銹青銅18.2---229.50.742 3240.015 12 332487.811.20.991 060177.50.671 4820.010 12 542帶CuCl銹青銅110.0---959.40.761 4080.046 61 408487.528.10.86129112.80.532 6130.004 82 742帶混合銹青銅111.73.10.371 1580.60.686140.000 71 772482.3160.30.181 02550.30.775880.000 51 613

(5)

(6)
由圖6(c)可見,在海洋環境模擬液中浸泡1 h時,帶混合銹青銅在中高頻區就出現兩個耦合的容抗弧,這可能是混合銹本身具有沉積膜特征,在大氣模擬液中帶CuCl銹青銅也表現出微弱的沉積膜特征,但由于銹層不夠致密,該特征不明顯;浸泡時間延長至48 h時,容抗弧半徑變小,說明其耐蝕性變差。 由表3可見:浸泡1 h時,裸青銅的極化電阻略低于帶混合銹青銅的,表明帶混合銹青銅在海洋環境模擬液中的腐蝕速率更小。
另外,對比可知,4種青銅在大氣環境模擬液中的極化電阻基本比在海洋環境模擬液中的小,說明海洋環境中的高含量Cl-會增大對青銅的腐蝕。
2.4 在SO2環境模擬液中的電化學腐蝕行為
由圖7可見:在SO2環境模擬液中,裸青銅表面生成的鈍化膜在模擬液中緩慢溶解,所以其開路電位隨浸泡時間的延長而下降,但電位最終保持相對平穩;Cu2O銹層存在孔隙,腐蝕介質容易侵入基體,導致帶Cu2O銹青銅的開路電位開始劇烈下降,但之后形成更均勻的腐蝕產物層,因此其開路電位趨于穩定;帶CuCl銹青銅的開路電位起初是一個緩慢下降的過程,隨后經歷了較為快速的下降,說明腐蝕介質在浸泡一段時間以后才與基體發生反應,這可能是腐蝕介質更易與CuCl發生反應,最終趨于穩定。帶混合銹青銅的開路電位曲線相對穩定,這說明混合銹的結構致密,與腐蝕介質反應緩慢。

圖7 SO2環境模擬液中4種青銅的開路電位隨浸泡時間的變化曲線Fig. 7 Curves of open circuit potential vs time for 4 kinds of bronze in SO2 environment simulation solution
在SO2環境模擬液中穩定后即浸泡3 600 s后,4種青銅的開路電位大小順序為帶Cu2O銹青銅(-0.101 V)>帶混合銹青銅(-0.129 V)>帶CuCl銹青銅(-0.214 V)>裸青銅(-0.234 V)。這說明在SO2環境模擬液中,帶Cu2O銹青銅的腐蝕傾向最小,而裸青銅的最大;較大氣環境模擬液和海洋環境模擬液中的開路電位相比,4種青銅在SO2環境模擬液中的開路電位均發生了負移,表明青銅在該腐蝕介質中的腐蝕傾向最大。
圖8是3種帶銹青銅與裸青銅在SO2環境模擬液下浸泡1 h和48 h時電化學阻抗譜的對比。裸青銅、帶Cu2O銹青銅和帶CuCl銹青銅浸泡1 h和48 h時的阻抗譜的擬合分別采用圖4(a)和圖4(c)所示等效電路,帶混合銹青銅浸泡時間1 h和48 h時的阻抗譜的擬合采用圖4(c)所示等效電路。表4是4種青銅在SO2環境模擬液中電化學阻抗譜的擬合參數。
由圖8(a)和表4可見:在SO2環境模擬液中浸泡1 h時,裸青銅和帶Cu2O銹青銅在高頻區均出現了一個容抗弧,低頻出現擴散尾弧,裸青銅和帶Cu2O銹青銅的電荷轉移電阻均較大,而浸泡48 h時,電荷轉移電阻顯著下降,容抗弧半徑均減小,表明兩者腐蝕速率均增大,但此時膜電阻均有所增大,低頻區的擴散尾弧均消失,表明腐蝕產物沉積在青銅表面,填滿銹層的孔隙,形成均勻的腐蝕產物層,其反應為

(a) 帶Cu2O銹青銅(b) 帶CuCl銹青銅(c) 帶混合銹青銅圖8 3種帶銹青銅與裸青銅在SO2環境模擬液中浸泡1 h和48 h時電化學阻抗譜的對比Fig. 8 EIS comparison of 3 kinds of patinated bronze with bare bronze in SO2 environment simulation solution:(a) bronze with Cu2O; (b) bronze with CuCl; (c) bronze with mixed patina
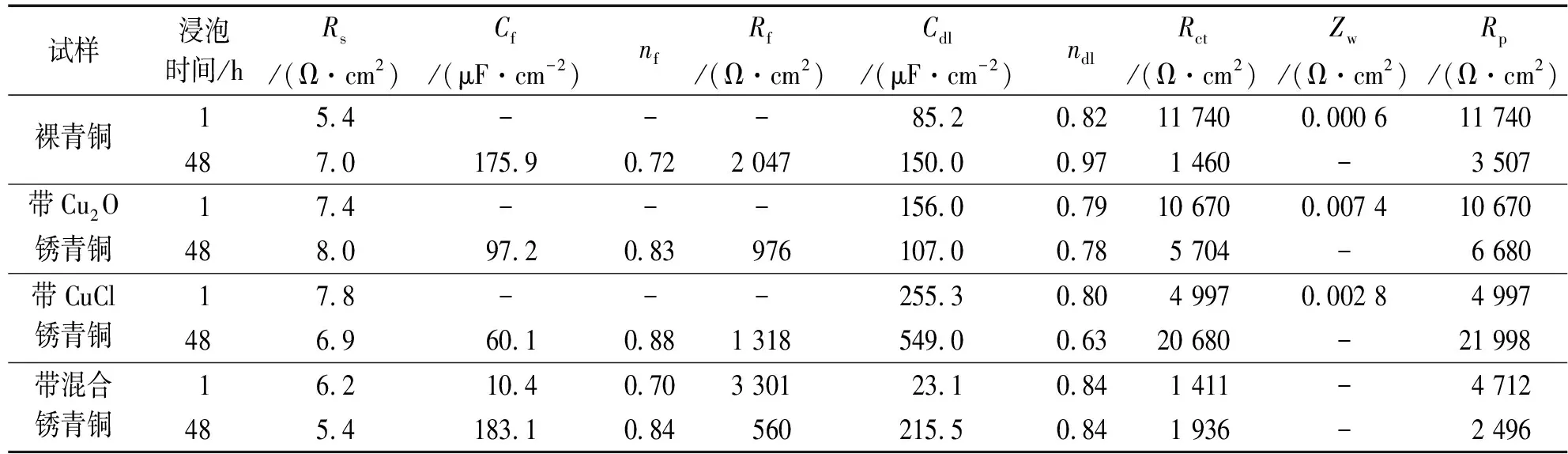
試樣浸泡時間/hRs/(Ω·cm2)Cf/(μF·cm-2)nfRf/(Ω·cm2)Cdl/(μF·cm-2)ndlRct/(Ω·cm2)Zw/(Ω·cm2)Rp/(Ω·cm2)裸青銅15.4---85.20.8211 7400.000 611 740487.0175.90.722 047150.00.971 460-3 507帶Cu2O銹青銅17.4---156.00.7910 6700.007 410 670488.097.20.83976107.00.785 704-6 680帶CuCl銹青銅17.8---255.30.804 9970.002 84 997486.960.10.881 318549.00.6320 680-21 998帶混合銹青銅16.210.40.703 30123.10.841 411-4 712485.4183.10.84560215.50.841 936-2 496

(7)
隨后Cu2O進一步生成Cu4SO4(OH)6。此時,裸青銅的極化電阻小于帶Cu2O銹青銅的,這可能是由于帶Cu2O銹青銅生成的腐蝕產物層更致密均勻引起的。
由圖8(b)和表4可見:在SO2環境模擬液中浸泡1 h時,帶CuCl銹青銅的阻抗譜與裸青銅的相似,帶CuCl銹青銅的電荷轉移電阻比裸青銅的小,表明此時帶CuCl銹青銅的腐蝕速率比裸青銅的大;浸泡48 h時,帶CuCl銹青銅在高頻區呈現出兩個耦合的容抗弧,擴散尾弧消失,電荷轉移電阻急劇增大,且遠大于裸青銅的電荷轉移電阻,表明此時帶CuCl銹青銅更耐腐蝕,其表面生成均勻穩定的腐蝕產物,腐蝕完全由電化學活化控制。
由圖8(c)和表4可見:在SO2環境模擬液中浸泡1 h和48 h時,帶混合銹青銅在中高頻區均出現容抗弧,但未出現擴散尾弧,其原因可能是混合銹層均勻覆蓋在基體表面,阻抗譜表現的是銹層特性;帶混合銹青銅浸泡48 h時的極化電阻比浸泡1 h時的小,表明腐蝕速率隨浸泡時間延長而增大;同時,浸泡1 h和48 h時帶混合銹青銅的極化電阻均小于裸青銅的,即其耐蝕性比裸青銅的差。
對比4種青銅在3種腐蝕介質中的極化電阻可知,其大小順序為大氣環境模擬液>SO2環境模擬液>海洋環境模擬液,這表明Cl-和SO2的存在均會加快青銅的腐蝕,并且,海洋環境的腐蝕性比SO2環境的更強。
3 結論
(1) 帶Cu2O銹青銅在3種環境模擬液中的腐蝕傾向性最小,而裸青銅的最大。
(2) 青銅試樣在3種環境模擬液中的腐蝕程度順序為:海洋環境模擬液>SO2環境模擬液>大氣環境模擬液。Cl-和SO2均會加速青銅的腐蝕,且Cl-有更強的腐蝕性。
(3) 在大氣環境模擬液中浸泡1 h時,裸青銅的耐蝕性最好,隨著浸泡時間的延長,3種帶銹青銅的腐蝕速率都降低,帶銹青銅表現出更高的耐蝕性,耐蝕性順序為帶CuCl銹青銅>帶Cu2O銹青銅>帶混合銹青銅;在海洋環境模擬液中,4種青銅的耐蝕性均較差,表明青銅文物在該環境中會發生較嚴重的腐蝕,并且耐蝕性不隨時間的變化而明顯增強;在SO2環境模擬液中,除了帶CuCl銹青銅,其余青銅的耐蝕性均隨著時間的推移大幅度降低,表明青銅文物保存時間越長,腐蝕破壞越嚴重。

