人工牛黃微生物限度檢查方法適用性實驗*
王永智,吳宏斌,邱文娜,方朝東,饒玲,聶利芳
(1.泰州醫藥高新技術產業園區疫苗工程中心,泰州 225300;2.江蘇大同盟制藥有限公司,泰州 225300)
人工牛黃制劑處方中含有牛膽粉等多種具有抑菌活性的成分[1-2],抑菌成分可能影響供試品中污染的微生物,從而影響微生物檢測結果準確性[3]。筆者在檢查方法、菌種選擇、培養基使用和限度標準制定等方面參照《中華人民共和國藥典》2015年版四部通則1105,1106和1107[4]要求,考察微生物限度檢查方法的適用性,以期客觀反映供試品中的微生物情況,確保檢測方法的可控及檢測結果的準確性和嚴謹性[5-6],現報道如下。
1 儀器與材料
1.1儀器 GNP-9080生化培養箱(上海精宏實驗設備有限公司);MJPS 150生化培養箱(上海精宏實驗設備有限公司);生物安全柜[型號:Thermo Forma/1300,賽默飛世爾科技(中國)有限公司];超凈工作臺(型號:SW-CJ-1FD,蘇州凈化設備有限公司)。
1.2試藥 人工牛黃(江蘇某制藥有限公司,批號:20170402,20170512,20170527)。
1.3培養基 胰酪大豆胨瓊脂培養基(批號:1702042)、沙氏葡萄糖瓊脂培養基 (批號:1702132)、胰酪大豆胨液體培養基(批號:161205)、腸道菌增菌液體培養基 (批號:1603022)、紫紅膽鹽葡萄糖瓊脂培養基(批號:1601142)、麥糠凱液體培養基(批號:161227)、麥糠凱瓊脂培養基(批號:160225)、RV沙門菌增菌液體培養基 (批號:1602152)、木糖賴氨酸脫氧膽酸鹽瓊脂培養基 (批號:161130)、三糖鐵瓊脂培養基(批號:151221)均由北京三藥科技開發公司提供。
1.4實驗菌株 金黃色葡萄球菌(Staphylococcusaureus) [CMCC(B)26 003];大腸埃希菌(Escherichiacoli) [CMCC (B)44 102];銅綠假單胞菌(Pseudomonasaeruginosa)[ CMCC ( B )10 104];枯草芽孢桿菌(Bacillussubtilis)[ CMCC(B)63 501];白念珠菌(Candidaalbicans) [CMCC(F)98 001];黑曲霉(Aspergilllusniger)[CMCC(F)98 003];乙型副傷寒沙門菌(SalmonellaparatyphiB) [CMCC(B)50 094]均購自中國食品藥品檢定研究院。
2 方法與結果
2.1需氧菌菌落計數方法適用性實驗
2.1.1菌液的制備 分別接種大腸埃希菌、乙型副傷寒沙門菌、銅綠假單胞菌的新鮮培養物至胰酪大豆胨液體培養基,30~35 ℃培養18~24 h,分別取上述培養物用pH值7.0無菌氯化鈉-蛋白胨緩沖液,依次稀釋制成每毫升含菌數<100 菌落形成單位(colony-forming unit,cfu)菌懸液;分別取金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌新鮮培養物至胰酪大豆胨液體培養基,30~35 ℃培養18~24 h,分別取上述培養物用pH值7.0無菌氯化鈉-蛋白胨緩沖液稀釋制成每毫升含菌數為100~10 000 cfu菌懸液;接種白念珠菌的新鮮培養物至沙氏葡萄糖液體培養基,20~25 ℃培養2~3 d,取此培養物用pH值7.0無菌氯化鈉-蛋白胨緩沖液,稀釋制成每毫升含菌100~10 000 cfu的菌懸液;將黑曲霉斜面的新鮮培養物接種至沙氏葡萄糖瓊脂斜面培養基上,20~25 ℃培養5~7 d,使大量孢子成熟。加入含0.05%聚山梨酯80的pH值7.0無菌氯化鈉-蛋白胨緩沖液3~5 mL,將孢子洗脫。然后用管口帶有薄無菌棉花或紗布能過濾菌絲的無菌毛細吸管吸出孢子懸液至無菌試管,用含0.05%聚山梨酯80的pH值7.0無菌氯化鈉-蛋白胨緩沖液稀釋制成每毫升含孢子100~10 000 cfu的孢子懸液。
2.1.2供試液的制備 稱取供試品10 g,加胰酪大豆胨液體培養基至100 mL,充分振搖使混勻,作為1:10供試液;取1:10供試液10 mL,加胰酪大豆胨液體培養基至100 mL,充分振搖使混勻,作為1:100供試液。
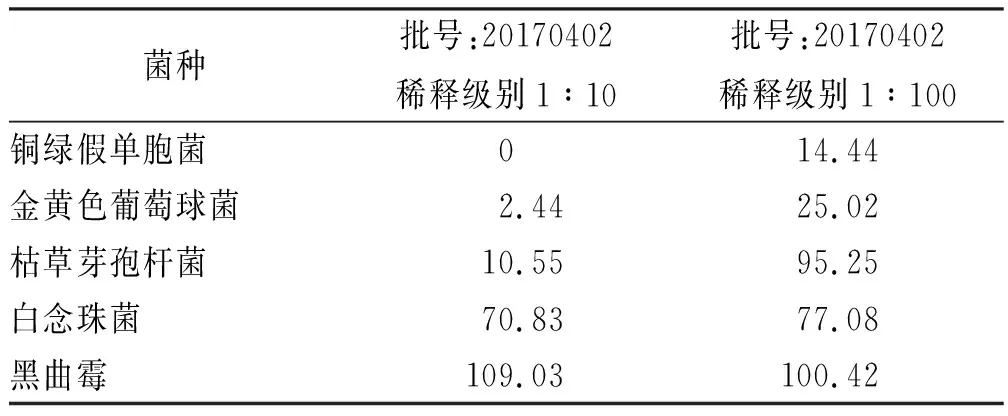
2.1.3計數方法及回收率計算 取稀釋級別分別為1:10,1:100供試液9.9 mL與每毫升含菌數為100~10 000 cfu的各實驗菌0.1 mL混勻,作為實驗組。以稀釋級別1:10,1:100 供試液9.9 mL和胰酪大豆胨液體培養基0.1 mL混勻作為供試品對照組;以9.9 mL胰酪大豆胨液體培養基和每毫升含菌數為100~10 000 cfu的各實驗菌0.1 mL混勻,同法操作,作為菌液對照組。分別吸取上述各處理組1 mL注入平皿,立即傾注胰酪大豆胨瓊脂培養基15~20 mL,混勻,凝固,于30~35 ℃倒置培養3 d,點計菌落數。計算各實驗菌回收率,實驗組菌回收率(%)=(實驗組平均菌落數-供試品對照組平均菌落數)/菌液組平均菌落數×100%。結果見表1。
由表1可知,采用稀釋級別為1:10及1:100的供試液對人工牛黃需氧菌總數計數方法進行驗證,部分實驗菌株實驗組回收率<50%,不滿足《中華人民共和國藥典》2015年版四部通則1105中對于實驗組菌落回收率的要求。采用含3%聚山梨酯80及0.3%卵磷脂的胰酪大豆胨液體培養基作為稀釋液稀釋供試品,去除供試品抑菌活性,重新進行需氧菌計數方法適用性實驗。
表1實驗組菌落數回收率實驗結果
Tab.1Resultsofrecoverytestonthebacteriainexperimentalgroup
%
2.2需氧菌菌落計數方法適用性實驗(第2次)
2.2.1供試液的制備 以含3%聚山梨酯80及0.3%卵磷脂的胰酪大豆胨液體培養基作為稀釋液配制樣品。取供試品10 g,加上述稀釋液至100 mL,充分振搖混勻,作為1:10供試液;取1:10供試品20 mL,加上述稀釋液至100 mL,充分振搖使混勻,作為1:50供試液。
2.2.2計數方法及回收率計算 按“2.1.3”項方法制備各實驗菌株實驗組、菌液對照組、供試品對照組并培養計數,同時以含3%聚山梨酯80及0.3%卵磷脂的胰酪大豆胨液體培養基代替供試液,作為中和劑對照組,按“2.1.3”項方法處理。分別計算實驗組菌株回收率及中和劑對照組菌落數回收率,結果見表2。
表2實驗組菌落數回收率實驗結果
Tab.2Resultsofrecoverytestonthebacteriainexperimentalgroup

%
由表2可知,以含3%聚山梨酯80及0.3%卵磷脂的胰酪大豆胨液體培養基作為稀釋劑,采用1:50 稀釋級別進行需氧菌總數計數方法適用性實驗時,所有菌種實驗組回收率均在50%~200%,采用該方法對批號為20170512,20170527樣品再獨立進行兩次需氧菌計數方法適用性實驗,以確認該方法的可靠性。結果見表3。
表3實驗組菌落數回收率實驗結果
Tab.3Resultsofrecoverytestonthebacteriainexperimentalgroup

%
2.3真菌和酵母菌總數計數方法適用性實驗 按照“2.2.1”項方法制備供試液;以白念珠菌、黑曲霉作為實驗菌株,按照“2.1.3”項方法制備各實驗菌株實驗組、菌液對照組;按照“2.2.2”項方法制備中和劑對照組。分別吸取上述各組1 mL注入平皿,立即傾注沙氏葡萄糖瓊脂培養基15~20 mL,混勻,凝固,于20~25 ℃倒置培養5 d點計菌落數,結果見表4。
表4實驗組菌落數回收率實驗結果
Tab.4Resultsofrecoverytestonthebacteriainexperimentalgroup

%
由表4結果可知,以含聚山梨酯80及0.3%卵磷脂的胰酪大豆胨液體培養基作為稀釋劑,采用1:10稀釋級別進行真菌和酵母菌總數計數方法適用性實驗時,所有菌種實驗組回收率均符合要求,采用此方法對批號為20170512,20170527的樣品再獨立進行兩次真菌和酵母菌總數計數方法適用性實驗,以確認該方法的可靠性。結果見表5。
表5實驗組菌落數回收率實驗結果
Tab.5Resultsofrecoverytestonthebacteriainexperimentalgroup

%
2.4控制菌檢查方法適用性實驗 依據《中華人民共和國藥典》2015年版四部通則1107中非無菌微生物限度標準要求[4],本品控制菌檢查項目標準為:不得檢出大腸埃希菌(1 g);不得檢出沙門菌(10 g);耐膽鹽革蘭陰性菌應小于102(1 g)。
2.4.1大腸埃希菌檢查方法適用性實驗 取1:10供試液10 mL,每毫升含菌數<100 cfu的大腸埃希菌菌懸液1 mL,加至約100 mL胰酪大豆胨液體培養基,作為實驗組;取胰酪大豆胨液體培養基10 mL,加至約100 mL胰酪大豆胨液體培養基,作為陰性對照組;取每毫升含菌數<100 cfu大腸埃希菌菌懸液1 mL,加至約100 mL胰酪大豆胨液體培養基作為陽性對照組。以上各處理組均置于30~35 ℃培養18 h。
分別取各組培養物1 mL,接種至含100 mL麥康凱液體培養基內培養,42~44 ℃培養24 h。取麥康凱液體培養物劃線接種于麥康凱瓊脂平板上30~35 ℃培養18 h,結果見表6。
表6大腸埃希菌檢查方法適用性實驗結果
Tab.6ResultsofapplicabilitytestonthemethodofEscherichiacoli

供試品201704022017051220170527實驗組+++陽性對照組+++陰性對照組---
+表示培養基有菌生長或呈陽性;-表示培養基無菌生長或呈陰性
+ represents the growth of bacteria in the medium or the positive result;- represents no bacteria growth in the medium of the negative result
2.4.2乙型副傷寒沙門菌檢查方法適用性實驗 取10 g供試品和每毫升含菌數不大于100 cfu的沙門菌菌懸液1 mL,置100 mL胰酪大豆胨液體培養基,作為實驗組;取10 mL胰酪大豆胨液體培養基,置100 mL胰酪大豆胨液體培養基,作為陰性對照組;取每毫升含菌數不大于100 cfu沙門菌菌懸液1 mL,置100 mL胰酪大豆胨液體培養基,作為陽性對照組;各處理組置于30~35 ℃培養18 h。
分別取上述培養物各0.1 mL,分別接種至10 mLRV沙門菌增菌液體培養基,30~35 ℃培養18 h。取少量RV沙門菌增菌液體培養物劃線接種于木糖賴氨酸脫氧膽酸鹽瓊脂平板上,30~35 ℃培養18 h。用接種針挑取疑似菌落于三糖鐵瓊脂培養基高層斜面上進行斜面和高層穿刺接種,培養18 h。結果見表7。
2.4.3耐膽鹽革蘭氏陰性菌檢查方法適用性實驗 稱取供試品10 g,加入胰酪大豆胨液體培養基至100 mL制成1:10供試液,混勻,20~25 ℃培養2 h,分別取此供試液1,0.1,0.01 mL(相當于供試品0.1,0.01,0.001 g),接種至10 mL腸道菌增菌液體培養基,分別加入不大于100 cfu的大腸埃希菌懸液1 mL,作為實驗組,同法制備銅綠假單胞菌實驗組;將1 mL胰酪大豆胨液體培養基接種至腸道增菌液體培養基10 mL中,加入不大于100 cfu的大腸埃希菌懸液1 mL,作為陽性對照組,同法制備銅綠假單胞菌陽性對照組;將1 mL胰酪大豆胨液體培養基接種至腸道增菌液體培養基10 mL中,作為陰性對照組。以上各處理組于30~35 ℃培養24 h。
表7乙型副傷寒沙門菌檢查方法適用性實驗結果
Tab.7ResultsofapplicabilitytestonthemethodofSalmonellaparatyphiB

供試品201704022017051220170527實驗組+++陽性對照組+++陰性對照組---
+表示培養基有菌生長或呈陽性;-表示培養基無菌生長或呈陰性
+ represents the growth of bacteria in the medium or the positive result;- represents no bacteria growth in the medium of the negative result
分別將各組培養物劃線接種至紫紅膽鹽葡萄糖瓊脂培養基平板上,于30~35 ℃培養24 h。結果見表8。
3 討論
采用平皿法對人工牛黃進行微生物限度檢查方法適用性檢查發現,稀釋級別為1:10及1:100的實驗組均有部分實驗菌株回收率不滿足50%~200%的要求。通過以含3%聚山梨酯80及0.3%卵磷脂胰酪大豆胨液體培養基作為稀釋液溶解、稀釋樣品,結果表明當稀釋級別為1:50時,成功消除了人工牛黃的抑菌活性,各實驗菌株的回收率均滿足要求。
在進行微生物限度檢查方法適用性實驗時,應根據藥品不同的抑菌活性采用適宜的方法。對于無抑菌活性的藥品,可直接采用平皿法進行檢查方法適用性驗證[7]。如藥品有抑菌活性則需要通過增大稀釋液或培養基體積、加入中和劑或滅活劑、采用薄膜過濾法或上述幾種方法的聯合使用等手段去除樣品的抑菌活性[4],才能反映藥品真實的微生物污染情況[8]并驗證藥品抑菌作用去除的有效性,以及去除方法對污染菌生長檢出的影響[6],若使用中和劑或滅活劑,實驗中應設中和劑或滅活劑對照組,即取相應量稀釋液替代供試品同實驗組操作,以確認其有效性和對微生物無毒性。
表8耐膽鹽革蘭陰性菌檢查方法適用性實驗結果
Tab.8Resultsofapplicabilitytestonthemethodofbile-tolerantgram-negativebacteria
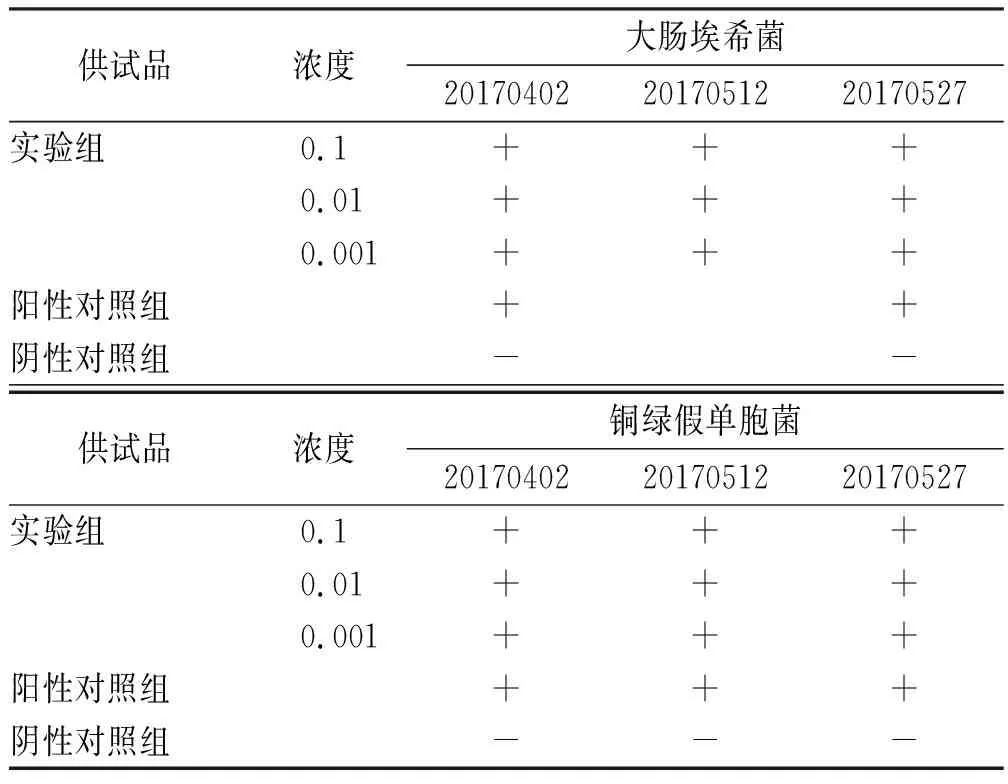
供試品濃度大腸埃希菌201704022017051220170527實驗組0.1+++0.01+++0.001+++陽性對照組++陰性對照組--供試品濃度銅綠假單胞菌201704022017051220170527實驗組0.1+++0.01+++0.001+++陽性對照組+++陰性對照組---
+表示培養基有菌生長或呈陽性;-表示培養基無菌生長或呈陰性
+ represents the growth of bacteria in the medium or the positive result;- represents no bacteria growth in the medium of the negative result

