當陽地區鲊廣椒中乳酸菌的分離鑒定及其應用
李 娜,王玉榮,葛東穎,代凱文,張振東,郭 壯*
鲊廣椒以大米粉和辣椒為主要原料,同時輔以食鹽、白胡椒和花椒等調味料,通過密封發酵制作而成[1],因口感酸辣而深受湖北及云南、貴州、四川和重慶等我國西南地區人們的喜愛[2]。由于鲊廣椒制作環境較為開放,且多以農戶手工制作為主,因而其具有較高的微生物多樣性[3]。王玉榮等[4-5]采用MiSeq高通量測序技術對當陽地區鲊廣椒微生物多樣性進行了解析,結果發現其優勢真菌屬為念珠菌屬(Candida)、分枝孢子菌屬(Cladosporium)、曲霉菌屬(Eurotium)等,且真菌含量過高不利于鲊廣椒滋味品質的形成;當陽地區鲊廣椒中細菌主要為乳酸桿菌屬(Lactobacillus)、魏斯氏菌屬(Weissella)、片球菌屬(Pediococcus)、葡萄球菌(Staphylococcus)、肉胞菌屬(Carnimonas),腸桿菌屬(Enterobacter)和普氏菌屬(Prevotella),其中乳酸菌的相對含量高達81.75%,且Lactobacillus對鲊廣椒風味的形成具有積極的作用。由此可見,從鲊廣椒中進行乳酸菌分離鑒定,同時使用分離株強化發酵制備鲊廣椒對鲊廣椒中致病菌或腐敗菌的抑制及品質的提升可能具有積極的意義[6]。
通過仿生技術(電子鼻和電子舌)已經實現了傳統發酵食品風味[7]和滋味[8]的數字化評價,且電子鼻和電子舌相結合在蘋果汁[9]、紅酒[10]、綠茶[11]和牛奶[12]的品質評價中有了廣泛的應用。
本研究從湖北省當陽地區采集了5份鲊廣椒樣品,采用傳統培養分離方法和分子生物學技術對其中蘊含的乳酸菌菌株進行了分離鑒定,并采用分離株強化發酵制備鲊廣椒,采用電子鼻和電子舌對其風味和滋味品質進行評價,同時通過主成分分析(principal component analysis,PCA)對具有優良發酵特性的乳酸菌菌株進行了初步篩選,為湖北省鲊廣椒細菌多樣性的解析提供數據支撐,同時為后續具有優良發酵特性鲊廣椒菌株的篩選提供菌株支持。
1 材料與方法
1.1 材料與試劑
MRS固體培養基:青島海博生物技術有限公司。
細菌基因組脫氧核糖核酸(deoxyribonucleicacid,DNA)小量制備試劑盒、DNA凝膠回收試劑盒、DNA Marker:康寧生命科學吳江有限公司;引物27F/1495R:武漢天一輝遠生物科技有限公司;蛋白酶K(20 U/μg)、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、DNA聚合酶(5 U/μL)、2×聚合酶鏈式反應(polymerase chain reaction,PCR)mix、10×PCR buffer、pMD18-T克隆載體:大連寶生物工程有限公司;大米粉、二荊條辣椒、花椒粉、胡椒粉、食鹽(均為食品級):襄陽市鑫源超市;甘油、磷酸二氫鉀、氫氧化鈉、鹽酸、磷酸、氯化鈉、吐溫-80、草酸、琥珀酸、酒石酸、檸檬酸、蘋果酸、乳酸、乙酸(均為分析純):上海國藥集團化學試劑有限公司;參比溶液、內部溶液和外部溶液:日本INSENT公司。
1.2 儀器與設備
HR40-ⅡB2型生物安全柜:青島海爾股份有限公司;QYC-2102C全溫培養搖床:上海新苗醫療器械制造有限公司;DG250厭氧工作站:英國Don Whitley公司;SA402B味覺分析系統:日本INSENT公司;LC-20ADXR高效液相色譜(high performance liquid chromatography,HPLC)儀:日本島津公司;VeritiTM96孔梯度PCR擴增儀:美國AB公司;Fluor Chem FC3化學發光凝膠成像系統:美國ProteinSimple公司;XFS-280手提式壓力蒸汽滅菌鍋:上虞市華宏凈化設備廠;ND-2000C微量紫外分光光度計:美國Nano Drop公司;DYY-12水平電泳儀:北京市六一儀器廠;PEN3型電子鼻:德國Airsense公司。
1.3 方法
1.3.1 樣品的采集
于2017年11月,從湖北省當陽市草埠湖鎮農戶家中采集鲊廣椒樣品5份,采集的樣品由大米和二荊條辣椒制作,發酵時間>20 d,無酸臭味且無霉斑。樣品采集后置于無菌采樣袋中帶回實驗室于24 h內完成疑似乳酸菌的分離。
1.3.2 乳酸菌的分離鑒定
分離:采用倍比稀釋法,將適當梯度的稀釋液涂布于含有1%CaCO3的MRS固體培養基上,于DG250厭氧工作站中(N2、H2和CO2的體積分數分別為85%、10%和5%)37 ℃條件下靜置培養48 h,根據菌落形態挑取單菌落并分離純化3次。將革蘭氏染色為陽性而過氧化氫酶實驗為陰性的菌株初步判定為乳酸菌[13],并采用甘油保藏法凍存于-80 ℃備用。
分子生物學鑒定:使用十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)法提取乳酸菌基因組DNA[14],并以其為模板進行16S rDNA PCR擴增。PCR擴增體系為10×PCR buffer 2.5 μL、dNTP(2.5 mol/L)2.0 μL、27F/1495R引物各0.5μL、rTaq酶(5U/μL)0.2μL、模板0.5μL、無菌水18.8 μL。PCR擴增條件為94 ℃預變性4 min;94 ℃變性1 min,55 ℃退火1 min,72 ℃延伸1 min 30 s,重復30個循環;72 ℃再延伸10 min。PCR產物經過清潔、連接和轉化后,挑取陽性克隆子送至南京金絲瑞生物科技公司進行測序。測序結果在美國國立生物技術信息中心(national center for biotechnology information,NCBI)上進行Blast比對,選取同源性≥99%的模式菌株的16S rDNA基因序列,采用MEGA 5.0軟件中的鄰接法(neighbor joining,NJ)構建系統發育樹。
1.3.3 植物乳桿菌強化發酵鲊廣椒的制作
原料攪拌均勻→接菌→裝壇→密封→發酵→成品
操作要點:每2 L玻璃泡菜壇中大米粉、辣椒、花椒、胡椒和鹽的添加量分別為750 g、225 g、3.15 g、3.15 g和75 g;L.plantarum接種量為5×106CFU/g鲊廣椒,其中鲊廣椒的質量為原輔料質量的總和;白酒噴灑量為3 mL,添加方式為壇口噴灑;發酵溫度為30 ℃,發酵周期為20 d。分別使用分離的L.plantarum對鲊廣椒樣品進行強化發酵,以不添加乳酸菌進行自然發酵的鲊廣椒為對照組。1.3.4 植物乳桿菌強化發酵鲊廣椒風味品質的評價
參照錢琴蓮等[15]的方法,使用電子鼻對鲊廣椒風味品質進行評價。稱取10 g鲊廣椒于樣品瓶中室溫平衡10 min,60 ℃水浴保溫20 min,設定進樣吸氣流量為200 mL/min,傳感器清潔時間為90 s,調零時間為5 s,測定時間為60 s,選取測定時間為49 s、50 s和51 s的響應值求平均值后進行分析。測定時先清洗儀器3 min,再測定樣品,每個樣品的測定時間間隔為1.5 min。
1.3.5 植物乳桿菌強化發酵鲊廣椒滋味品質的評價
參照王玉榮等[16]的方法,使用電子舌對鲊廣椒滋味品質進行評價。稱取50 g鲊廣椒樣品加入150 mL蒸餾水中浸泡30 min,8 000 r/min離心10 min后取上清液,測定各鲊廣椒樣品的酸味、苦味、澀味、鮮味和咸味5個基本味及后味A(澀味的回味)、后味B(苦味的回味)和豐度(鮮味的回味)3個基本味的回味,每個樣品測定4次,取后3次測定數據進行分析。每10個樣品為一批次進行測定,測定時均將對照組樣品設置為1號位,同時在數據處理時將其各滋味指標強度設置為0。
1.3.6 植物乳桿菌強化發酵鲊廣椒有機酸種類及含量的分析
參照楊成聰等[17]的方法,使用HPLC法對鲊廣椒樣品中的有機酸種類及含量進行測定。稱取20 g鲊廣椒樣品,加入0.01 mol/L的磷酸二氫鉀溶液定容至100 mL,浸泡30 min后,8 000 r/min離心10 min,上清液過0.45 μm的濾膜,濾液裝于樣品瓶中待測。繪制草酸、琥珀酸、乳酸、乙酸、蘋果酸、酒石酸和檸檬酸7種有機酸的標準曲線,并對線性回歸方程進行擬合。HPLC條件:流動相為0.01 mol/L的磷酸二氫鉀溶液(pH值=2.30),柱溫為25 ℃,檢測波長為215 nm,進樣體積為20 μL,流速為1.0 mL/min。
1.3.7 數據處理與統計分析
使用PCA法對L.plantarum強化發酵的鲊廣椒品質進行分析,使用MEGA 5.0軟件繪制系統發育樹,其他圖使用Origin 2017繪制。
2 結果與分析
2.1 當陽地區鲊廣椒中乳酸菌的分離與鑒定
采用傳統培養分離方法從5份當陽地區鲊廣椒樣品中分離得到18株疑似乳酸菌,編號為HBUAS52005~52010、HBUAS52015~52026。所有菌株在含有1%CaCO3的MRS固體培養基上均有透明圈,過氧化氫酶實驗均呈陰性,革蘭氏染色均呈陽性且細胞形態均為桿狀。提取18株疑似乳酸菌菌株的基因組DNA并進行16S rDNA基因的PCR擴增,PCR擴增電泳結果如圖1所示。
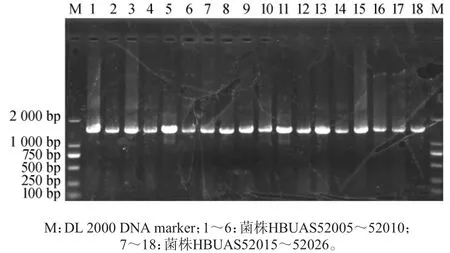
圖1 18株乳酸菌的16S rDNA基因PCR擴增電泳結果Fig. 1 Electrophoretic results of PCR amplification of 16S rDNA gene of 18 lactic acid bacteria
由圖1可知,18株疑似乳酸菌的PCR擴增產物堿基長度均為1 500 bp左右,條帶清晰且無明顯非特異性擴增條帶。PCR擴增產物經進一步清潔、連接和轉化后,挑選陽性克隆子送往測序公司進行測序。16S rDNA基因序列經比對分析后,選取同源性≥99%的乳酸菌模式種的16S rDNA基因序列構建系統發育樹,結果如圖2所示。
由 圖2 可 知,菌 株HBUAS52005、HBUAS52006、HBUAS52007、HBUAS52008、HBUAS52010、HBUAS52015、HBUAS52016、HBUAS52017、HBUAS52018、HBUAS52019和HBUAS52020與植物乳桿菌(Lactobacillus plantarum)JCM1149聚于一個分支且同源性為99%,因而被鑒定為L.plantarum;菌株HBUAS52009與Lactobacillus futsaii YM0097同源性為100%,故被鑒定為L.futsaii;菌株HBUAS52024和HBUAS52026與營養乳桿菌(Lactobacillus alimentarius)DSM20249的同源性為99%,因而被鑒定為L.alimentarius;菌株HBUAS52021、HBUAS52022、HBUAS52023和HBUAS 52025與泰國魏斯氏菌(Weissella thailandensis)FS61-1聚于一個分支,故被鑒定為W.thailandensis。結果表明,從5份當陽鲊廣椒中共分離到的18株疑似乳酸菌經16S rDNA序列分析后鑒定為2個屬和4個種,其中L.plantarum有11株,占總數的61.11%,因而是當陽地區鲊廣椒中的優勢乳酸菌。

圖2 基于16S rDNA基因序列構建的系統發育樹Fig. 2 Phylogenetic tree based on 16S rDNA gene sequences
2.2 植物乳桿菌強化發酵對鲊廣椒風味品質的影響
在對當陽地區鲊廣椒中乳酸菌分離、鑒定的基礎上,挑選其中11株L.plantarum分別進行鲊廣椒的強化發酵,同時以未添加乳酸菌自然發酵的鲊廣椒樣品為對照。各傳感器對不同處理鲊廣椒風味品質的分析如表1所示。
由表1可知,較自然發酵的鲊廣椒,傳感器W1C、W3C和W5C對L.plantarum強化發酵制備的鲊廣椒響應值的平均值均大于對照組,而傳感器W5S、W1S、W1W、W2S、W2W和W3S呈現出相反的趨勢。因傳感器W1C、W3C和W5C主要對鲊廣椒揮發性風味物質中的芳香類物質靈敏,而W5S、W1S、W1W、W2S、W2W和W3S主要對揮發性風味物質中的氫氧化物、甲烷、有機硫化物、萜類物質、乙醇或烷烴類物質靈敏,由此可見,添加L.plantarum進行強化發酵時多數鲊廣椒的芳香類物質含量得到了提升。
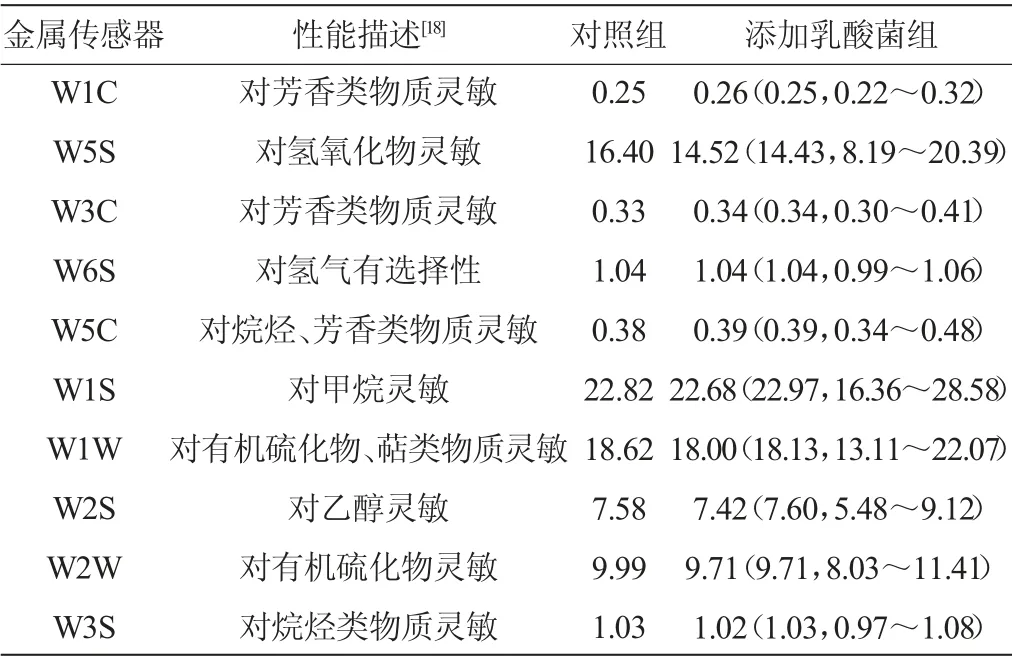
表1 各傳感器對鲊廣椒樣品風味品質的分析Table 1 Flavor quality analysis of Zhaguangjiao samples by each sensors
2.3 植物乳桿菌強化發酵對鲊廣椒滋味品質的影響
在對鲊廣椒風味品質評價的基礎上,進一步采用電子舌對鲊廣椒的滋味品質進行評價,各滋味指標相對強度的箱型圖如圖3所示。
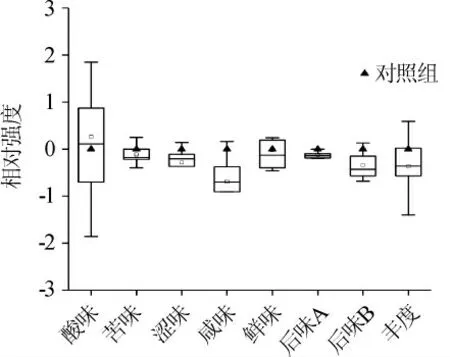
圖3 不同處理鲊廣椒各滋味指標相對強度值的箱型圖Fig. 3 Box plot of relative intensity value of each taste indexes of Zhaguangjiao samples with different treatments
由圖3可知,不同處理鲊廣椒在酸味、鮮味和豐度(鮮味的回味)指標上存在較大的差異,其極差值分別為3.71、1.65和1.99,而在后味B(苦味的回味)、苦味、澀味、后味A(澀味的回味)和咸味上的極差值較小,分別為0.81、0.65、0.51、0.27和0.97。有文獻報道[19-20],在使用SA402B電子舌系統對食品滋味品質進行評價時,若兩個樣品在某一指標上的相對強度值差異>1.0,則其差異可對消費者喜好性產生影響,否則無影響。由此可見,添加植物乳桿菌發酵對鲊廣椒的影響主要體現在酸味、豐度(鮮味的回味)和鮮味上,且添加L.plantarum進行強化發酵時,鲊廣椒的酸味強度得以提升,而其鮮味和豐度(鮮味的回味)強度呈現出相反的趨勢。因此,進一步采用HPLC對不同處理鲊廣椒中有機酸的種類及含量進行了測定,其結果如表2所示。

表2 不同處理鲊廣椒中有機酸含量的比較Table 2 Comparison of the organic acid contents in Zhaguangjiao samples with different treatments
由表2可知,7種有機酸回歸方程的相關系數均>0.99,呈現出良好的線性相關,說明擬合的回歸方程具有較高的可信性。乳酸和乙酸為鲊廣椒中的主要有機酸,含量分別在4.96~6.20 mg/g和1.15~8.92 mg/g范圍內。較自然發酵鲊廣椒,添加L.plantarum進行強化發酵時,多數鲊廣椒的乳酸、乙酸、蘋果酸、酒石酸和檸檬酸的含量明顯上升,而草酸和琥珀酸含量下降。
2.4 基于PCA植物乳桿菌強化發酵對鲊廣椒品質影響
為深入評價L.plantarum強化發酵對鲊廣椒品質的影響,進一步結合電子舌和電子鼻數據進行PCA,基于PCA鲊廣椒品質的因子載荷圖如圖4所示。
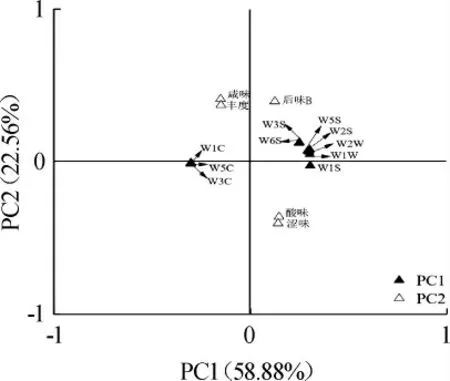
圖4 基于PCA鲊廣椒品質的因子載荷圖Fig. 4 Factor loading diagram of quality of Zhaguangjiao samples based on PCA
由圖4可知,第一主成分由10個電子鼻傳感器(W1C、W2S、W3C、W1S、W6S、W5C、W3S、W2W、W5S和W1W)構成,其貢獻率為58.88%。第二主成分由4個基本滋味指標(酸味、澀味、咸味、豐度)和1個回味指標(后味B)構成,其貢獻率為22.56%。PC1中W1C、W3C和W5C位于X軸負方向,而PC2中酸味偏于Y軸負方向,傳感器W1C、W3C和W5C對鲊廣椒中芳香性風味物質敏感,酸味亦為鲊廣椒的特征性指標,因而在空間排布上越偏向于左下方的鲊廣椒樣品其品質越好。基于PCA鲊廣椒品質的因子得分圖如圖5所示。
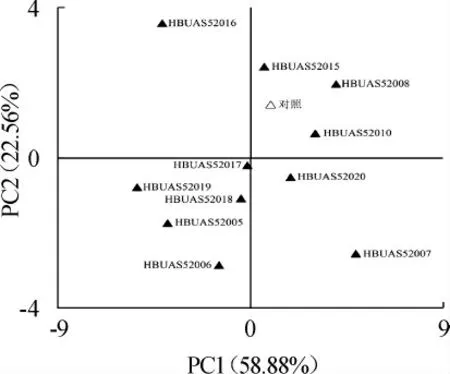
圖5 基于PCA鲊廣椒品質的因子得分圖Fig. 5 Factor score diagram of quality of Zhaguangjiao samples based on PCA
由圖5可知,除L. plantarum HBUAS52008外,其他L.plantarum強化發酵的鲊廣椒樣品在空間排布上均較自然發酵的樣品偏下或偏左。由此可見,多數L.plantarum強化發酵可提升鲊廣椒的品質。其中L.plantarum HBUAS52019強化發酵的樣品在空間上的排布最偏向X軸負方向,因而其制備的鲊廣椒風味最好,而L. plantarum HBUAS52006強化發酵的樣品最偏向Y軸負方向,因而其制備的鲊廣椒酸味最為濃郁。由此可見,L. plantarum HBUAS52019和L.plantarum HBUAS52006可作為潛在菌株用于后續鲊廣椒產業化乳酸菌菌株的篩選研究。
3 結論
本研究采用傳統培養分離方法和分子生物學技術從5份湖北省當陽地區鲊廣椒中分離鑒定得到11株植物乳桿菌(L.plantarum),采用分離得到的11株L.plantarum強化發酵鲊廣椒,結果表明,添加L.plantarum進行強化發酵時多數鲊廣椒風味物質中的芳香類物質含量明顯提升,滋味中酸味明顯提升,而鮮味和豐度(鮮味的回味)明顯下降,其中L.plantarum HBUAS52019和L.plantarum HBUAS52006可作為具有優良鲊廣椒發酵特性的菌株用于后續的篩選。

