結(jié)核分枝桿菌Rv1626的原核表達(dá)及其免疫功能研究
袁偉 許禮發(fā) 王曉春 張京燕 朱心怡

摘要:目的? 擬靶向結(jié)核分枝桿菌(M.tb)感染后的分泌期抗原Rv1626,構(gòu)建其原核表達(dá)質(zhì)粒pPROEX-Rv1626并表達(dá)純化,通過人群和動(dòng)物實(shí)驗(yàn)評(píng)價(jià)其免疫原性。方法? 構(gòu)建重組載體pPROEX-Rv1626,以全血干擾素釋放分析技術(shù)(WBIA)檢測(cè)其是否能被山西省長治市M.tb感染者的T細(xì)胞特異性識(shí)別;同時(shí)免疫小鼠,檢測(cè)其特異性誘導(dǎo)脾細(xì)胞分泌的IFN-γ、TNF-α和IL-2水平及抗體水平。結(jié)果? ①成功構(gòu)建重組載體pPROEX-Rv1626,并成功誘導(dǎo)表達(dá)、純化和鑒定;②rRv1626蛋白誘導(dǎo)M.tb感染者外周血中淋巴細(xì)胞產(chǎn)生的IFN-γ水平均顯著高于健康者對(duì)照者(P<0.001),ATB患者外周血中淋巴細(xì)胞分泌IFN-γ水平顯著高于LTBI人群(P<0.001);③BCG+Rv1626/DMT組產(chǎn)生的特異性相關(guān)抗體滴度顯著高于Rv1626/DMT組及BCG組(P<0.01);Rv1626/DMT組和BCG+Rv1626/DMT組的IgG2a/IgG1比值顯著高于DMT組和BCG組(F=33.69),且前兩組IgG2a /IgG1>1,傾向于Th1型細(xì)胞免疫應(yīng)答;④不同免疫組小鼠無論是PPD或rRv1626蛋白刺激,BCG+Rv1626/DMT組均分泌最高水平的IL-2、IFN-γ和TNF-α,其次為BCG組、Rv1626/DMT組,PBS組為最低。同時(shí)Rv1626/DMT組顯著高于DMT組(P<0.01)。結(jié)論? rRv1626能被M.tb感染者T細(xì)胞所識(shí)別,免疫小鼠能誘導(dǎo)抗原特異性Th1型細(xì)胞免疫應(yīng)答,可能與其提供的免疫保護(hù)力密切相關(guān)。
關(guān)鍵詞:結(jié)核分枝桿菌;Rv1626;原核表達(dá);免疫原性;結(jié)核病
中圖分類號(hào):R378.91+1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻(xiàn)標(biāo)識(shí)碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ?DOI:10.3969/j.issn.1006-1959.2019.01.022
文章編號(hào):1006-1959(2019)01-0065-04
Prokaryotic Expression and Immune Function of Mycobacterium Tuberculosis Rv1626
YUAN Wei1,XU Li-fa1,WANG Xiao-chun1,ZHANG Jing-yan2,ZHU Xin-yi3
(1.School of Medicine,Anhui University of Science and Technology,Huainan 232001,Anhui,China;
2.Department of Clinical Laboratory,Affiliated Heping Hospital,Changzhi Medical College,Changzhi 046000,Shanxi,China)
Abstract:Objective? To target the secretory antigen Rv1626 after Mycobacterium tuberculosis (M.tb) infection, construct its prokaryotic expression plasmid pPROEX-Rv1626 and express it for purification. The immunogenicity was evaluated by human and animal experiments. Methods? The recombinant vector pPROEX-Rv1626 was constructed and tested by whole blood interferon release assay (WBIA) to detect T cells specifically recognized by M.tb infected patients in Changzhi City, Shanxi Province. Simultaneous immunization of mice was used to detect their specific induction. The levels of IFN-γ, TNF-α and IL-2 secreted by spleen cells and antibody levels. Results? ①The recombinant vector pPROEX-Rv1626 was successfully constructed and successfully expressed, purified and identified. ②rRv1626 protein induced IFN-γ levels in peripheral blood of M.tb infected patients was significantly higher than healthy controls (P<0.0001). At the same time, the level of IFN-γ secreted by lymphocytes in peripheral blood of ATB patients was significantly higher than that of LTBI (P<0.0005);③The specific antibody titers produced by BCG+Rv1626/DMT group were significantly higher than those of Rv1626/DMT group and BCG group (P<0.01).The ratio of IgG2a/IgG1 in Rv1626/DMT group and BCG+Rv1626/DMT group was significantly higher than that in DMT group and BCG group (F=33.69), and the former two groups of IgG2a/IgG1>1 tended to Th1 type cellular immune response; ④Different The mice in the immunized group were stimulated with PPD or rRv1626 protein, and the highest levels of IL-2, IFN-γ and TNF-α were secreted in the BCG+Rv1626/DMT group, followed by the BCG group and the Rv1626/DMT group, and the PBS group was the lowest. At the same time, the Rv1626/DMT group was significantly higher than the DMT group (P<0.005). Conclusion? rRv1626 can be recognized by T cells infected by M.tb. Immunized mice can induce antigen-specific Th1-type cellular immune responses, which may be closely related to the immune protection provided by them.
Key words:Mycobacterium tuberculosis;Rv1626;Prokaryotic expression;Immunogenicity;Tuberculosis
結(jié)核病(TB)由結(jié)核分枝桿菌(Mycobacterium tuberculosis,M.tb)感染引發(fā),與獲得性免疫缺陷綜合征(AIDS)、瘧疾(malaria)并稱為世界上三大主要的傳染性疾病。全球約有1/4人群感染M.tb,2016年全球TB新發(fā)病例約為1040萬,其中金磚五國占其總數(shù)的50%以上,中國的TB發(fā)病率和死亡率均在22個(gè)TB高負(fù)擔(dān)的國家位居前列[1]。盡管卡介苗(BCG)在全球接種覆蓋率超過90%,但對(duì)接種者的保護(hù)效應(yīng)僅能持續(xù)約5~10年,這可能是由于世界各地BCG培養(yǎng)和免疫策略不同,進(jìn)而導(dǎo)致基因型的改變[2]。由于BCG無法對(duì)成人TB提供足夠的免疫保護(hù)力,尤其對(duì)M.tb潛伏感染人群(LTBI)效果有限,故亟需更高效的結(jié)核病預(yù)防和治療性疫苗。本課題基于篩選和構(gòu)建M.tb感染分泌期高表達(dá)抗原Rv1626,以體外人群和體內(nèi)動(dòng)物實(shí)驗(yàn)檢測(cè)其免疫原性,旨在為新型結(jié)核疫苗的研究提供有效的候選靶抗原。
1 材料與方法
1.1實(shí)驗(yàn)材料? E.coli DH5α株、E.coli BL21(DE3)株購自Tiangen生物公司;SPF級(jí)C57BL/6小鼠購自安徽醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心;Ni-NTA 蛋白純化系統(tǒng)購自GE公司;人、鼠相關(guān)細(xì)胞因子ELISA kit檢測(cè)試劑盒均購自深圳Dakewe公司。二甲基三十六烷基銨(DDA)、單磷酰脂質(zhì)A(MPL)和海藻糖6,6'-二分枝菌酸(TDB)購自Sigma公司。
1.2方法
1.2.1引物設(shè)計(jì)? 分析pPROEX載體上的多克隆位點(diǎn)及Rv1626全序列酶切位點(diǎn),設(shè)計(jì)特異性引物(P1: TTCGGATCC ACCGGCCCCACCACCGACG,P2: ATCTCGAG GGTGTCTTTGGGTGTTCCGAGGGTT)。PCR擴(kuò)增條件:95 ℃,5 min,94 ℃,50 s,65 ℃,50 s,72 ℃,40 s,30 cycles,72 ℃,10 min。
1.2.2質(zhì)粒構(gòu)建表達(dá)、純化? 以分子克隆法將Rv1626基因片段導(dǎo)入原核表達(dá)載體pPROEX中,構(gòu)建重組載體pPRO-Rv1626,以BamHⅠ和XhoⅠ行雙酶切鑒定。過夜培養(yǎng)后,經(jīng)CaCl2和熱休克法轉(zhuǎn)入E.coli BL21(DE3)感受態(tài)細(xì)胞中,以終濃度為0.5 mmol/L的IPTG誘導(dǎo)表達(dá),再以Ni-NTA純化蛋白,4 ℃梯度透析36 h后以內(nèi)毒素清除試劑盒除去內(nèi)毒素(<0.1 EU/ml)。以15% SDS-PAGE及Western blotting分析鑒定蛋白,再以BCA試劑盒測(cè)定蛋白濃度。
1.2.3 IGRA檢測(cè)不同人群外周血抗原特異性IFN-γ水平? 委托山西長治醫(yī)院檢驗(yàn)科,病史采集、問卷調(diào)查及全身體檢,隨機(jī)選取感染者和健康者共40例,同時(shí)依據(jù)臨床診斷標(biāo)準(zhǔn)對(duì)受試人群進(jìn)行初篩。感染者(包括ATB和LTBIs):存在(或無)明顯TB感染癥狀、有與TB患者接觸史、痰涂片或痰培養(yǎng)陽性(或陰性)、胸部X光出現(xiàn)可疑陰影(或正常),以及結(jié)核菌素試驗(yàn)(TST)檢測(cè)陽性(TST≥5 mm);健康對(duì)照者:無與TB感染者密切接觸史、TST檢測(cè)陰性(TST<5 mm)。
采集受試者的全血,以0.5 ml/孔加入無菌24孔板,并以5 μg/孔rRv1626蛋白進(jìn)行刺激,置37 ℃溫箱孵24 h。同時(shí)分別以等體積的PBS和PHA分別為陰性和陽性對(duì)照,收集血漿以人IFN-γ ELISA試劑盒檢測(cè)各孔IFN-γ濃度,并得出各孔最終值=實(shí)際測(cè)得值-PBS刺激的本底值。
1.2.4實(shí)驗(yàn)動(dòng)物分組及免疫方式? 6周齡雌性C57BL/6小鼠共30只,分為PBS組、BCG組、佐劑DMT(DDA、TDB、MPL)組、Rv1626/DMT組和BCG+Rv1626/DMT組,6只/組。具體免疫方式如下:①PBS組:200 μl PBS /只;②BCG組:200 μl /只(含菌1.2×106 CFU)BCG免疫1次;③DMT組:100 μl DMT混合100 μl PBS /只;④Rv1626/DMT組:含40 μg rRv1626蛋白溶液100 μl混合100 μl DMT /只;⑤BCG+Rv1626/DMT組:先以200 μl/只(含菌1.2×106 CFU)BCG免疫1次,3周后以Rv1626/DMT(含40 μg rRv1626蛋白溶液100 μl混合100 μl DMT /只)增強(qiáng)免疫2次,間隔3周。注射方式:PBS組和BCG組分別為0周注射1次;DMT和Rv1626/DMT組免疫共3次,每3周注射1次;BCG+Rv1626/DMT組0周時(shí)先以BCG注射1次,3周后,以Rv1626/DMT增強(qiáng)2次,每3周1次。
1.2.5小鼠血清中抗原性特異性抗體水平檢測(cè)? 免疫9周后,對(duì)各組小鼠摘眶取血,收集各組小鼠血清,應(yīng)用間接ELISA法檢測(cè)抗原特異性IgG、IgG1、IgG2a滴度(以陽性結(jié)果最高稀釋倍數(shù)的倒數(shù)表示),以IgG2a和IgG1實(shí)際測(cè)得的稀釋倍數(shù)計(jì)算IgG2a:IgG1。
1.2.6 ELISA檢測(cè)脾細(xì)胞培養(yǎng)上清中抗原特異性IFN-γ、TNF-α和IL-2 水平? 無菌分離出小鼠脾細(xì)胞并定量,將100μl的2.5×106 /孔的脾細(xì)胞加入24孔板中,陽性對(duì)照組為PPD(10μg /孔);陰性對(duì)照組為RPMI1640培養(yǎng)基;實(shí)驗(yàn)組為Rv1626蛋白(10μg /孔)。37 ℃培養(yǎng)24~72 h后,離心并收集上清,用鼠ELISA試劑盒檢測(cè)相應(yīng)細(xì)胞因子分泌水平。
1.3統(tǒng)計(jì)學(xué)分析? 以SPSS18.0進(jìn)行數(shù)據(jù)分析,IGRA法檢測(cè)不同人群IFN-γ濃度水平,采用非參數(shù)U檢驗(yàn),各組小鼠免疫原性相關(guān)指標(biāo)比較采用單因素方差分析。P<0.05為差異有統(tǒng)計(jì)學(xué)意義,P<0.01為差異有顯著統(tǒng)計(jì)學(xué)意義,P<0.001為統(tǒng)計(jì)學(xué)意義極顯著。
2 結(jié)果
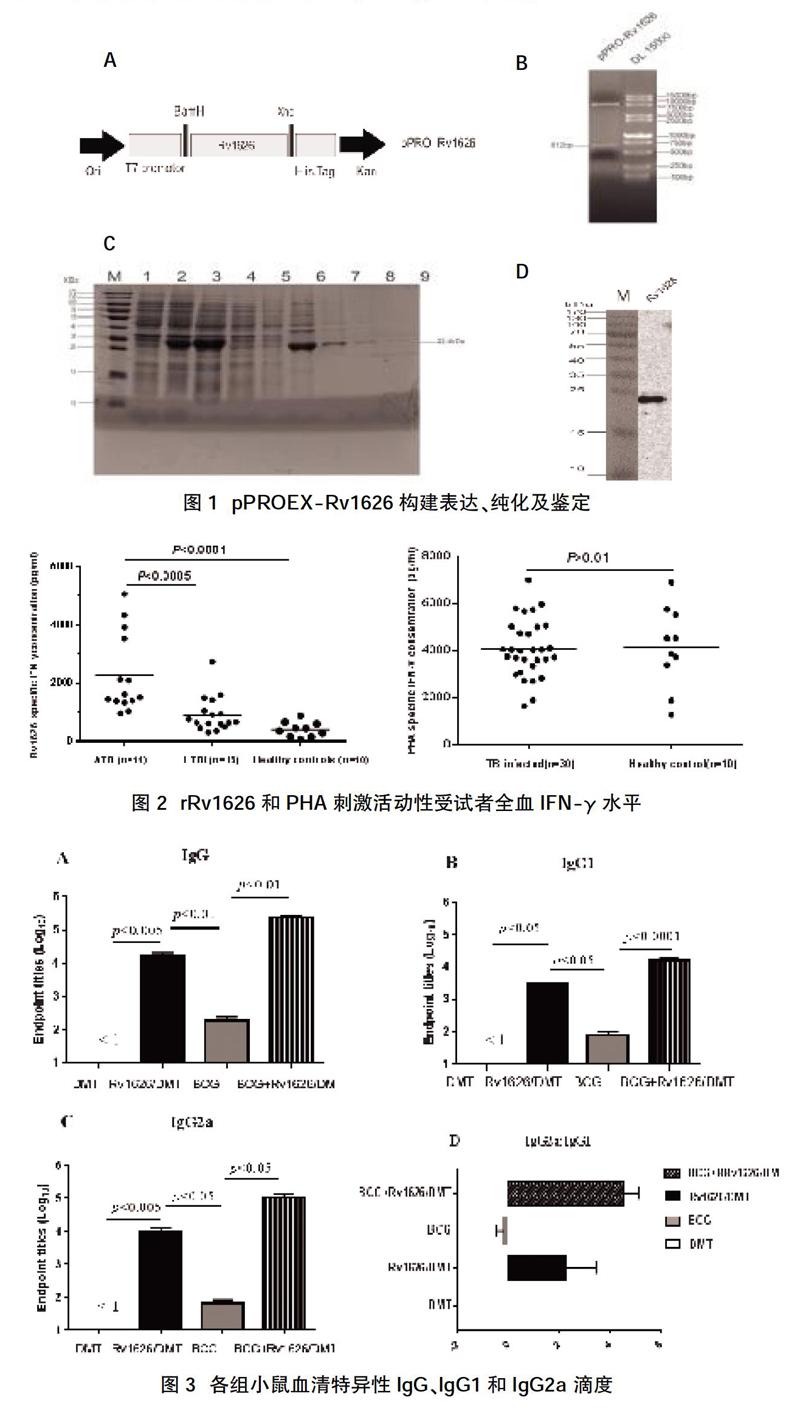
2.1 pPROEX-Rv1626原核表達(dá)載體的構(gòu)建、表達(dá)純化和免疫印跡分析? 經(jīng)PCR擴(kuò)增出大小為612 bp的序列片段,插入pPROEX后,成功構(gòu)建重組質(zhì)粒pPROEX-Rv1626。經(jīng)XhoⅠ、BamHⅠ雙酶切及測(cè)序鑒定無誤(見圖1A、B)。rRv1626蛋白誘導(dǎo)表達(dá)并經(jīng)Ni-NTA柱以變性條件純化后,獲得分子量為22.4 kD蛋白產(chǎn)物,與預(yù)期符合(見圖1C、D);經(jīng)Western blotting鑒定其成功表達(dá)。BCA試劑盒測(cè)定蛋白濃度為1.6 mg/ml,蛋白總表達(dá)量為4.5 mg。在Bio-Rad凝膠成像儀經(jīng)圖像分析測(cè)得蛋白純度為92.2%。
2.2 rRv1626刺激受試者產(chǎn)生特異性IFN-γ水平比較? 委托山西長治醫(yī)學(xué)院附屬醫(yī)院檢驗(yàn)科篩選出符合臨床診斷標(biāo)準(zhǔn)的受試者共40例,其中健康對(duì)照者、ATB患者和LTBI受試者及分別為10例、14例和16例。rRv1626蛋白誘導(dǎo)M.tb感染者外周血中淋巴細(xì)胞產(chǎn)生的IFN-γ水平均顯著高于健康者對(duì)照者(P<0.001),同時(shí)誘導(dǎo)ATB人群外周血中淋巴細(xì)胞分泌IFN-γ水平顯著高于LTBI人群(P<0.001),見圖2A。非特異性刺激物PHA誘導(dǎo)受試者外周血中淋巴細(xì)胞產(chǎn)生的IFN-γ水平無統(tǒng)計(jì)學(xué)差異(P>0.01),見圖2B。
2.3 Rv1626/DMT免疫小鼠誘導(dǎo)高水平的特異性IgG抗體? TMD組產(chǎn)生的IgG抗體及其亞類無顯著的特異性;BCG+Rv1626/DMT組產(chǎn)生的特異性相關(guān)抗體滴度顯著高于Rv1626/DMT組及BCG組(P<0.01);Rv1626/DMT組和BCG+Rv1626/DMT組的IgG2a/IgG1比值顯著高于DMT組和BCG組(F=33.69),且前兩組IgG2a /IgG1>1,傾向于Th1型細(xì)胞免疫應(yīng)答,見圖3。
2.4 Rv1626/DMT免疫小鼠脾細(xì)胞分泌高水平特異性Th1型細(xì)胞因子? 不同免疫組小鼠無論是PPD或rRv1626蛋白刺激,BCG+Rv1626/DMT組均分泌最高水平的IL-2、IFN-γ和TNF-α,其次為BCG組、Rv1626/DMT組,PBS組為最低。同時(shí)Rv1626/DMT組顯著高于DMT組(P<0.01)。PPD刺激時(shí),BCG組水平顯著高于Rv1626/DMT組、rRv1626刺激時(shí)則反之(P<0.01);各組表達(dá)的IL-4水平均較低且無顯著差異,見圖4。
3 討論
篩選M.tb感染后多個(gè)不同時(shí)期優(yōu)勢(shì)表達(dá)抗原,并以之為候選靶抗原構(gòu)建TB亞單位疫苗,已成為當(dāng)今新型結(jié)核疫苗研究的重要策略之一。目前,絕大多數(shù)的新型結(jié)核亞單位疫苗仍聚焦于復(fù)制期優(yōu)勢(shì)表達(dá)抗原,如Ag85A、Ag85B和Rv3619等被廣泛用于TB疫苗研究中,且均證實(shí)具有較好的免疫保護(hù)效果[3]。近年來,已有12條疫苗進(jìn)入臨床試驗(yàn)階段,涉及表達(dá)單個(gè)或多個(gè)靶抗原的不同形式的疫苗有7種,其中亞單位疫苗有4種,尤其以單表達(dá)分泌期優(yōu)勢(shì)抗原為重要研究靶點(diǎn)。本課題的重要意義在于通過人群和動(dòng)物實(shí)驗(yàn)篩選出具有潛力的分泌期靶抗原。
Rv1626是M.tb感染復(fù)制期分泌的重要抗原[4]。Derrick SC等[5]在2013年使用結(jié)核分枝桿菌攻擊小鼠模型測(cè)試了16種抗原,實(shí)驗(yàn)結(jié)果顯示,Rv1626可顯著降低實(shí)驗(yàn)感染動(dòng)物的肺、脾臟的荷菌量,能誘導(dǎo)強(qiáng)烈的Th1型細(xì)胞免疫,刺激分泌IL-2、TNF-α、INF-γ等細(xì)胞因子。通過上調(diào)INF-γ激活巨噬細(xì)胞,增強(qiáng)其吞噬能力和加工提呈抗原能力,最終有效地殺死M.tb,以及升高IL-2水平以保護(hù)宿主抵抗M.tb的感染。可見Rv1626可能是潛在的免疫原性較強(qiáng)的靶抗原,可刺激機(jī)體分泌較高水平的抗原特異性Th1型細(xì)胞因子。
本研究首次構(gòu)建并成功克隆表達(dá)原核質(zhì)粒pPROEX-Rv1626,通過人群實(shí)驗(yàn),證實(shí)Rv1626誘導(dǎo)ATB者產(chǎn)生的IFN-γ水平顯著高于LTBI者,同時(shí)刺激ATB和LTBI受試者產(chǎn)生的特異性IFN-γ水平顯著高于健康者,提示了Rv1626是可被M.tb 感染人群T細(xì)胞所識(shí)別的特異性抗原,是具有潛力的疫苗靶抗原。在免疫小鼠9周后以及以BCG初免、Rv1626增強(qiáng)免疫后,均誘導(dǎo)了較高水平的TNF-α、IL-2和IFN-γ,同時(shí)Rv1626/DMT組和BCG+Rv1626/DMT組小鼠血清IgG2a /IgG1>1,傾向于Th1型細(xì)胞免疫應(yīng)答。
綜上所述,本研究證實(shí)了Rv1626可被山西長治市M.tb感染人群T細(xì)胞特異性識(shí)別。在動(dòng)物免疫原性實(shí)驗(yàn)中檢測(cè)到實(shí)驗(yàn)組抗原特異性Th1型細(xì)胞因子水平低于BCG組,可能與Rv1626僅為單個(gè)靶抗原、刺激水平不夠有關(guān);這也在BCG+Rv1626/DMT組誘導(dǎo)的相關(guān)細(xì)胞因子水平均顯著高于BCG組和Rv1626/DMT組得到了驗(yàn)證。rRv1626可被TB感染人群T細(xì)胞所識(shí)別、具有較好的免疫原性,為研制M.tb感染人群(尤其是LTBIs)的預(yù)防及治療型疫苗提供了候選靶抗原。本課題研究篩選并構(gòu)建了M.tb感染復(fù)制期優(yōu)勢(shì)表達(dá)抗原,并對(duì)其免疫原性進(jìn)行了深入分析,為構(gòu)建包含多階段抗原的融合疫苗、有效提高其抗M.tb感染的保護(hù)性研究奠定了堅(jiān)實(shí)的基礎(chǔ)。
參考文獻(xiàn):
[1]Schmit KM,Wansaula Z,Pratt R,et al.Tuberculosis - United States,2016[J].Mmwr Morbidity & Mortality Weekly Report,2017,66(11):289-294.
[2]Singhal N,Bisht D,Joshi B.Immunoprophylaxis of tuberculosis: an update of emerging trends[J].Arch Immunol Ther Exp,2010,58(2):97-106.
[3]Evans TG,Schrager L,Thole J.Status of vaccine research and development of vaccines for tuberculosis[J].Vaccine,2016,34(26):2911-2914.
[4]Reyes PR,Parlane NA,Wedlock DN,et al.Immunogencity of antigens from Mycobacterium tuberculosis, self-assembled as particulate vaccines[J].International Journal of Medical Microbiology,2016,306(8):624-632.
[5]Derrick SC,Yabe IM,Yang A,et al.Immunogenicity and protective efficacy of novel Mycobacterium tuberculosis antigens[J].Vaccine,2013,31(41):4641-4646.

