流式細胞術檢測循環血骨髓瘤細胞的研究進展①
王顯鳳 陳文明
(首都醫科大學附屬朝陽醫院血液科,北京100020)
多發性骨髓瘤(Multiple myeloma,MM)是惡性漿細胞在骨髓內惡性增殖和廣泛浸潤的一種血液系統腫瘤,具有高度異質性,目前尚不能治愈。MM診斷及殘留病灶監測現階段主要依賴骨髓(Bone marrow,BM)穿刺樣本進行分析,但骨髓穿刺有創傷,骨髓稀釋或骨髓瘤病灶分布不均可導致不同穿刺部位的結果相差較大。
有研究表明MM循環骨髓瘤細胞(Circulating myeloma cells,CMCs)具有獨特的免疫表型、細胞遺傳學及功能[1-3]。它的優點在于分布均勻,獲取簡單且創傷小。而流式細胞術具有可分析數量大、敏感性高、多參數分析、客觀、準確、快速的優點,伴隨著二代流式(Next generation flow,NGF)的出現,敏感性高達10-6,能進一步提高CMCs的檢出率[4]。因此利用多參數流式細胞術(Multiparameter flow cytometry,MFC)檢測CMCs有利于監測MM疾病的進展、治療療效和判斷預后,使其在臨床及科研中具有廣闊的應用前景,現有醫療機構對檢測CMCs的免疫表型所采取的檢測方案并未統一,對檢測CMCs應用前景等存在爭議,對CMCs的生物學特征、病理生理機制仍不清楚。本文就CMCs的免疫表型、預后意義及臨床應用的研究進展進行綜述。
1 循環骨髓瘤細胞的免疫表型特征
漿細胞(Plasma cells,PCs)為外周淋巴器官中成熟B淋巴細胞在抗原刺激下分化增殖釋放到外周血(Peripheral blood,PB),再返回BM中分化成一種不再具有分化增殖能力的終末細胞。BM中正常漿細胞(Normal plasma cells,NPCs)主要表達CD19+CD27++CD81+CD200+/dimCD45++CD38+++CD138+,胞漿輕鏈呈非限制性表達,小部分NPCs表達CD45-CD56+CD81-,約1/3 NPCs表達CD19-CD56-CD117-,通常不表達B細胞相關抗原,如CD20、CD22和膜免疫球蛋白(smIg)[5-8]。
1962年Ginsberg等[9]證實MM患者PB中能檢測到PCs,大量研究報道CMCs的免疫表型,主要表達CD38、CD138,67%表達CD56、96%不表達CD19,CD45一般呈陰性表達,胞漿免疫球蛋白輕鏈呈限制性表達[1,10,11],有學者用CD38、CD56、CD19、CD45、CD138、CD37等抗體對MM患者BPPCs與BMPCs的免疫表型進行了比較,發現除CD56、CD138在外周血中的表達水平較骨髓低外,兩者具有相同的復合免疫表型,同時證實CMCs CD19、CD38、CD45表達水平較NPCs低[10],2016年Muz等[12]研究證實CD138在CMCs中呈弱陽或陰性表達。2013年Paiva等[1]對CMCs免疫表型做進一步研究,發現CMCs低表達整合蛋白、黏附分子、活化分子,比如CD11a、CD11c、CD29、CD49d、CD49e、CD33、CD56、CD117、CD28、CD81等。可見NPCs、骨髓中骨髓瘤細胞(Myeloma cell,MCs)、CMCs抗原表達不盡相同(見表1),可依據不同抗原表達情況區分良惡性漿細胞。有研究報道CD56、CD117表達與骨髓外浸潤及預后較差有關,CD200陰性表達與MM患者無事件生存期有關[13-15]。Paiva等[1]還證實CMCs與BM基質細胞共培養時,CMCs大部分處于靜止狀態,這一特性可能與其高度克隆潛能有關,可能代表一種獨立的骨髓亞克隆漿細胞。
綜上,CD38、CD138、CD19、CD56、CD45、胞漿免疫球蛋白輕鏈是區分良惡性漿細胞的重要免疫標記,已逐步被人們接受,逐漸應用于臨床。其他表面分子如CD1la、CD28、CD33、CD117、CD200等也同樣受到了一些學者的關注,相關免疫標記在CMCs上的應用前景還需深入探索。
表1比較正常漿細胞、骨髓瘤細胞、循環骨髓瘤細胞的免疫表型
Tab.1AcomparisonofphenotypesofNPCs,MCsandCMCs

AntigenNPCs(BM)CMCs(BP)MCs(BM)Percentagepositive of MCsCD38StrongPositivePositive100%CD138StrongDim/NegativeStrong100%CD56NegativeDimPositive75%CD19PositiveNegativeNegative95%CD33NegativeDimPositive18%CD117NegativeDimPositive30%CD27StrongDim/NegativeDim/Negative40%-50%CD28Dim/NegativeDimStrong15%-45%CD81PositiveDimDim/Negative55%
2 漿細胞設門及抗體選擇
抗體的選擇對于確定漿細胞的免疫表型、檢測的可重復性及敏感性都非常關鍵,尤其是對于含量較低的CMCs,然而設置統一的設門策略也非常必要。由于部分異常漿細胞CD38表達較弱[1,5,10],如果僅用CD38和SSC設門,易出現假陰性結果;用CD38和CD138設門,可以提高漿細胞的檢出率,但易混有前體B細胞,影響漿細胞異常免疫表型的分析;用CD38和CD45可以減少其他細胞成分,但CD45陽性的惡性漿細胞也容易被遺漏;在此基礎上歐洲骨髓瘤組(European Muhiple Myeloma Network,EMMN)于2008年在MM免疫分型的設門策略達成一致,中國免疫學會血液免疫分會臨床流式細胞術學組于2017年在漿細胞腫瘤殘留檢測的設門策略上達成一致,兩者一致認為分析時聯合使用CD38、CD138、CD45和SSC共同設門,可達到最佳檢出率,同時建議CD38、CD138、CD45應至少在一管中同時檢測,如果使用雙變量分析,第一個門應該用CD38和CD138設門,確保不遺漏CD45陰性的漿細胞組分,其他管最好也選用CD38和CD138[5,16]。
同時國內外專家共識認為在定義異常漿細胞免疫表型時,不能依賴于單個或少量標記來確定,無論是MM診斷還是MM-MRD監測[5,16]。EMMN認為應用CD38、CD138、CD19、CD56可以區分至少90%的漿細胞,聯合CD27、CD28、CD117、CD20可以增加至95%,再聯合胞漿Kappa與Lambda,檢出率可達100%[3,12]。目前關于是否需要檢測胞漿Kappa與Lambda,國內外仍存在爭議,因為檢測胞漿免疫球蛋白輕鏈需要洗滌、透膜,步驟較多,易造成細胞的丟失,因此國外的有些學者認為在膜抗體檢測數量足夠多的情況下可以不用檢測胞漿抗體,但國內學者認為,胞漿免疫球蛋白輕鏈的限制性表達對于確定克隆性漿細胞是最直接的證據,在使用抗體相對較少時,建議進行檢測[16]。綜上對于CMCs檢測,如何選擇最佳抗體及分析方法還需深入研究。
3 循環骨髓瘤細胞的檢測方法
根據多發性骨髓瘤細胞的形態學特點及遺傳免疫學特點,用于檢測漿細胞的手段有光學顯微鏡、電子顯微鏡觀察外周血涂片中的漿細胞,免疫熒光顯微技術、PCR技術和流式細胞術等方法檢測特異性標記物。
由于外周血漿細胞數量較少,單純采用形態學檢測陽性率極低,目前已很少使用。1996年Joshua等[17]采用溴脫氧尿苷熒光免疫標記技術和流式細胞儀分析CD38強陽細胞,并對這兩種方法檢測的65例樣本漿細胞標記指數(Plasma cell labeling index,PCLI)進行了比較,結果前者PCLI平均值較后者PCLI平均值低,研究結果說明后者敏感性明顯高于前者。Rawstron等[10]分別采用CD38單抗通過流式細胞儀檢測外周血漿細胞和IgH-PCR免疫熒光技術檢測瘤細胞的方法,并對兩者結果進行比較,結果提示兩者有很好的一致性,IgH-PCR檢測結果為陽性的流式細胞術結果均為陽性,IgH-PCR檢測結果陰性的流式細胞術檢測結果均為陰性,結果顯示流式細胞儀免疫標記能作為檢測漿細胞的定量手段。2015年Sanoja-Flores等[4]用NGF檢測21例MM、5例SMM、37例MGUS、8例孤立性漿細胞瘤患者的循環漿細胞,在SMM、MM、60%MGUS患者的BP中均能檢測到CMCs,三者的CMCs百分比中位值依次為0.002 6%、0.003 3%、0.000 2%,證實NGF檢測敏感性可達10-6。2016年Muz等[12]研究發現檢測CMCs時聯合CD38、CD3、CD14、CD16、CD19、CD123抗體可以提高CD138弱陽性或陰性CMCs的檢出率。2018 Kamande等[18]應用流式細胞分選儀檢測9例MGUS、11例SMM、19例有癥狀MM及9例治療后MM患者的CMCs,除1例MGUS未檢測到CMCs外,其余CMCs均陽性,各組均值分別為62.4個/ml、68.8個/ml、818.4個/ml、169.3個/ml,有癥狀MM的CMCs均值明顯高于其他3組,研究顯示通過細胞分選法能提高CMCs的檢出率。不同的檢測方案、不同疾病狀態對CMCs的檢出率存在影響,NGF、流式分選對MM中CMCs的檢出率可達100%,同時應用流式分選可提高MGUS中CMCs的檢出率(見表2)。
綜上可見流式細胞術具有高靈敏性、準確性以及快速、簡便的特點,并且與免疫熒光顯微技術、PCR技術等檢測手段有很好的一致性[4,10,17,18],其敏感性高于細胞形態學、免疫熒光技術。因此目前采用流式細胞儀檢測CMCs在臨床及科研領域已逐步得到應用。
4 循環骨髓瘤細胞的預后價值
CMCs不僅能反映腫瘤負荷、疾病活動狀態,還能預測初治、復發、緩解狀態或移植后患者的總體生存期(Overall survival,OS)、無進展生存期(Progression free survival,PFS),同時CMCs是促進冒煙型多發性骨髓瘤(Smoky multiple myeloma,SMM)進展成MM的危險因素,也是患者危險分層的重要依據[11,19-26],因此檢測CMCs對MM患者有非常重要的意義。
1993年Witzig等[20]用免疫熒光顯微技術檢測了84例患者的CMCs(35例初治MM、26例復發MM、10例MGUS、13例SMM),將MGUS與SMM歸為疾病無活動性狀態,初治MM及復發MM歸為活動性狀態,結果顯示后者CMCs高于前者,處于疾病活動狀態的61例患者,復發MM CMCs中位值高于初治MM CMCs中位值,顯示CMCs與疾病的活動性密切相關;取3×106L-1作為臨界值進一步分析,CMCs>3×106L-1時占疾病處于活動性狀態的67%(41/61),CMCs<3×106L-1時占疾病無活動性狀態的96%(22/23),再次證明CMCs能預測疾病的活動狀態。研究表明,CMCs是預測MM患者OS的重要預后因素。2014年Gonsalves等[25]使用MFC分析了157例初治MM患者的PBPCs,發現CMCs陰性組OS比CMCs陽性組明顯延長(P=0.019),CMCs陰性組患者2年、3年OS分別為91%、87%,CMCs陽性組患者2年、3年OS分別為76%、67%。同年Gonsalves等[19]用同樣的方法分析了145例復發患者CMCs,得到了相似的結論。2018年Foulk等[2]研究緩解期MM患者,證實低CMCs組的總體生存期比高CMCs組更受益,進一步證實CMCs與生存期呈負相關,CMCs高預示生存期短。多篇文獻報道CMCs影響移植后患者生存期[27,28],2016年Chakraborty等[27]用流式細胞術分析了840例接受ASCT的MM患者CMCs,結果顯示CMCs陰性組的移植后嚴格完全緩解率、PFS、OS的中位值比CMCs陽性組高。2018 年Cowan等[28]做了類似研究,發現CMCs影響移植后MM患者的生存期,結果顯示CMCs陰性組PFS較CMCs陽性組延長(P=0.031),證實了Chakraborty的結論,但發現OS無差異,接受ASCT后達完全緩解組中CMCs陰性組PFS較CMCs陽性組延長,在VGPR或療效更好的MM患者中,CMCs陰性組PFS較CMCs陽性組延長(P=0.04),證實CMCs是高風險MM群體的獨特因素。多篇文獻報道CMCs是導致SMM進展為MM的重要因素,2013年Bianchi等[22]利用免疫熒光法研究了171例SMM患者,結果顯示高CMCs是SMM進展為MM的危險因素。2016年Gonsalves等[26]用MFC分析100例SMM患者的CMCs,結果顯示CMCs陰性SMM組的最短疾病進展中位值比CMCs陽性組的明顯延長,58%CMCs陽性的SMM在24月內進展為MM,僅有9%CMCs陰性的SMM進展為MM;取150個CMCs作為臨界值進一步分析,結果顯示低CMCs組的最短疾病進展中位值比高CMCs組的明顯延長,研究結果進一步證實Bianchi的觀點,2018年Foulk等[2]的研究結果同樣證實這一觀點。因此檢測SMM中CMCs有利于醫生及早采取有針對性的治療。
表2比較流式細胞儀檢測MM、SMM、MGUS中CMCs的陽性率
Tab.2AcomparisonofpercentagepositiveofCMCsinMM,SMMandMGUSbyflowcytometry
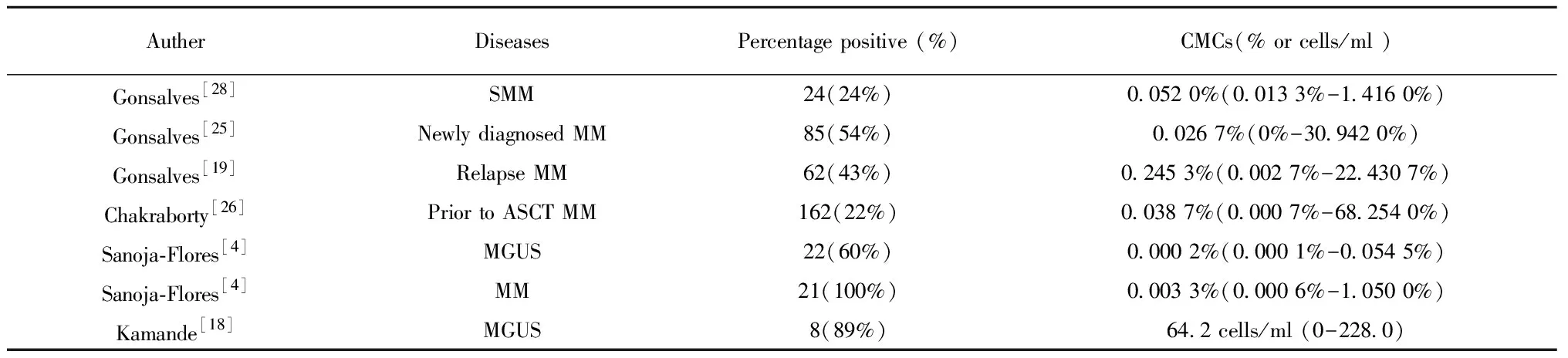
AutherDiseasesPercentage positive (%)CMCs(% or cells/ml )Gonsalves[28]SMM24(24%)0.052 0%(0.013 3%-1.416 0%)Gonsalves[25]Newly diagnosed MM85(54%)0.026 7%(0%-30.942 0%)Gonsalves[19]Relapse MM62(43%)0.245 3%(0.002 7%-22.430 7%)Chakraborty[26]Prior to ASCT MM162(22%)0.038 7%(0.000 7%-68.254 0%)Sanoja-Flores[4]MGUS22(60%)0.000 2%(0.000 1%-0.054 5%)Sanoja-Flores[4]MM21(100%)0.003 3%(0.000 6%-1.050 0%)Kamande[18]MGUS8(89%)64.2 cells/ml (0-228.0)
5 存在的問題及展望
綜上研究證實CMCs在判斷疾病活動程度、疾病療效及進展、生存期方面有著不可忽視的作用,應用流式細胞術檢測CMCs在未來具有良好的臨床應用前景,但目前對于CMCs研究仍存在問題,尚需深入探索。首先CMCs檢測目前國內外尚未建立統一方案,因此未來研究應進一步規范統一檢測方案,使不同研究機構的結果更具有說服力和參考性;其次NGF檢測值≥10-6時,檢測值是否具有特異性,仍然需要臨床驗證;最后CMCs的生物學特征、病理生理機制仍不清楚,未來仍需致力于CMCs的基礎研究。未來能否將CMCs納入預后分層體系,CMCs能否替代骨髓的檢測尚需大量的臨床研究證實。