2型糖尿病對大鼠長骨結構與骨髓間充質干細胞增殖分化的影響*
胡 巍 劉 娜 王譯凡 李 影 賀琦多 郭 斌
糖尿病是以高血糖為特征的慢性代謝性疾病,由胰島素分泌不足或胰島素抵抗引起,分為1型、2型、妊娠型及其他如基因缺陷等少數特殊型糖尿病,而其中2型糖尿病最為常見,占比超過90%。2型糖尿病以胰島素分泌相對不足為特征,可表現為胰島素抵抗綜合征[1]。長期進展的糖尿病會導致多組織器官如眼部、腎臟、骨組織、心血管系統等的慢性損害和功能障礙,其并發癥嚴重影響身體健康[2,3]。
骨形成與骨吸收活動的動態平衡維持了骨組織的正常生長及代謝活動,失衡引起骨組織硬化、骨質疏松及退化吸收等骨疾病。臨床及體外細胞學實驗表明,1型糖尿病和2型糖尿病均可增加骨折風險及干擾骨愈合[4],且1型糖尿病主要干擾骨形成代謝過程而非骨吸收代謝過程,對成骨進程的相關細胞可表現出抑制作用[5]。然而目前關于2型糖尿病對體內長骨骨組織結構和骨髓間充質干細胞(bone marrow stem cells,BMSCs)的影響研究鮮少展開。本研究擬建立2型糖尿病大鼠模型,分析2型糖尿病對長骨形態參數以及對骨髓間充質干細胞生物學功能的影響,為防治2型糖尿病引起的骨損傷疾病提供依據。
1.材料和方法
1.1 材料
1.1.1 實驗動物與分組 健康清潔SPF級雄性GK大鼠和雄性Wistar大鼠各8只,6周齡,體質量GK大鼠138.5±17.1g,Wistar大鼠161.3±15.9g,購自常州卡文斯實驗動物有限公司,動物合格證號:201723853。
1.1.2 主要試劑與儀器 α-MEM培養液、胎牛血清(Gibco,美國),青霉素/鏈霉素混合液、胰蛋白酶-EDTA消化液(HyClone公司,美國),超敏感大鼠胰島素酶聯免疫試劑盒(Mercodia,瑞典),BCIP/NBT底物顯色試劑盒(上海碧云天生物技術有限公司),Annexin V-FITC/PI凋亡檢測試劑盒、Cell Counting Kit-8試劑盒、DNA含量檢測試劑盒(細胞周期),Trizol reagent RNA提取試劑盒(Invitrogen,美國)、PrimeScriptTM RT Reagent Kit(TaKaRa, 日 本 ), TransStart Top Green qPCR SuperMix(北京全式金生物科技有限公司),β-甘油磷酸鈉、L-維生素C、地塞米松(Sigma,美國),GEeXploreLocusMicroCT掃描機(美國通用公司),羅氏ACCU-CHEKR Advantage血糖儀(Roche,瑞士),BD FACS流式細胞儀(BD,美國),CFX96實時定量PCR儀(Bio-Rad,美國)。
1.2 方法
1.2.1 構建2型糖尿病大鼠模型 采用GK大鼠純食物誘導方法構建2型糖尿病模型。自6周齡至14周齡,8只GK組大鼠作為實驗組,輔以高脂飼料喂養;8只Wistar大鼠作為對照組,輔以普通飼料喂養。每周于固定時間禁食、不禁水12h后進行生理指標測定,包括體重、空腹血糖,使用羅氏ACCU-CHEKR Advantage血糖儀測定大鼠尾靜脈血血糖值。大鼠至14周齡夜間禁食、不禁水12h后,檢測各組空腹胰島素,再進行口服葡萄糖耐量試驗(oral glucose tolerance test,OGTT)。胰島素測定時采血自大鼠內眥靜脈,應用超敏感大鼠胰島素酶聯免疫試劑盒檢測空腹胰島素值。口服葡萄糖耐量試驗給予50%葡萄糖溶液4.2g/kg灌胃,分別在空腹時、糖負荷30min、60min和120min后于尾靜脈采血并測定血糖值。2型糖尿病大鼠模型構建成功的標準:空腹血糖值≥11.1mmol/L或OGTT實驗120min后血糖大于16.7mmol/L。
1.2.2 顯微CT掃描脛骨結構形態計量學指標選取建模成功的兩組GK組大鼠和Wistar組大鼠各8只,注射戊巴比妥鈉處死大鼠,解剖雙側股骨和脛骨。咬骨鉗去除股骨兩端骨質,暴露骨髓腔,利用干細胞培養液沖洗出骨髓,并置于37℃、5%CO2及飽和濕度的環境進行細胞培養;脛骨放置于多聚甲醛固定液固定24h后,采用美國通用公司GE eXplore Locus MicroCT掃描機(voltage 80V,current 450μA,bin mode 1×127μm)對脛骨近端骨骺端進行連續斷層掃描。
1.2.3 細胞純化 待原代細胞匯合至80%時,加入0.25%胰蛋白酶-EDTA消化成細胞懸液,再加入等量細胞培養液終止反應,1000r/min離心5min,棄上清后加入細胞培養液重懸細胞,應用有限稀釋法培養BMSCs。調整細胞密度至1.5×104/mL,向96孔板每孔中加入0.1mL細胞懸液,37℃、5%CO2細胞培養箱內培養48h后標記單個細胞孔,補加0.1mL細胞培養基,3日換液一次,待克隆細胞長至96孔板底匯合至60%時,0.25%胰蛋白酶-EDTA消化、擴大培養,用于后續實驗。
1.2.4 CCK-8法檢測細胞增殖能力 取第三代生長良好的各組骨髓間充質干細胞,用0.25%胰蛋白酶-EDTA消化成細胞懸液。稀釋細胞懸液,細胞計數后以5×104/ml濃度的懸液按照100μL/孔接種至96孔板,將培養板放入培養箱預培養,分別在1d、2d、3d、4d、5d后向每孔加入10μL CCK-8溶液,用酶標儀測定各孔在450nm處的吸光度。
1.2.5 細胞凋亡檢測試驗與細胞周期檢測試驗收集各組第三代骨髓間充質干細胞1×106/次,用ANNEXIN V-FITC/PI凋亡檢測試劑盒中的Binding Buffer懸浮并重懸細胞使細胞密度達到1×106/ml,每管加入100μL細胞,再向管中加入5μL Annexin V-FITC,再加入 5μL PI溶液孵育5min,最后每管加入PBS溶液至500μL,流式細胞儀上機檢測;調整第三代骨髓間充質干細胞細胞濃度為1×106/ml,取1ml單細胞懸液,離心單細胞懸液,去除上清液,在細胞中加入70%預冷乙醇500μL,固定2小時4℃保存至過夜,在細胞沉淀中加100μL RNaseA溶液,37℃水浴30min,加入400μL PI染色液混勻孵育30min,流式細胞儀進行上機檢測,記錄激發波長488nm處紅色熒光。
1.2.6 ALP染色檢測成骨誘導分化能力 收集各組第三代骨髓間充質干細胞,細胞計數后以3×105/孔接種至6孔板中,培養細胞匯合至60%時更換為細胞成骨分化培養基分別培養7天,每3日換液一次。7d后倒置相差顯微鏡下觀察BMSCs復層生長并出現圓形結節,棄培養液并沖洗,多聚甲醛固定細胞20min后,應用BCIP/NBT底物顯色試劑盒,染色20min后流水沖洗,倒置顯微鏡下拍照。
1.2.7 實時定量PCR檢測 Trizol提取各組第3代BMSCs常規培養和成骨誘導7d的RNA,應用微量紫外分光光度計測定RNA的濃度和純度。應用PrimeScript RT reagent Kit進行cDNA合成,按照使用說明在20μL反轉錄體系中進行,總反應體系為:上游引物0.5μL,下游引物0.5μL,qPCR SuperMix 10μL,cDNA 1μL,ddH2O 8μL。參照NCBI GenBank數據庫,采用Primer primer 5.0軟件設計目的基因上下游引物,由華大基因公司合成引物。采用CFX96實時定量PCR儀進行檢測,PCR擴增反應條件:95℃3min;95℃10s,55.5℃30s,35個循環。

表1 目的基因的引物序列
1.2.8 統計學分析 各個試驗重復三次,定量結果數據以)表示。應用SPSS 17.0統計軟件采用t檢驗和單因素方差分析對試驗結果數據進行分析,檢驗水準為雙側α=0.05。
2.結果
2.1 2型糖尿病大鼠模型建模的確定 6至14周,GK組大鼠體重增長較Wistar組緩慢,且有隨著生長周齡增加兩組大鼠體重差異逐漸擴大的趨勢(圖1A)。14周齡的GK組大鼠有多飲、多尿的表現,GK組大鼠的空腹血糖值14.61±5.31顯著高于Wistar組的空腹血糖值6.24±0.54(圖1B)。GK組大鼠內眥靜脈血的空腹胰島素含量值0.81±0.14顯著高于Wistar組(圖1C)。OGTT口服葡萄糖耐量試驗結果顯示GK組大鼠血糖波動幅度較Wistar組大,60min的血糖值達到最高值,120min后Wistar組大鼠血糖值6.4±0.3降至約初始水平,GK組大鼠血糖值22.3±2.1則較初始水平顯著上升(圖1D)。所有GK組大鼠生理指標都滿足空腹血糖值≥11.1mmol/L或OGTT實驗120min后血糖大于16.7mmol/L的標準,均建模成功。
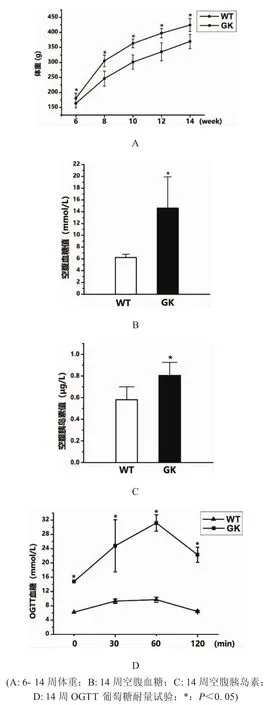
圖1 大鼠糖尿病生化指標檢測試驗
2.2 2型糖尿病對脛骨骨形態計量分析的影響顯微CT掃描兩組大鼠脛骨形態計量分析的結果見(表2)。GK糖尿病組大鼠脛骨長度顯著低于Wistar對照組,結構模型指數SMI顯著高于Wistar對照組,而骨礦物質密度BMD、骨小梁厚度Tb.Th、骨小梁間距Tb.Sp及骨體積分數BV/TV在兩組間均無明顯差異。雖然GK糖尿病組結構模型指數SMI值顯著增加顯示可能有骨質疏松傾向,但綜合骨礦物質密度BMD、骨小梁厚度Tb.Th、骨小梁間距Tb.Sp及骨體積分數BV/TV數值說明2型糖尿病尚未顯著引起骨質疏松樣改變。
表2 大鼠脛骨顯微CT骨形態計量分析,n=8)
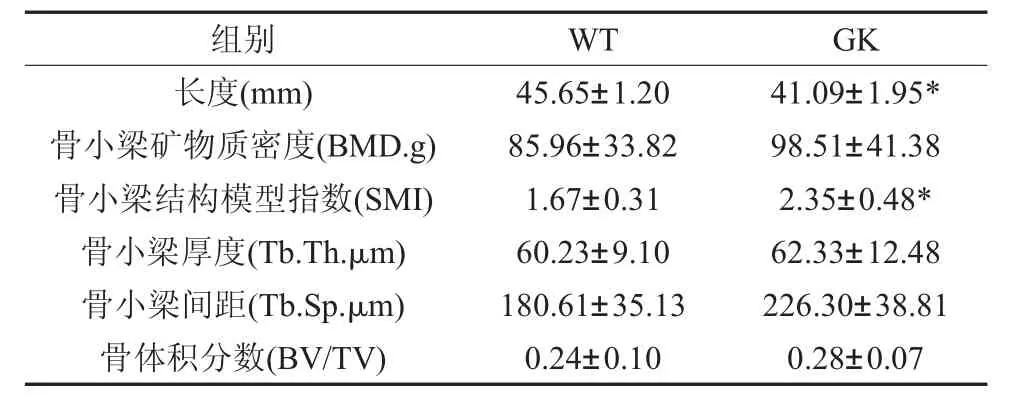
表2 大鼠脛骨顯微CT骨形態計量分析,n=8)
*:P<0.05
?
2.3 2型糖尿病對BMSCs增殖和凋亡活性的影響 與對照組Wistar BMSCs流式細胞周期結果比較,GK組BMSCs在2型糖尿病微環境中,G1期細胞百分數93.38±0.69%顯著高于Wistar組86.72±1.64%,S期細胞百分數2.60±0.46%,G2期細胞百分數4.05±0.31%,都顯著低于對照組,表明2型糖尿病微環境對GK組BMSCs具有G1期阻滯作用(圖2A,表3)。應用流式細胞儀檢測兩組BMSCs細胞凋亡,兩組BMSCs均只有少量細胞凋亡,GK組BMSCs早期凋亡2.01±0.61%,晚期凋亡11.74±1.47%,凋亡率顯著比Wistar對照組高(圖2B,表4)。
CCK-8試驗結果顯示,兩組BMSCs在第一天和第二天吸光度值未見明顯差異,但第三天開始Wistar組吸光度值顯著高于GK組(圖3)。GK組細胞生長曲線較平緩,從第三天開始Wistar組BMSCs細胞逐漸步入對數生長期,且擴增能力顯著強于GK組BMSCs。
結合增殖和凋亡試驗表明,2型糖尿病微環境對BMSCs具有抑制增殖活性、促進細胞凋亡的作用。

圖2A 流式細胞儀檢測BMSCs細胞周期
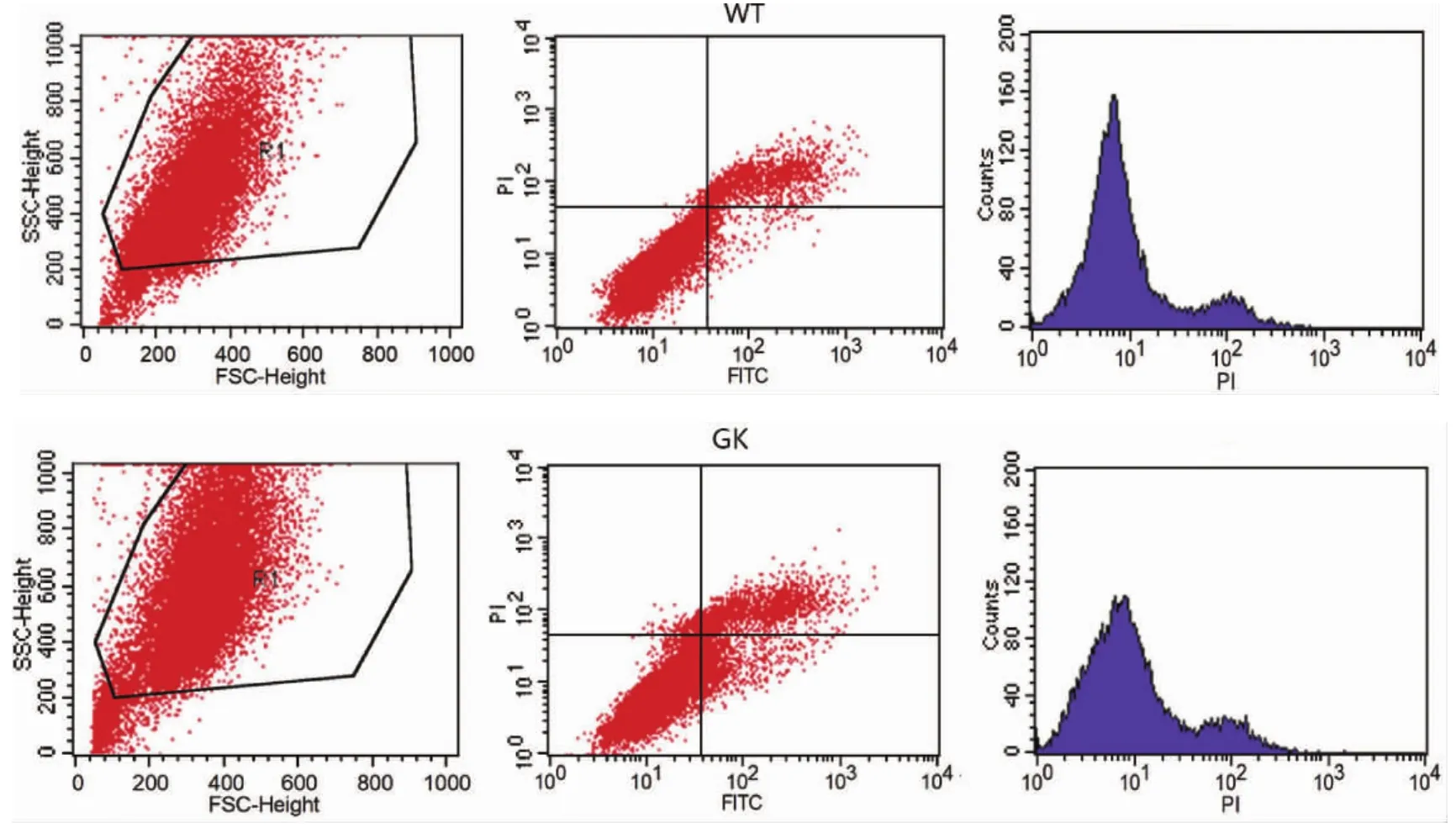
圖2B 流式細胞儀檢測BMSCs細胞凋亡
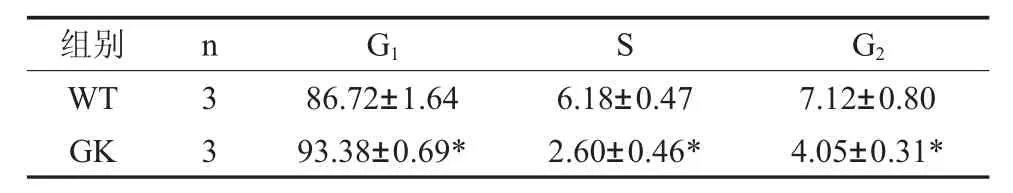
表3 2型糖尿病對BMSCs細胞周期的影響(%)

表4 2型糖尿病對BMSCs細胞凋亡的影響(%)
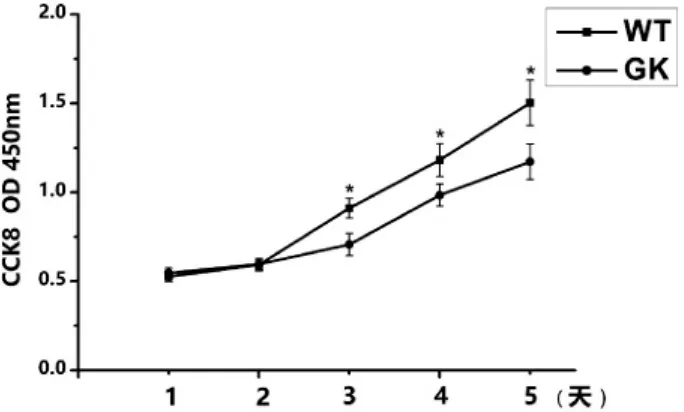
圖3 CCK-8試驗(*:P<0.05)
2.4 2型糖尿病抑制BMSCs成骨分化能力 兩組BMSCs經過7d成骨誘導后,鏡下可見GK組和Wistar組BMSCs都形成眾多圓形結節,Wistar組圓形結節更大、數更多量。ALP染色結果表明,6孔板中Wistar組較GK組染色更深、著色密度更大。鏡下見ALP染色呈藍色,圍繞圓形結節區域,呈條狀或團狀,GK組染色區域較稀疏(圖4-圖5)。
兩組BMSCs經過7d成骨誘導后,采用qRTPCR對GK組和Wistar組BMSCs成骨分化誘導前后的早期及晚期成骨標志基因表達進行檢測,結果發現:成骨誘導前,GK組BMSCs的成骨基因OPN、ALP、Runx2 mRNA表達量(0.14±0.04,0.45±0.13,0.50±0.12)低于 Wistar組(0.29±0.04,0.70±0.08,0.78±0.16);成骨誘導后,GK組BMSCs的成骨基因OPN、ALP、Runx2mRNA表達量(0.34±0.08,0.64±0.11,0.83±0.08)都較成骨誘導前顯著增加,但都低于Wistar組(0.82±0.10,1.47±0.06,1.21±0.04),二者差異具有統計學意義。晚期成骨標志物OSX雖然在成骨誘導前兩組間無明顯差異,但成骨誘導后GK組OSX mRNA表達量0.68±0.05顯著低于Wistar對照組0.88±0.04(圖 6)。
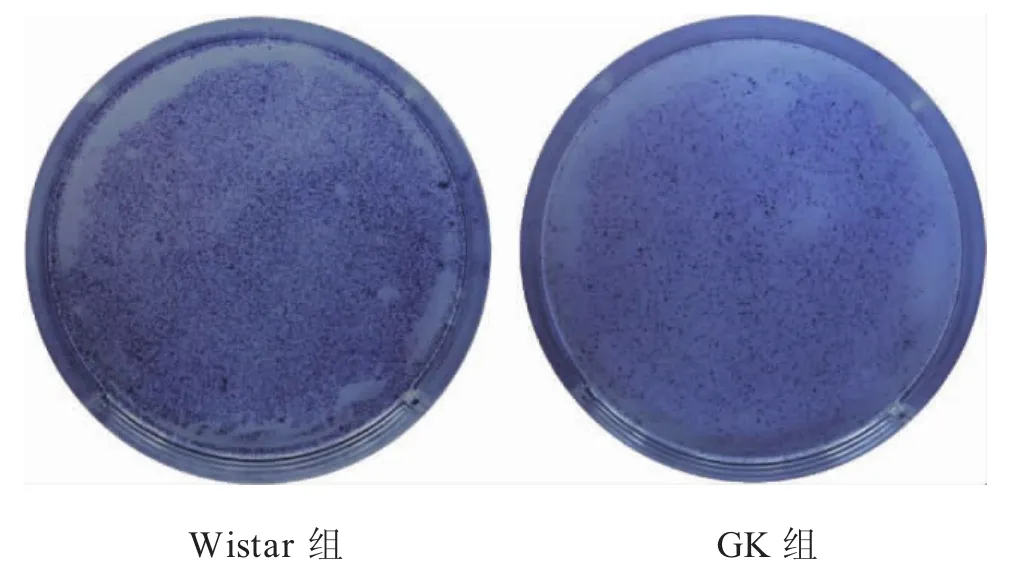
圖4 BMSCs ALP染色平皿肉眼觀
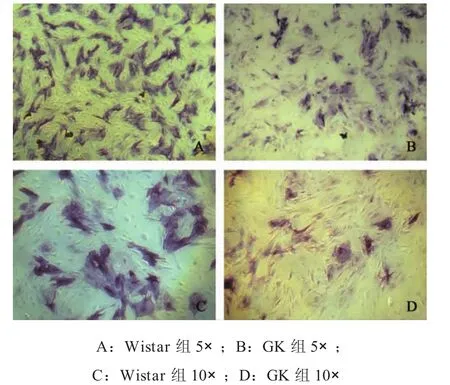
圖5 BMSCs ALP染色倒置顯微鏡下觀
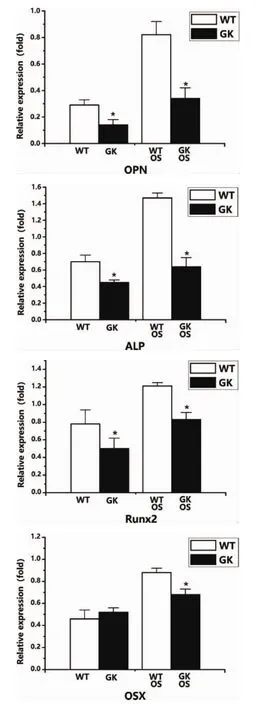
圖6 BMSCs成骨標志基因表達(OS:成骨誘導;*:P<0.05)
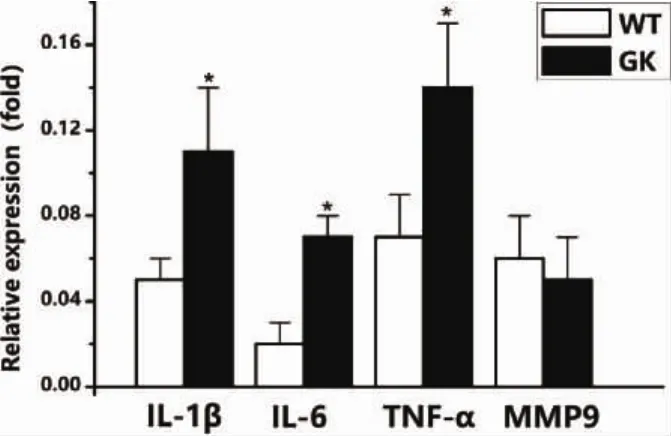
圖7 BMSCs促炎因子基因表達(*:P<0.05)
該定性和定量的結果提示,2型糖尿病微環境下調BMSCs早期及晚期成骨標志基因的表達,抑制BMSCs的成骨分化能力。
2.5 2 型糖尿病對 IL-1β、IL-6、TNF-α、MMP9促炎因子表達的影響 應用qRT-PCR對GK組和Wistar組BMSCs的促炎因子基因表達進行檢測,結果發現:GK組BMSCs的成骨基因IL-1β、IL-6、TNF-αmRNA 表達量(0.11±0.03,0.07±0.01,0.14±0.03)高于 Wistar組(0.05±0.01,0.02±0.01,0.07±0.02),而 MMP9 mRNA表達量在兩組間無顯著差異(圖7)。IL-1β、IL-6及TNF-α與炎癥的發生及進展關系密切,該結果說明2型糖尿病上調BMSCs部分促炎因子的表達,可能引起BMSCs炎癥微環境從而影響其成骨活性。
2.6 2型糖尿病對caspase-3、caspase-8凋亡因子表達的影響 應用qRT-PCR對GK組和Wistar組BMSCs的凋亡因子基因表達進行檢測,結果發現:GK組BMSCs的凋亡因子caspase-3、caspase-8 mRNA表達量在GK組顯著增高,表達量分別為0.27±0.03、0.18±0.03,高于Wistar對照組0.18±0.04、0.14±0.01,P<0.05。該結果與之前流式細胞儀檢測的細胞凋亡趨勢一致,表明2型糖尿病促進BMSCs凋亡活性。
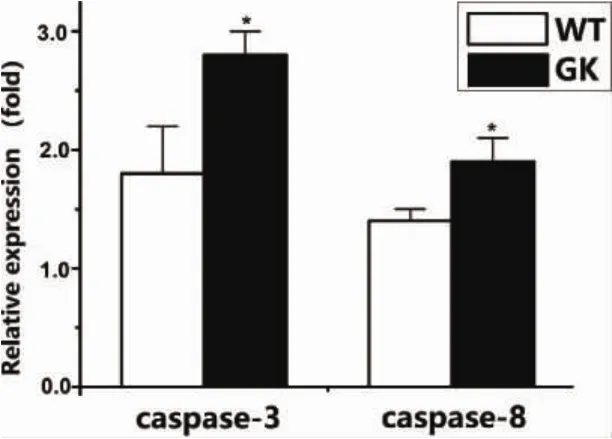
圖7 BMSCs凋亡因子caspase3、caspase8基因表達(*:P<0.05)
3.討論
1型糖尿病和2型糖尿病均增高骨折風險、干擾骨形成及損傷骨愈合。1型糖尿病為胰島素依賴型糖尿病,在1型糖尿病患者和動物模型中,骨礦物質密度(bone mineral density,BMD)指數降低,骨小梁數量減少,骨髓脂肪組織增多[6]。1型糖尿病大鼠的高糖狀態使得Nfic等成骨相關基因表達下降,成骨標記產物降低[7]。臨床研究發現1型糖尿病使腰椎骨折風險增高1.3-2.3倍,股骨頸部骨折風險增高約2.6倍,橈骨遠端骨折風險增高約1.8倍[8]。2型糖尿病為非胰島素依賴型糖尿病,大多研究也認為2型糖尿病增加骨折風險。而有研究表明2型糖尿病影響骨代謝活動與時間相關,初始階段的胰島素抵抗正性影響骨組織,而長期進展的2型糖尿病則損傷骨代謝活動。也有臨床研究發現新確診的2型糖尿病骨折風險與正常人群無明顯差異,而有5年及以上病史2型糖尿病人群的骨折風險顯著上升[9-11]。
本研究發現2型糖尿病大鼠模型骨礦物質密度BMD指數與對照組無顯著差異,這與之前部分研究結論一致,但也有學者指出BMD指數并未能完全反映骨量變化。通過計算機斷層掃描研究2型糖尿病患者髖關節和脊柱,證明2型糖尿病患者具有相似的小梁容積密度,而骨量和橫截面積顯著降低[12,13]。本研究通過顯微CT掃描結果證實2型糖尿病GK大鼠模型的脛骨長度降低、結構模型指數增高。而理論上發生骨質疏松時,骨小梁從板狀向桿狀轉變,結構模型指數增加、骨小梁厚度值減少、骨小梁間距值增加,更多本研究其他的數據包括BMD、骨小梁厚度、骨小梁間距及骨體積分數數值并無顯著差異,說明14周內2型糖尿病尚未顯著引起骨質疏松樣改變。值得一提的是,Burghard等[14]學者發現在骨小梁區域,部分高骨密度面積補償了2型糖尿病受試者中較低的骨密度面積受試者,從而維持骨小梁整體正常的壓縮骨強度;相反,在骨皮質區域,骨骼面積較小,受試者未被高骨密度面積補償,導致骨質下降、彎曲強度和皮質骨脆性增加,這些發現可能有助于解釋2型糖尿病患者髖關節和其他易骨折部位骨折風險增高的現象。有學者[15]報告1型糖尿病患者骨量減少和骨質疏松發病率為48%~72%,2型糖尿病骨質疏松發病率可達20%~60%。糖尿病相關的細胞因子、生長因子、信號通路在問充質干細胞的分化過程中發揮著重要的調控作用,共同導致糖尿病性骨質疏松的發生。由于本研究可能構建2型糖尿病GK模型時間較短,骨計量形態學參數是否會隨著糖尿病進展而發生更明顯的變化,未來需要進一步探究。
骨髓間充質干細胞一直是骨再生醫學的熱點,其具備良好的增殖能力、多向分化能力,是理想的再生醫學種子細胞,對于骨形成活動及更新具有重要意義。本研究結果表明2型糖尿病促進BMSCs凋亡活性、抑制BMSCs的增殖能力和成骨分化能力,抑制骨形成代謝活動。同時,2型糖尿病上調促炎因子白介素 1β(interleukin-1β,IL-1β)、白介素6(interleukin 6,IL-6)、腫瘤壞死因子α(tumor necrosis factor α,TNF-α)的表達,表明 2 型糖尿病引起BMSCs炎癥微環境。有學者[16]研究也發現2型糖尿病大鼠頜骨來源的BMSCs的成骨分化能力受到損害。臨床研究[17]報告2型糖尿病患者血樣品中骨鈣素(osteocalcin,OCN)含量降低,且與IL-6及C反應蛋白含量呈負相關。也有研究表明患有牙周炎的人群也具有顯著增加的TNF-α、IL-1β和IL-6水平[18,19],炎癥延長并伴有脂質過氧化增加[20]。Pacios等[21]學者指出2型糖尿病使成骨細胞OCN表達降低,腫瘤壞死因子水平增加,而使用腫瘤壞死因子抑制劑可以部分恢復成骨相關因子的表達。腫瘤壞死因子還限制下調其他炎癥因子表達的能力,增加核因子-κB活性,從而激活核因子 κB(nuclear factor-kappa B,NF-κB)信號通路,導致成骨細胞fra-1和Runx2基因表達減少,抑制成骨分化能力[22,23]。研究發現2型糖尿病也增加caspase-3凋亡相關基因的表達,促進細胞凋亡的發生[24],本研究結果也驗證了這一趨勢,但炎癥介質影響骨髓間充質干細胞的增殖分化更多具體機制尚需進一步探究。
綜上所述,本研究發現2型糖尿病GK大鼠模型短期內未使長骨發生顯著骨質疏松樣改變;2型糖尿病抑制骨髓間充質干細胞增殖活性及成骨分化能力,上調骨髓間充質干細胞部分促炎因子和凋亡因子的表達。該結果提示,2型糖尿病引起的炎癥微環境可能是抑制骨形成代謝的原因之一,研究抑制或逆轉炎性介質作用或成為調控恢復2型糖尿病微環境下的骨髓間充質干細胞成骨活性的新思路。

