氘重氧水液相催化交換法氫正常化工藝研究
蔣琮琪,劉 嚴,肖 斌
(1.上海化工研究院有限公司,上海 200062;2.蘇州聯清生物科技有限公司,江蘇 215434)
重氧水是重氧同位素的氫化物,物理和化學性質與普通水相似。重氧元素可以作為示蹤劑廣泛用于核醫學顯像、生物醫藥、環境監測、生命科學等領域。目前,重氧水廣泛應用于核醫學診斷領域,是PET正電子顯像藥物18F-FDG的主要合成原料,該藥物通過回旋加速器轟擊18O生成18F-,再經自動藥物化學合成靜脈注射劑。
國內重氧水的主要生產方法是水精餾法,該方法在富集重氧(18O)元素的同時富集氘(D)元素,得到含氘重氧水(HD18O)。氘元素是常用的減速劑,在回旋加速器內轟擊重氧元素時,如果有氘元素存在,會使產品產率大大降低。而且在精餾生產18O的過程中,氘含量增加會引起氧-16/氧-18分離系數顯著減小,增加分離難度[1]。所以需要將氘重氧水中的氘元素變成氫元素,去除氘元素的過程為氫正常化。
目前,國內重氧水氫正常化通過電解裝置使氘重氧水產生重氧氣體和重氫氣體,去除重氫氣體后將重氧氣體經分離、冷卻、干燥后與高純氫氣經催化化合反應生成重氧化氫氣體,再冷凝成產品重氧水。該方法對裝置的氣密性要求極高,流程復雜、極易發生爆炸。利用電解使重氧水氫正常化生產成本高,安全風險大,有待開發一種流程簡單,安全經濟的方法。
液相催化交換法(LPCE)是氣態氫同位素與液態水之間進行氫同位素交換,從水中分離氫同位素的有效方法之一,目前主要用于含氚重水提氚、重水升級、含氚廢水脫氚以及重水生產等領域[2]。利用液相催化法進行含氘重氧水氫正常化研究還未見相關報道。本研究采用LPCE處理含氘重氧水,將含氘重氧水通過裝有疏水催化劑Pt/C/PTFE與親水填料的反應交換柱,與高純氫氣體進行同位素交換反應,使含氘重氧水氫正常化。本實驗系統研究了低氘濃度下的氘重氧水液相催化交換法氫正常化工藝,為進一步開展高氘濃度氘重氧水液相催化交換法氫正常化工藝研究提供依據。
1 主要材料與儀器
1.1 主要儀器
蘭格蠕動泵-BT300-2J、耐熱石英交換柱-Φ32 mm×1 500 mm、朗凡MF4008氣體質量流量計、GC8800H氣相色譜儀:上海科創色譜儀器有限公司;DHFY-10/10恒溫反應浴:上海科興儀器有限公司。
1.2 主要材料
自制1%(重量百分比)Pt/C/PTFE疏水催化劑、Φ2 mm×2 mm Dixon填料、藍色硅膠干燥劑、氘重氧水(18O:97%,D:1%)、高純氫(99.999%)。
2 實驗方法
2.1 實驗原理
氫水同位素液相催化交換法操作方便、安全、節能,其核心是疏水催化劑,常用的疏水催化劑有Pt/C/PTFE和Pt/SDB。氫水同位素液相催化交換的工藝關鍵設備是催化交換柱,催化交換過程分為氣液相轉變和氣相催化交換,以H2-HD18O同位素交換為例,催化交換過程[3]為:

(a)
該過程可分為兩步:

(b)

(c)
反應式(b)為氣液相轉變過程;反應式(c)為氣相催化交換反應,是總反應過程的速率控制步驟。g代表氣相,l代表液相,v代表蒸汽相。
2.2 實驗流程
實驗反應流程圖示于圖1。將含氘重氧水經預熱器預熱后從交換柱頂部進入交換柱內,高純氫氣體經預熱器預熱后從交換柱底部進入交換柱內,高純氫與含氘重氧水在交換柱內進行催化交換反應,分析交換柱頂部氫氣中的氘含量。每組實驗開始前和結束后,用高純氮氣吹掃交換柱20 min。
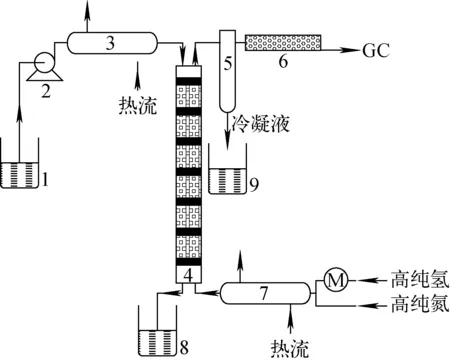
1——原料儲罐;2——恒流泵;3、7——預熱器;4——催化交換柱;5——氣液分相罐;6——干燥管;7——預熱器;8——產品收集罐1;9——產品收集罐2 圖1 實驗流程圖1——Material tank;2——The constant flow pump;3、7——Preheater;4——Catalytic exchange column;5——Gas-liquid split tank;6——Drying tube;8——Product collecting tank1;9——Product collecting tank2Fig.1 Flow diagram of the experiment
2.3 實驗條件
含氘重氧水(18O:97%,D:1%;L=0.1 kg/h)通過預熱器進入交換柱,交換柱內徑32 mm,長1.5 m,由耐熱石英加工而成,交換柱中裝填7段疏水催化劑(Pt/C/PTFE)和親水填料(Dixon填料),裝填比30%,每段疏水催化劑高65 mm,交換柱外設有加熱套控制反應溫度,反應溫度30~70 ℃,高純氫氣(D:0.015%)通過預熱器從交換柱底部進入交換柱,氣液摩爾比0.5~3.0。交換柱出口氫氣經氣液分離后,取樣經GC8800H分析氘含量。
3 結果與討論
3.1 理論關系推導
總體積傳質系數(Kya)是液相催化交換反應進行的量度(即氫同位素與液態水間發生同位素交換的總量)表征方法之一。Kya表示在固定體積的催化交換柱中單位時間單位催化床體積轉移某種氫同位素的量。逆流交換柱中:
(1)
式中:F為氫氣線速度,m·s-1;h為催化層的有效高度,m;NTU為傳質單元數。
(2)
G*(yt-yb)=L*(xt-xb)
(3)
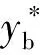
Kya在工藝技術方面的實用性強,通過Kya衡量重氧水液相催化交換法氫正常化工藝的技術參數(溫度和氣液比)對除氘效果的影響,Kya值越大,單位時間單位催化床體積轉移某種氫同位素的量越多,催化轉化的效果越好,氘重氧水氫正常化的效果也越好。
分離系數α為液相中氘和氫的摩爾數比與氣相中氘和氫的摩爾數比的比值:
(4)
以H2-HD18O交換反應為例:
(5)
式中:K為平衡常數;x為液相中的氘含量;y為氣相中的氘含量。理想狀態下,反應物和生成物濃度:[HD]=2y(1-y),[H218O]=(1-x)2,[H2]=(1-y)2,[HD18O]=2x(1-x),則有:
(6)
根據平衡常數和分離系數的定義,兩者存在一定區別,僅在每種分子中只有一個可交換原子的氫同位素交換反應時,α=1/K成立,在高溫或較低氘濃度時,分離因子α=1/K[4]。
對于H2-HD18O氣相催化交換反應(c),催化交換平衡常數Kv-g由統計熱力學計算出與溫度的關系式[5]:
(7)
對于HD18O-H218O氣液相反應(b),根據其定義以及拉烏爾公式,得出:
(8)
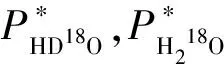
Hook給出的三參數數據列于表1[6],方程如公式(9):
(9)
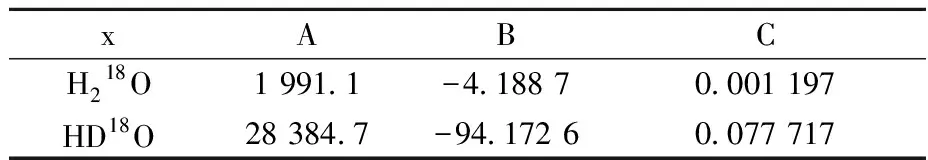
表1 Hook三參數數據[6]Tabel 1 W. Alexander Van Hook A, B, C value[6]
由公式(9)及表1數據可得:
(10)
(11)
K=Kg-v*Kv-l=1.363 9*
(12)
(13)
溫度-分離系數曲線示于圖2。分離系數α隨溫度升高而降低,α在283.15~353.15 K的變化趨勢結果表明,交換溫度越高,氘元素越容易向氣相中轉移。
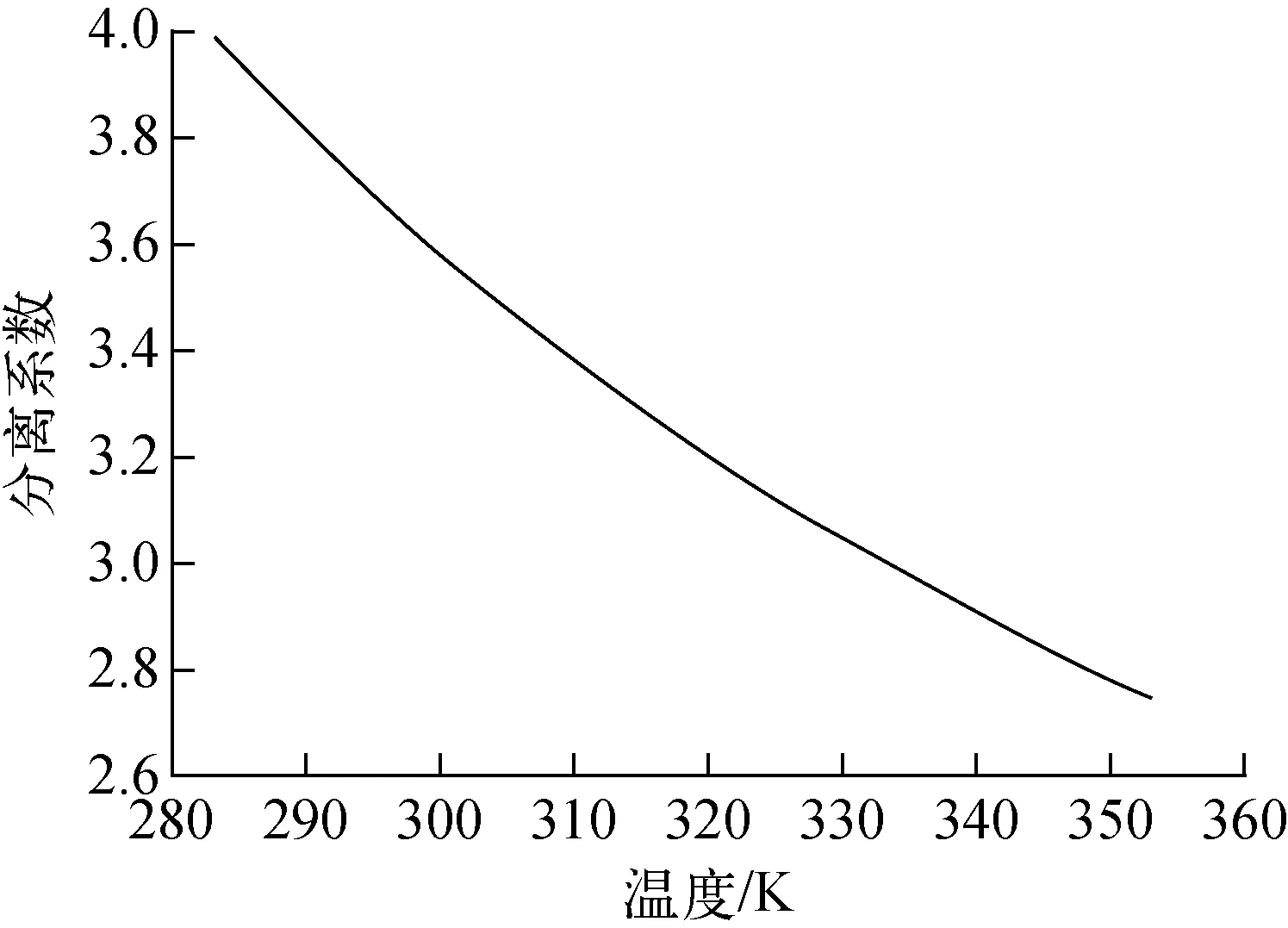
圖2 溫度-分離系數曲線圖Fig.2 Influence of temperature on α
3.2 溫度對總傳質系數的影響
溫度與總體積傳質系數的關系示于圖3。從理論上分析,溫度升高,分離系數越小,氘越容易向氣相轉移。從圖3結果可知,溫度較低時,總體積傳質系數隨溫度升高而升高,此時不論是氣液相轉變過程還是氣相催化交換過程,升高溫度均能提高交換過程的平衡常數,所以交換柱內的總體積傳質系數增大。在實際操作條件下,總體積傳質系數不僅受溫度影響,同時也受其他因素影響,溫度超過60 ℃后,Pt/C/PTFE催化劑達到最佳使用溫度,繼續升高溫度,水相的汽化量增加,阻礙液體水的下流及均勻分布,影響傳質效果,故H2-HD18O催化交換反應溫度以60 ℃為宜。
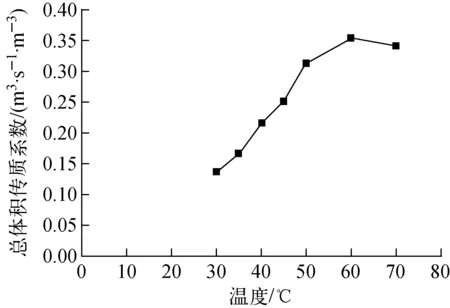
圖3 溫度-總體積傳質系數圖Fig.3 Influence of temperature on Kya
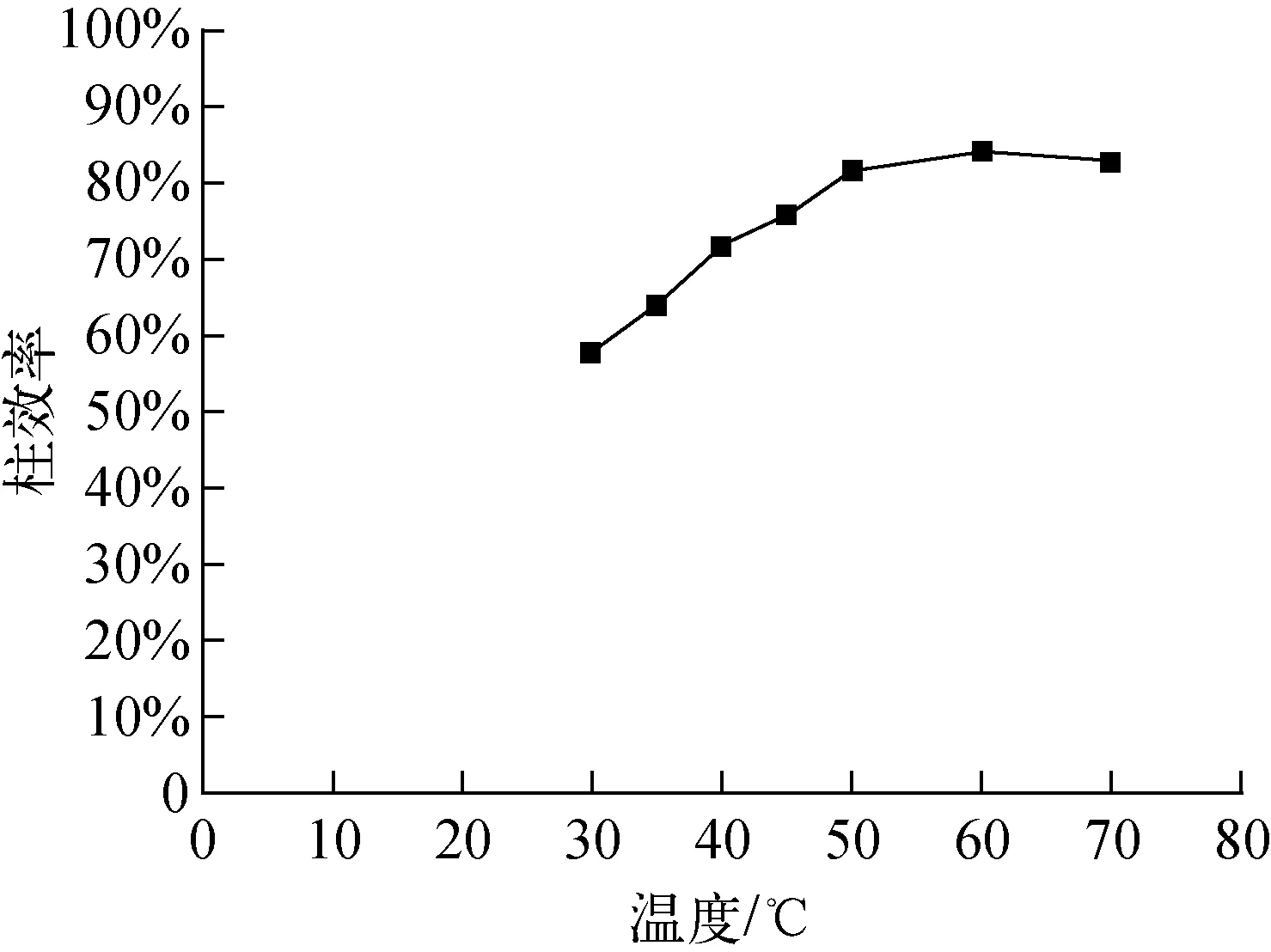
圖4 溫度-柱效率曲線圖Fig.4 Influence of temperature on η
3.3 氣液比對總體積傳質系數的影響
液體流量為0.1 kg/h,氣液比對Kya的影響結果示于圖5。由圖5結果可知,當氣液比大于2,總體積傳質系數的增長速度減緩。這是因為氣液比的增大能夠提升總體積傳質系數,但不能任意加大氣液流量,對于一個固定直徑的交換柱,它對液體處理量的大小由交換柱的液泛系數決定,而液泛系數跟交換柱裝填的填料比表面積、裝填方式、空塔氣速有關,如果盲目增大氣液流量,一是會導致氣液流速過快,交換柱內氣液接觸時間過少,交換效率降低;二是氣液流速越大,水汽夾帶現象越嚴重,交換柱內會發生液泛,交換柱的傳質效率就會大大下降。從實驗結果分析,在不發生液泛的前提下,氣液比越大,氘重氧水氫正常化效果越好。
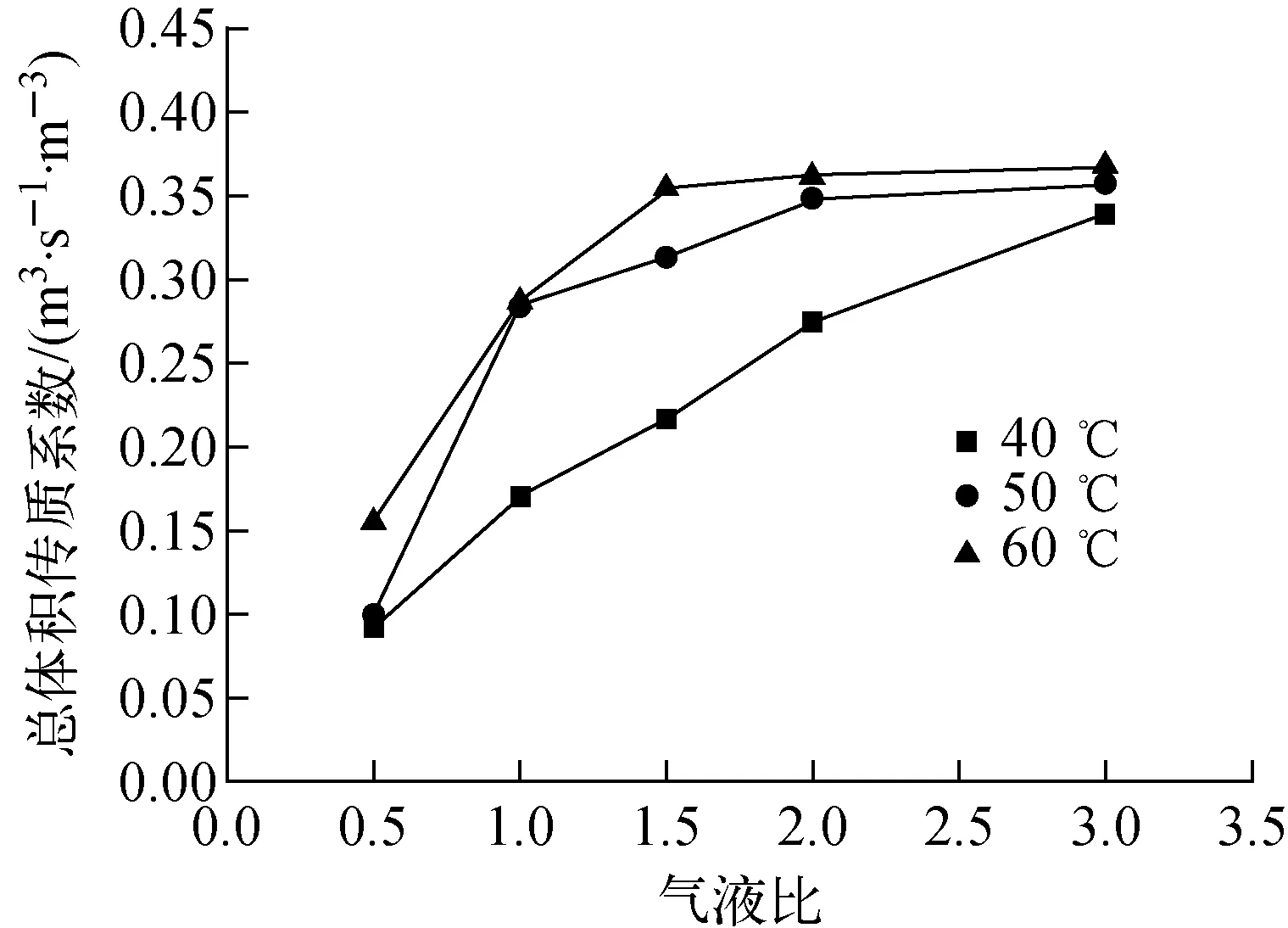
圖5 氣液比對Kya的影響Fig.5 Influence of G/L ratio on Kya
4 小結
(1) 隨著溫度升高,含氘重氧水除氘過程的總體積傳質系數Kya值先變大后變小。溫度超過60 ℃后,水相的汽化量增加,阻礙液體水的下流及均勻分布,從而影響H2-HD18O傳質效果,故最優交換溫度為60 ℃。
(2) 氣液比越大,H2-HD18O總體積傳質系數Kya越大,氘重氧水的除氘效果越好,但不能盲目增大氣液比,氣液比越大越容易造成液泛,同時過大的氣液比會減少氣液兩相接觸時間,降低交換效率。
致謝:感謝高級工程師秦川江在液相催化交換理論方面給予的指導;感謝工程師池毅在實驗裝置搭建的過程中給予幫助;感謝高級工程師李猷在樣品檢測方面提供的方便。

