鼻咽癌放療后雙側顳葉白質及海馬結構早期損傷的擴散峰度成像研究
陳紅,何浩強,呂曉飛,韓路軍,楊雅迪,李晶,文戈
鼻咽癌(nasopharyngeal carcinoma,NPC)是好發于我國南方的惡性腫瘤,放射治療是鼻咽癌的主要治療方式,而放射治療難以避開臨近的雙側顳葉、海馬等結構,放射性腦損傷已成為嚴重影響患者生活質量的并發癥之一[1]。晚期放射性腦損傷為不可逆性,治療效果較差,故早期監測放射性腦損傷尤為重要。既往擴散張量成像(diffusion tensor imaging,DTI)對放射性腦損傷研究集中于白質,且DTI是假設分子呈高斯運動,而生物組織由于受到細胞膜、細胞器、細胞內外環境的影響,分子運動呈非高斯擴散[2]。擴散峰度成像(diffusion kurtosis imaging,DKI)作為DTI技術的延伸,適用于研究腦組織灰白質,能夠反映非高斯運動的擴散特性,更接近組織中分子真實擴散情況,從而反映腦組織微觀結構變化[3-6]。近年來,DKI已在輕微腦損傷、注意力缺陷多動障礙、阿爾茨海默病、乳腺癌、前列腺癌、腦膠質瘤等有初步運用,但其在鼻咽癌顳葉白質及海馬早期隱匿性放射性腦損傷的研究鮮見。本研究旨在采用DKI技術探討鼻咽癌早期放射治療后雙側顳葉及海馬微觀結構變化的非高斯擴散特點,評價DKI在早期放射性腦損傷的運用價值,以期為其臨床早期發現及監測提供客觀依據。
1 材料與方法
1.1 研究對象
本研究共納入鼻咽癌組(NPC組)及正常對照組(NC組)兩組被試。NPC組為2015年10月至2018年1月在中山大學腫瘤防治中心就診的29例NPC患者,男21例,女8例,年齡(40.28±9.45)歲,教育年限(12.29±2.98)年,鼻咽癌分期:AJCC第7版TNM I-IVb期。
納入標準:(1)經活檢病理證實,且未接受手術、誘導化療、放療等抗腫瘤治療的鼻咽癌初診患者;(2)擬按臨床計劃行適型調強放射治療(intensity modulated radiation therapy,IMRT);(3)年齡18~60歲,右利手;(4)無遠處轉移及明顯顱內侵犯征象;(5)常規MRI檢查顱內無明顯實質性病變(包括腦實質腫瘤、腦組織炎癥、腦血管病變、腦白質病變);(6)既往無顱腦外傷及手術史,無神經及精神疾病史。
排除標準:(1)對磁共振檢查禁忌者;(2)糖尿病、高血壓患者及合并其他系統疾病;腫瘤復發再次放療或不能堅持及完成IMRT治療者;(3)文盲、智力或視力低下不能完成量表測試者。
NC組為同時期收集的20例正常被試者,男13例,女7例,年齡(41.00±10.04)歲,教育年限(12.15±3.48)年。所有正常被試均無不適臨床癥狀;無顱內病變;無嚴重血管疾病及腫瘤病史;無本人及家族性精神疾病史;無高血壓及糖尿病;無其他全身性或系統性疾病;無藥物濫用史;均為漢族、右利手。
所有NPC被試于治療前及放療后3個月時、所有NC被試均接受顱腦MRI檢查。被試在MRI檢查當天行蒙特利爾認知評估量表(Montreal cognitive assessment,MoCA)量表測試,完成量表評價的NPC組治療前被試26例、NPC組放療后3個月被試18例、NC組被試20例。本研究通過中山大學腫瘤防治中心倫理委員會審核批準(批準號:GZR2014-073),所有被試在檢查前均簽署了知情同意書。
1.2 鼻咽癌治療方法和劑量
1.2.1 放射治療
鼻咽癌患者均行根治性IMRT,選用大孔徑CT以3 mm層距進行平掃及增強掃描,掃描范圍從頭到胸鎖關節下2 cm,參照ICRU50[7]和62號[8]文件勾畫鼻咽大體腫瘤體積(GTVp)、頸部轉移淋巴結體積(GTVnd)、臨床靶區體積1(CTV1)及臨床靶區體積2(CTV2),GTVp、GTVnd、CTV1、CTV2靶區處方劑量分別為:66~72 Gy、64~70 Gy、60~63 Gy、54~56 Gy[9],劑量分割次數為30~33次。對雙側顳葉和海馬結構在逐個CT圖像層面上勾畫進行劑量評價,通過Eclipse或Monaco計劃系統將鼻咽癌患者劑量數據進行收錄匯總。雙側顳葉及海馬最大劑量/平均劑量分別如下,左側顳葉:(7009.8±690.4) cGy/(1928.9±572.8) cGy;右側顳葉:(7019.4±710.6) cGy/(2029.7±668.3) cGy;左側海馬:(4911.7±1495.4) cGy/(2150.1±816.4) cGy;右側海馬:(4983.9±1460.9) cGy/(2160.3±890.1) cGy。
1.2.2 化療
鼻咽癌化療方案相近,鼻咽癌患者均經過1~3程誘導化療或/和同期放化療,化療方案包括TPF (多西他賽+順鉑+5-氟尿嘧啶)、TP (紫杉醇+順鉑)、DDP (順鉑)、力樸素、尼妥珠單抗等化療方案。
1.3 MRI數據采集
采用GE Discovery MR750 3.0 T掃描儀和32通道頭線圈。掃描序列包括常規MR序列(矢狀位3D-T1WI、T2FLAIR)和DKI序列。掃描參數如下,矢狀位3D-T1WI:矩陣256×256,FOV 256 mm×256 mm,層厚1 mm,層間距0,FA=8°,TR 8.2 ms,TE 3.2 ms,TI 800 ms,掃描層數176層。DKI:25個方向擴散敏感度,b值分別為:0、1000、2000 s/mm2,矩陣128×128,FOV 240 mm×240 mm,層厚3 mm,層間距0,TR 5300 ms,TE 77.1 ms,NEX為1,掃描層數46層。
1.4 圖像后處理
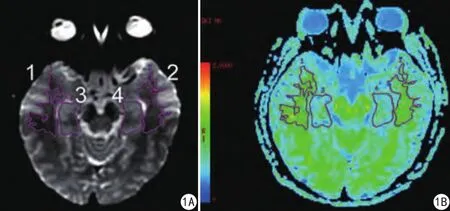
圖1 DKI參數測量的ROI示意圖。1為右側顳葉白質ROI,2為左側顳葉白質ROI,3為右側海馬ROI,4為左側海馬ROI;勾畫過程參考b0圖。A;b0圖;B:MK彩圖Fig. 1 The ROI maps for measurement of DKI parameters. ROI 1 represents the white matter of the right temporal lobe. ROI 2 represents the white mater of the temporal lobe. ROI 3 represents the right hippocampus. ROI 4 represents the left hippocampus. ROIs were drawn referred to b0 and MK maps. A: b0 map. B: MK map.
使用ADW4.6工作站對數據進行分析處理,得到7個參數圖:各向異性分數(fractional anisotropy,FA)圖、平均擴散系數(mean diffusivity,MD)圖、軸向擴散張量(axial diffusivity,Da)圖、徑向擴散張量(radial diffusivity,Dr)圖、平均峰度(mean kurtosis,MK)圖、軸向峰度(axial kurtosis,Ka)圖、徑向峰度(radial kurtosis,Kr)圖,于雙側顳葉白質、雙側海馬手動勾畫ROI (region of interest),ROI放置于靠近側腦室下角的雙側顳葉白質、雙側海馬最大面積層面,應盡量避開腦溝、腦室以及鄰近的血管等結構。勾畫過程參考b0圖及DKI彩圖,同時將ROI投射到其他DKI參數圖上(圖1)。ROI的勾畫參考以往文獻[10-11],由2名醫師(具有3年經驗的住院醫師及11年經驗的副主任醫師)共同討論決定,并測量3次后取平均值。
1.5 統計學分析
采用SPSS 23.0軟件包對數據進行分析。首先采用kolmogorov-smimov法對數據進行正態分布檢驗,數據符合正態性分布時采用配對或兩獨立樣本t檢驗。ROI測量的各DKI參數值以均數±標準差(±s)形式表示。采用兩獨立樣本t檢驗比較NPC組治療前和NC組的年齡、教育年限間的差異,采用χ2檢驗比較NPC組和NC組的性別差異。采用兩獨立樣本t檢驗對NPC組治療前與NC組基線DKI各參數值及MoCA量表評分差異進行比較,采用配對樣本t檢驗對NPC組治療前及3個月后各DKI參數值及MoCA量表評分差異進行比較,DKI相關參數的比較采用同側分別進行比較。在NPC組內,采用兩獨立樣本t檢驗對放療前后有統計學差異的左右側顳葉DKI參數值的變化程度進行比較;對NPC組內放療前后差異有統計學意義的DKI參數值,采用偏相關分析,以年齡、性別、教育年限作為協變量,分析其放療前后差值變化與MoCA量表評分差值變化、與所在同側顳葉/海馬的最大/平均劑量之間的相關關系。上述P<0.05被認為具有統計學意義。

圖2 NPC組治療前與放療后雙側顳葉白質及右側海馬的DKI參數變化。Temp_R:右側顳葉白質;Temp_L:左側顳葉白質;HIPP_R:右側海馬;pre_NPC:鼻咽癌組治療前;3m_NPC:鼻咽癌組放療后3個月;NC:正常對照組;ns:無統計學差異Fig. 2 Changes of DKI related parameters of the bilateral temporal lobe white matter and the right hippocampus before and after treatment in NPC group. Temp_R: white matter of right temporal lobe, Temp_L: white matter of left temporal lobe. HIPP_R: right hippocampus. pre_NPC: pretreatment in NPC group. 3m_NPC: 3 months after radiotherapy in NPC group. NC: normal control. ns: not significant.
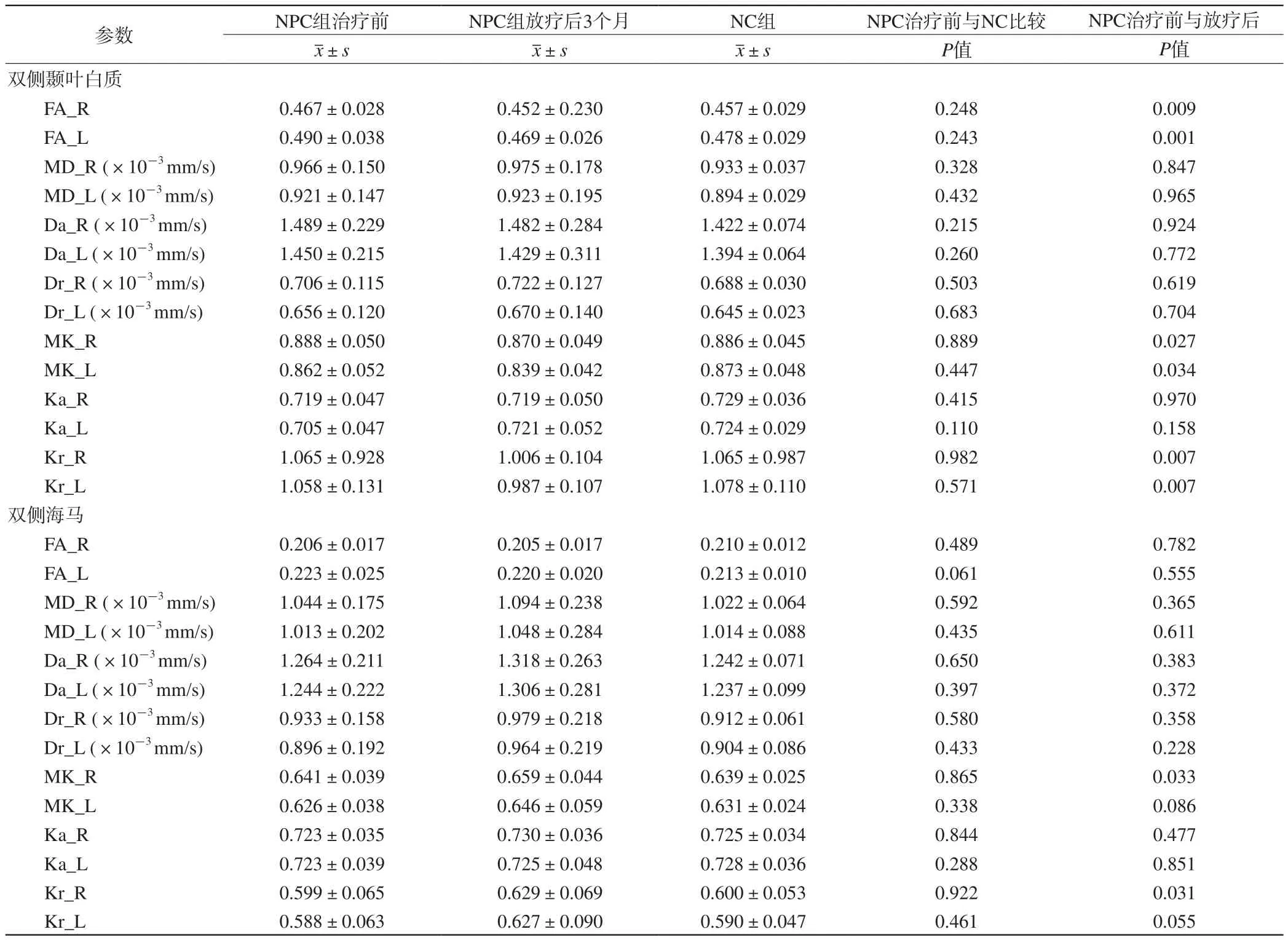
表1 NPC組和NC組雙側顳葉白質、雙側海馬ROI各參數比較Tab. 1 Comparisons of the parameters of each ROI within bilateral temporal lobe white matter and bilateral hippocampus between NPC group and NC group
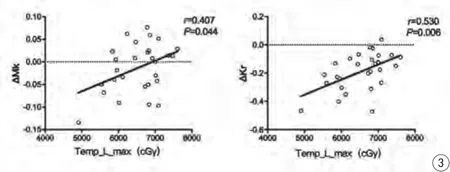
圖3 NPC組左側顳葉白質治療前與放療后3個月MK、Kr的差值(△MK、△Kr)與左側顳葉放療最大劑量(Temp_L_max)呈顯著正相關Fig. 3 The different values of MK and Kr (△MK, △Kr) in white matter of the left temporal lobe show significant a positive correlation with the maximum irradiation dose of the left temporal lobe (Temp_L_max), respectively.
2 結果
2.1 臨床資料
NPC組和NC組臨床資料無統計學差異(年齡:t=0.66,P=0.36;教育年限:t=0.21,P=0.89;性別:χ2=0.30,P=0.58)。
2.2 雙側顳葉及海馬各DKI參數值比較
2.2.1 雙側顳葉白質
與NPC組治療前比較,NPC組放療后3個月雙側顳葉白質的FA(左側:P=0.009;右側:P=0.001)、MK(左側:P=0.027;右側:P=0.034)、Kr值(左側:P=0.007;右側:P=0.007)均顯著減低(表1,圖2);左右顳葉白質的放療前后FA、MK、Kr值的變化程度、雙側顳葉白質的MD、Da、Dr、Ka值治療前與放療后3個月的改變均無顯著統計學差異(P值均大于0.05)。NPC組治療前與NC組基線雙側顳葉白質的各DKI參數值均無顯著統計學差異。
2.2.2 雙側海馬
與NPC組治療前比較,NPC組放療后3個月右側海馬的MK值(P=0.033)、Kr值(P=0.031)顯著升高(表1,圖2);左側海馬的MK、Kr值、雙側海馬的MD、Da、Dr、Ka值的改變均無顯著統計學差異。NPC組治療前與NC組基線雙側海馬各DKI參數值均無顯著統計學差異。
2.3 MoCA量表評分值比較及相關性分析
NPC組放療后3個月的MoCA評分[(27.47±2.04)分]較治療前MoCA評分[(28.94±1.20)分]顯著減低(t=2.58,P=0.02)。NPC組治療前與NC組的MoCA評分[(28.90±0.91)分]統計學分析無顯著統計學差異(t=0.32,P=0.75)。偏相關分析結果表明,NPC組治療前與放療后MoCA量表的差值與雙側顳葉放療最大/平均劑量、與雙側海馬放療最大/平均劑量、與雙側顳葉白質放療前后FA、MK、Kr差值、與右側海馬放療前后MK、Kr差值的相關性均無顯著統計學差異(P值均大于0.05)。
2.4 DKI差異參數的變化與放療最大/平均劑量相關性分析
在NPC組內,左側顳葉白質治療前與放療后3個月MK、Kr的差值(△MK、△Kr)與左側顳葉放療最大劑量呈顯著正相關(P=0.044,r=0.407;P=0.006,r=0.530)(圖3),與左側顳葉放療平均劑量無顯著相關(P>0.05)。右側顳葉白質治療前與放療后3個月MK、Kr的差值與右側顳葉放療最大/平均劑量、右側海馬治療前與放療后3個月MK、Kr的差值與右側海馬放療最大/平均劑量、雙側顳葉白質治療前與放療后3個月FA的差值與右側顳葉放療最大/平均劑量均無統計學差異(P值均大于0.05)。
3 討論
3.1 DKI參數在放射性腦損傷中的運用
放射性腦損傷是NPC患者嚴重影響生活質量的并發癥,根據放療時間和臨床癥狀,放射性腦損傷分為三個階段:急性反應期(放療后數天到數周內),亞急性期或早期延遲反應期(放療3個月后),晚期延遲反應期(放療后6個月到數年)[12-13]。早期放射性腦損傷的臨床癥狀表現為嗜睡、頭痛、惡心等,這些通常是短暫可逆的,晚期延遲反應期癥狀包括不同程度的漸進性神經認知功能損害,甚至最終不可逆性的放射性腦壞死[14],因而放射性腦損傷的臨床早期檢測顯得尤為重要。
DKI在DTI模型的基礎上引入了概率與四階峰度,可以評價腦組織白質和灰質水分子擴散的受限程度及擴散的不均質性,顯示DTI難以顯示的纖維交叉、彎曲等復雜微觀環境的結構特征[15]。DKI可同時獲得衍生的DTI擴散度量(FA、MD、Da、Dr)及DKI度量指標(MK、Ka、Kr)[5]。FA常用來評價腦白質水分子沿纖維束方向的擴散,MD用于反映分子整體擴散水平和擴散阻力的整體情況,Da及Dr分別代表與軸突方向平行和垂直的水分子的擴散。MK是定義為峰度在所有方向峰度的平均值,被認為是組織微結構復雜程度的指標,Ka是指沿著擴散橢球軸向的峰度值,Kr代表擴散正交方向上的峰度值,因擴散受限主要在徑向,Kr較Ka較為突出[5]。
3.2 顳葉白質的DKI參數改變及其意義
本研究中,NPC組雙側顳葉白質放療后3個月FA值較治療前顯著減低,這與以往的人體及動物實驗研究結果相似[14,16-19]。在放療后早期延遲反應期,由于白質軸突的脫髓鞘過程,會導致FA值的減低,并且由于放療后早期的炎癥反應,充填在軸突周圍的膠質細胞增生及周圍血管的水腫,軸突密度的減低,這也會導致顳葉白質的FA值減低[14,16-17,19]。還有一種說法認為,由于水腫的存在,軸突組織變得疏松,其組織排列變得不規則,組織一致性減低,導致了FA值的減低[2]。本研究中NPC組放療后3個月雙側顳葉白質MK值較放療前顯著減低,可能是由于雙側顳葉白質放療后軸突完整性破壞,細胞減少,軸突密度減低,導致了腦組織復雜程度減低[3-4,12,15]。在以往潘海賓等[20]的橫斷面研究中,亦發現了鼻咽癌放療結束后早期出現顳葉白質MK值降低,但他們的研究并未進一步探討Kr及Ka值的變化。我們進一步的研究發現雙側顳葉白質放療后Kr值減低,說明水分子垂直于軸突方向的擴散受限程度減低,進一步說明了NPC組放療后顳葉白質早期延遲反應期脫髓鞘過程的存在[15]。而本研究中反映髓鞘完整的DTI衍生參數Dr在鼻咽癌放療前后并未有顯著差異,與之相似的是,Cheung等[21]的研究發現Kr值較Dr值能更敏感探測神經組織徑向的改變,本研究結果表明Kr值能比DTI衍生參數Dr值能夠更敏感反映NPC放療后顳葉白質髓鞘的丟失。
3.3 海馬的DKI參數改變及其意義
海馬是對放療后早期損傷效應尤為敏感的腦區。本研究首次探討了海馬放療后早期的擴散峰度改變,我們發現NPC組放療后3個月右側海馬的MK值及Kr值顯著升高。海馬是以灰質為主的顳葉解剖結構,MK值的升高可能是由于放療后早期神經元胞體細胞和細胞器腫脹,且伴隨著膠質細胞的增生,導致腦灰質組織的復雜程度升高所致。而右側海馬放療后3個月的Kr值升高,可能是由于NPC放療后早期延遲反應期神經元細胞及細胞器腫脹,膠質細胞增生,導致了水分子擴散受限程度升高[15]。放療后早期顳葉海馬擴散峰度參數改變模式的機制需要進一步深入研究。
3.4 DKI的參數改變與放療劑量相關關系及其意義
劑量依賴性的改變在放射性腦損傷相關研究常有報道[13,22-25],而擴散峰度參數的變化與劑量間的關系鮮有研究。本研究中NPC組左側顳葉白質治療前和放療后3個月的MK、Kr值差值和左側顳葉放療最大劑量值呈顯著正相關關系,提示NPC組顳葉白質的微觀結構改變與放療劑量密切相關。與之相似的是,以往的臨床和動物實驗研究究表明放射性腦損傷與放療劑量有關[22-25]。而右側顳葉白質、右側海馬治療前后的MK、Kr差值與相關放療劑量無顯著統計學差異,可能是由于本研究樣本量不夠大所致。
3.5 MoCA量表值的改變及其意義
本研究發現NPC組放療后3個月的MoCA量表值減低,表明了NPC組放療后早期延遲反應期患者的神經認知功能下降。有研究認為放療引起的學習及記憶功能減退與海馬的損傷有關[26]。海馬被認為負責言語記憶的形成,其功能障礙可能會導致患者記憶能力下降[10,27]。放療可能會引起血管的損傷從而導致海馬結構功能障礙,有臨床試驗表明放療時保護海馬能使患者早期意識功能障礙的受損程度減低[28]。但本研究MoCA量表評分值的改變與DKI參數值的改變沒有顯著相關性,這可能是由于MoCA量表評估的簡單性及不敏感性引起的,以往的研究顯示MoCA量表在評價被試的執行功能、語言和視覺記憶、注意力方面并不非常敏感[29]。
本研究仍存在一些不足:(1)本研究樣本量偏小,今后將擴大樣本量進一步研究;(2) MoCA量表是簡易神經認知評估量表,有待進一步采用精細量表評估神經認知功能;(3)盡管本研究表明顳葉白質損傷與放療關系密切,但所有NPC組患者均進行誘導化療或(和)同期放化療,化療藥物對腦組織結構的損傷仍未能排除[30],進一步研究單純放射治療患者的顳葉損傷可以排除化療影響;(4)本研究采用手動勾畫ROI方式獲得DKI參數值,其可重復性較差,今后采用基于體素的全腦研究可以克服這一局限性。
綜上所述,本研究顯示了鼻咽癌放療后早期雙側顳葉白質和海馬的隱匿性微觀結構改變,并表明左側顳葉白質擴散峰度參數呈劑量依賴性改變,采用DKI能較DTI更敏感地發現這些病變非高斯擴散特點。DKI可以作為客觀的影像學手段監測鼻咽癌放療后顳葉白質和海馬早期隱匿性放射性腦損傷,為臨床早期發現及干預提供客觀影像學依據。
利益沖突:無。

