磁性石墨烯/β-環糊精復合材料固相萃取-HPLC-MS/MS法檢測飼料中的6種鎮靜劑和5種β-受體激動劑
何曉明,余鵬飛,陳 可,趙月鈞,沈雄雅,胡永東,倪娟楨
(綠城農科檢測技術有限公司,浙江杭州31052)
隨著養殖業的快速發展,鎮靜劑和β-受體激動劑作為促生長劑被廣泛用于動物養殖過程中。鎮靜劑是一類對中樞神經系統具有抑制作用的藥物,具有抗驚厥、鎮靜催眠、抗焦慮、肌肉松弛和安定作用,在飼養過程中將此類藥物添加至飼料中以達到快速催肥、縮短出欄時間的目的[1]。β-受體激動劑,俗稱“瘦肉精”,可以選擇性地作用于腎上腺素,增加蛋白質合成、增強脂肪分解代謝,顯著提高酮體瘦肉率[2]。研究表明,鎮靜劑和β-受體激動劑可通過飼料進入到動物組織,長期食用會對人體中樞神經系統等造成不良影響[3-4]。我國原農業部176號、193號公告中明確規定嚴禁在動物飼養過程中使用該類藥物。因此,建立一種快速、高效、靈敏、準確地檢測飼料中多種鎮靜劑和β-受體激動劑的方法,對保障畜產品的質量安全具有重要意義。
迄今為止,鎮靜劑和β-受體激動劑的檢測方法主要包括:酶聯免疫法(ELISA)[5]、氣相色譜-質譜法(GCMS)[6-7]、液相色譜法(HPLC)[8]和高效液相色譜-串聯質譜法(HPLC-MS/MS)[9-10]。ELISA法和HPLC法方法靈敏度較低,選擇性較差,不能滿足痕量檢測的要求。GC-MS法通常需要衍生化才能進行測定,費時較長。HPLC-MS/MS法因其具有靈敏度高、選擇性和抗干擾能力強,成為最常用的檢測方法。
由于鎮靜劑和β-受體激動劑在飼料中一般以痕量存在,且飼料基質復雜,易對分析造成干擾,在進行檢測分析前需進行富集和凈化。目前,飼料樣品殘留的前處理方法主要是固相萃取技術(SPE),存在如操作繁瑣、處理時間長、成本高等問題。相比之下,基于磁性石墨烯的磁性固相萃取技術因結合了磁性萃取操作簡單、傳質迅速、材料可回收利用和石墨烯具有巨大的比表面積和對有機化合物產生強大的π-π相互作用等特點,目前已被應用于多個領域[11-13]。然而,石墨烯作為一種疏水性的碳基納米材料,在萃取過程中容易團聚,極大地阻礙了其在前處理技術中的應用。
β-環糊精(β-CD)是由7個D-(+)吡喃葡萄糖通過α-1,4糖苷鍵首尾相連而成環形低聚糖,具有一個環外親水的疏水腔,能夠選擇性吸附各類客體分子在疏水空腔內形成穩定的主客體絡合物。利用β-環糊精修飾磁性石墨烯制備納米復合材料,保留了磁性石墨烯和β-環糊精兩者的自身優點,也可以增加石墨烯的親水性和分散性,避免石墨烯由于π-π 作用和范德華力作用而團聚的現象,提高萃取效率[14-17]。
本研究利用改進的磁固相萃取對飼料進行前處理,自制了一種新型的吸附劑(Fe3O4-G/β-CD)對飼料中的6種鎮靜劑和5種β-受體激動劑進行萃取,同時結合HPLC-MS/MS對其進行測定。本方法具有較高的靈敏度及精密度、較短的實驗時間、較低的分析成本等特點,能滿足目前的檢測要求。
1 材料與方法
1.1 儀器與試劑
LC-MS/MS 8050三重四級桿液相色譜-串聯質譜儀(日本Shimadzu公司);ST16R高速冷凍離心機(美國Thermo公司);DZF-0632真空干燥箱(上海一恒科學儀器有限公司)。
β-受體激動劑類:克倫特羅、沙丁胺醇、萊克多巴胺、西馬特羅、特布他林;鎮靜劑類:氯丙嗪、地西泮、艾司唑侖、咪達唑侖、奧沙西泮、硝西泮純度均大于95%,購于 Dr.Ehrenstorfer公司。
磁性石墨烯Fe3O4-G(筆者所在實驗室自制[17]);甲酸、乙腈和甲醇(HPLC級,美國Thermo公司);實驗用水為Milli-Q(美國Millipore公司)超純水;其他試劑均為國產分析純試劑。
1.2 標準儲備液的配制
分別準確稱取10 mg上述標準物質,采用甲醇配制成濃度為100 mg/L的儲備液,置于-18℃冰箱保存,分別吸取100μL配制好的標準溶液于10 mL容量瓶中,采用甲醇定容,配制成1 mg/L混合標準溶液,臨用時稀釋成適當濃度的混合標準工作液。
1.3 磁性石墨烯/β-環糊精復合材料(Fe3O4-G/β-CD)的制備
Fe3O4-G/β-CD參照文獻[17]采用原位沉淀法制得。取磁性石墨烯Fe3O4-G 600 mg分散于150 mL水中,超聲1 h,加入2.5 mL濃氨水,室溫下攪拌10 min,加入4.8 gβ-環糊精,于60℃水浴中攪拌5 h。待溶液冷卻至室溫,用乙醇和水洗滌數次去除過量的β-環糊精,用磁鐵分離,60℃下真空干燥24 h后得到Fe3O4-G/β-CD。
1.4 樣品前處理
稱取2.0 g均質處理好的飼料樣品于50 mL聚乙烯離心管中,加入10 mL 80%乙腈-水溶液,渦旋混勻,超聲提取5 min后,4℃下以4 000 r/min離心3 min,取上清液于50 mL雞心瓶中。殘渣用10 mL 80%乙腈-水溶液重復提取1次,合并2次提取液,旋轉蒸發至干,用10 mL水復溶,轉移至15 mL離心管中。
稱取60 mg Fe3O4-G/β-CD加入到上述離心管中,40℃下超聲6 min,用磁鐵分離固液兩相。棄去上清液,加入3 mL乙腈,渦旋2 min,磁性分離后將上清液轉移至另一離心管中,重復解析1次,合并收集2次解析液,40℃下氮吹近干。用1.0 mL甲醇復溶,過0.22μm 有機相濾膜,供HPLC-MS/MS測定。
1.5 測定方法
1.5.1 色譜條件 色譜柱:ACQUITY UPLC HSS T3(2.1×100 mm,1.8μm);柱溫:40℃;流速:0.3 mL/min;進樣量:3μL;流動相:A相為0.1%甲酸水溶液,B相為0.1%甲酸甲醇溶液;梯度順序:0~1.0 min,7% B;1.0~3.0 min,7%~25% B;3.0~5.0 min,25%~95% B;5.0~7.0 min,95% B;7.0~8.0 min,95%~7% B。
1.5.2 質譜條件 電噴霧離子源(ESI):正離子模式;溫度:400℃,毛細管電壓:4 000 V;霧化氣流量:3.0 L/min;加熱氣流量:10.0 L/min;定性與定量離子對、碰撞能量等參數見表1。
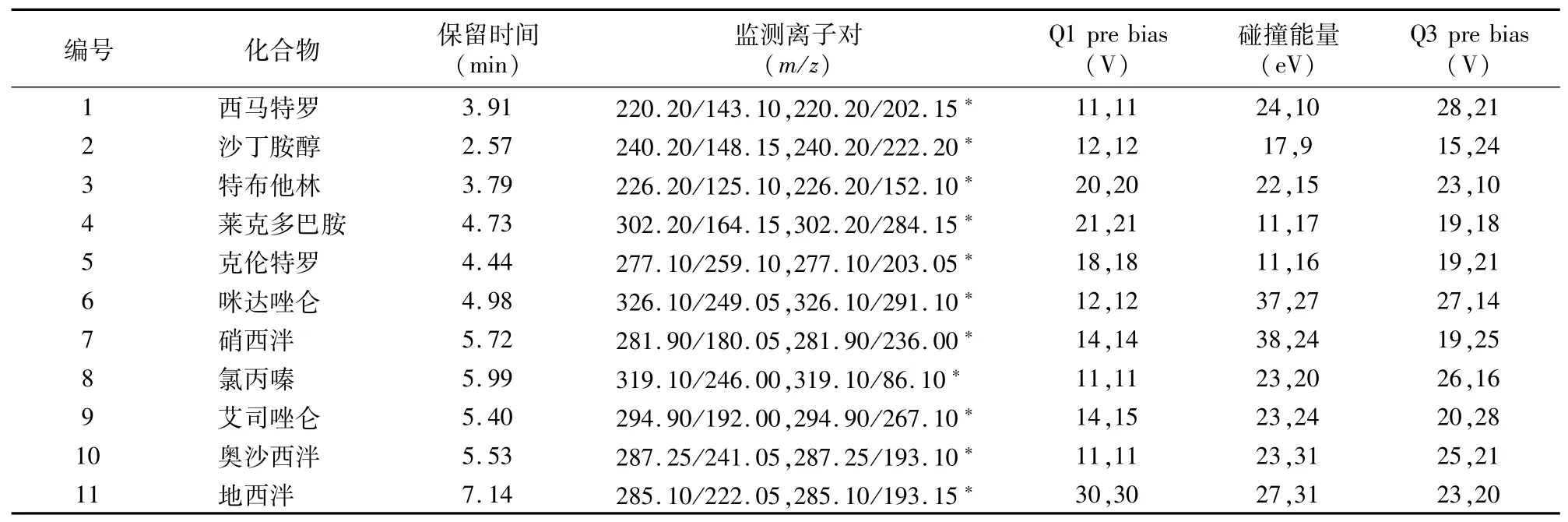
表1 11種待測物的質譜參數
2 結果與討論
2.1 色譜及質譜條件優化
根據待測物特點,本研究選用ESI正離子模式作為其離子化方式。分別配制質量濃度為200μg/L的標準溶液,采用一級質譜全掃描的方式獲得各待測物的準分子離子,再對其進行二級質譜分析,確定每個待測物的定量、定性離子對,最后在多反應監測模式下進一步優化各種質譜參數。所選擇的母離子、子離子和碰撞能量等參數見表1。
本研究考察了ACQUITY UPLC HSS T3(2.1×100 mm,1.8μm)、Ultimate UHPLC AQ-C18(2.1×100 mm,1.8μm)和Kinetex@2.6μm XB-C18(2.1×100 mm,2.6μm)3種不同類型的色譜柱對11種待測物的靈敏度和分離效果。結果表明,3種色譜柱的靈敏度均能滿足要求,但采用ACQUITY UPLC HSS T3柱時,待測物譜峰峰形較好,因此選用ACQUITY UPLC HSST3色譜柱。
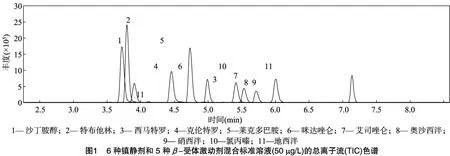
ESI電離是在溶液狀態下完成的,因此本研究進一步對流動相進行優化。文獻表明,使用甲醇或在水相中添加0.1% 甲酸均能使待測物獲得較好的分離度和響應強度[9-10]。本研究在此基礎上考察了在甲醇中加入0.1%甲酸對11種待測物分離及峰型的影響。結果表明,當甲醇中加入0.1%甲酸后,雖對待測物響應強度影響不大,但峰型和重復性有明顯改善。這可能是甲醇和水相中酸濃度相同,保證了在梯度洗脫過程中,2種流動相混合時,pH值恒定,容易平衡梯度。因此本研究選擇0.1%甲酸甲醇-0.1%甲酸水溶液作為流動相。11種化合物的總離子流色譜圖見圖1。
2.2 提取條件優化
文獻顯示,甲醇、乙酸乙酯和乙腈是獸藥提取的的常用試劑,由于飼料中蛋白質和脂類物質是主要的基質干擾物,所以選擇了有更好的蛋白沉淀作用的乙腈作為提取試劑。
飼料的水分含量較低,直接用有機溶劑提取效果不佳。為改善提取效果,在提取時加入一定量水用以分散樣品,增加有機試劑與樣品的接觸面積,從而提高提取效率。本研究進一步對體積分數為60%、70%、80%、90%的乙腈-水溶液和純乙腈5種提取試劑進行比較。結果表明,當提取溶劑中乙腈體積分數為80%時,提取效率最高,通過2次分步提取,11種待測物的回收率均大于85%。
2.3 萃取條件優化
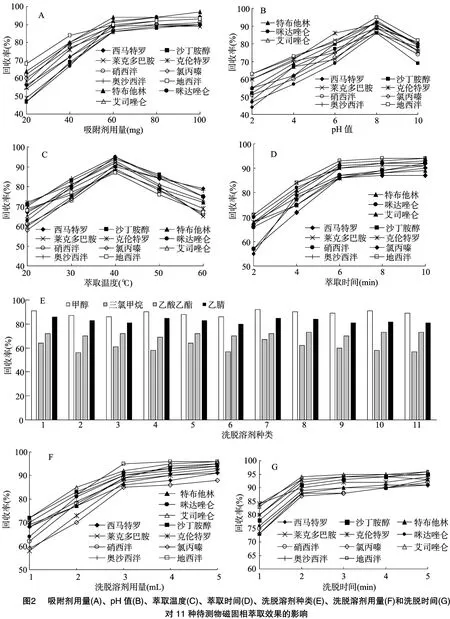
為得到11種待測物的最佳萃取條件,本研究分別考察了吸附劑用量、pH值、萃取溫度、萃取時間、洗脫溶劑的種類及用量、洗脫時間等因素對萃取效果的影響。
2.3.1 吸附劑用量 吸附劑的用量是影響萃取效率的重要因素,本研究分別對20、40、60、80、100 mg的Fe3O4-G/β-CD用量進行了考察,由圖2-A可知,當Fe3O4-G/β-CD用量為20~60 mg時,萃取效率隨Fe3O4-G/β-CD用量的增加而明顯提高;繼續增加用量萃取效率反而有降低趨勢,可能是過多的Fe3O4-G/β-CD導致待測物洗脫不完全,因此選擇吸附劑的用量為60 mg。
2.3.2 pH值 pH值是影響吸附劑和待測物物化性質的重要因素,本研究考察了pH值在2~10時對11種待測物的萃取效率的影響,由圖2-B可知,pH值在2~8時,萃取效率隨著pH值的增高而增大,這是由于11種待測物均為堿性化合物,酸度系數(pKa)>7,堿性條件下非離子狀態存在,易與吸附劑吸附。pH值繼續升高,回收率有所下降,產生這現象的原因可能是活性基團容易在強堿條件下電離,影響了待測物與吸附劑之間的相互作用,因此選擇pH值為8。
2.3.3 萃取溫度 溫度可以改變待測物從樣品擴散到吸附劑的傳質速率,選擇適當的溫度有利于待測物的萃取,考察了萃取溫度分別為20、30、40、50、60℃時的萃取效果,由圖2-C可知,萃取效率隨著溫度的升高而逐漸增加,在40℃時萃取效率達到最大;溫度繼續升高萃取效率反而有所下降,可能是隨著溫度升高待測物在吸附劑和樣品間分配系數降低的原因,因此最終選擇萃取溫度為40℃。
2.3.4 萃取時間 固相萃取本質是待測物在提取試劑與吸附劑之間達到一個分配平衡,萃取效率與萃取時間有著直接的關系。選擇適當的萃取時間不僅能提高萃取效果,還可以縮短萃取時間。本研究對萃取時間為2、4、6、8、10 min時的萃取效率進行比較,由圖2-D可知,隨著萃取時間的延長,萃取效率逐漸增大,當萃取時間達到6 min后萃取效率基本穩定,吸附已經飽和,達到萃取動態平衡。因此本研究選擇萃取時間為6 min。
2.3.5 洗脫溶劑的種類及體積 洗脫溶劑的種類是影響洗脫效率的重要因素,為了將待測物盡可能地從Fe3O4-G/β-CD中洗脫,本研究察了甲醇、乙腈、乙酸乙酯和三氯甲烷4種試劑的洗脫效果,由圖2-E可知,采用乙腈作為洗脫溶劑時對11種待測物的洗脫效率最好,因此選擇乙腈作為洗脫溶劑。進一步考察了洗脫溶劑用量1、2、3、4、5 mL對洗脫效率的影響,由圖2-F可知,當洗脫溶劑用量為3 mL時,11種待測物的回收率均大于85%,繼續增加洗脫溶劑用量,回收率無明顯變化,因此選擇3 mL乙腈作為洗脫溶劑。
2.3.6 洗脫時間 洗脫時間也是影響洗脫效率的一個重要因素,為更高效地將待測物從Fe3O4-G/β-CD中洗脫,考察洗脫時間1、2、3、4、5 min時的洗脫效果,由圖2-G可知,2 min就足以完全洗脫待測物。因此,選擇洗脫時間為2 min。
2.3.7 Fe3O4-G/β-CD的重復利用 為考察Fe3O4-G/β-CD的重復利用性能,每次試驗后,采用乙腈洗滌3次,60℃烘干,再重新按“1.5”節進行處理。結果顯示,當循環使用5次后,待測物的回收率仍在80%以上,說明Fe3O4-G/β-CD具有良好的穩定性和較高的重復利用率。
2.4 基質效應
基質效應在液相色譜-串聯質譜分析中普遍存在,是基質成分和待測物在電噴霧離子源進行離子化時相互競爭所致。為評價基質效應,分別配制基質匹配標準曲線(添加含量為1、5、10、20、50、100μg/L)及對應的純溶劑標準曲線。根據基質標準曲線與純溶劑標準曲線的斜率比值評價11種待測物的基質效應。若斜率在0.8~1.2之間,表明基質效應不明顯。結果表明,11種待測物斜率在0.833~0.905之間,說明本研究的前處理方法可以有效消除飼料中蛋白質和脂類物質等引起的基質效應。但為了獲得更加準確的定量結果,本研究仍采用基質匹配標準曲線以消除基質效應的影響。
2.5 線性范圍和定量限
配制6個水平的基質匹配混合標準溶液進行測定,以色譜峰面積為縱坐標(Y),相應的質量濃度(μg/L)為橫坐標(X)繪制標準曲線,得出11種待測物線性范圍、線性回歸方程和相關系數(表2)。同時,根據10倍信噪比(S/N)確定待測物方法定量限(LOQ),表明11種待測物的線性關系良好,定量限為μg/kg數量級。

表2 11種待測物的線性方程、回歸方程、相關系數和定量限
2.6 回收率與精密度
在空白配合飼料、濃縮飼料和預混飼料中分別添加5、10、25μg/kg 3個水平的混合標準溶液,按照“1.4”節和“1.5”節前處理方法及測定條件重復測定6次。由表3可知,11種待測物平均回收率為84.7%~96.8%,相對標準偏差為3.2%~10.8%,說明該方法具有較高的準確度和精密度。
與現行國家標準[18-19]和文獻[9-10]相比,本方法在保證靈敏度的前提下,操作更加簡便,同時將檢測周期縮短至1 h,更適合大批量樣品的檢測。
2.7 實際樣品分析
用本方法對日常送檢的配合飼料、濃縮飼料和預混飼料各10份進行分析,均無藥物殘留檢出。
3 結論
本研究以自制的β-環糊精磁性石墨烯納米材料為新型吸附劑,采用磁固相萃取技術,并結合HPLC-MS/MS建立了可同時測定飼料中6種鎮靜劑和5種β-受體激動劑的快速檢測方法。結果表明,該方法具有簡便、快速、準確度好、靈敏度高、經濟的特點,且有效克服了基質干擾的問題,可以滿足日常飼料樣品快速檢測的需求,為監管部門提供技術支撐。
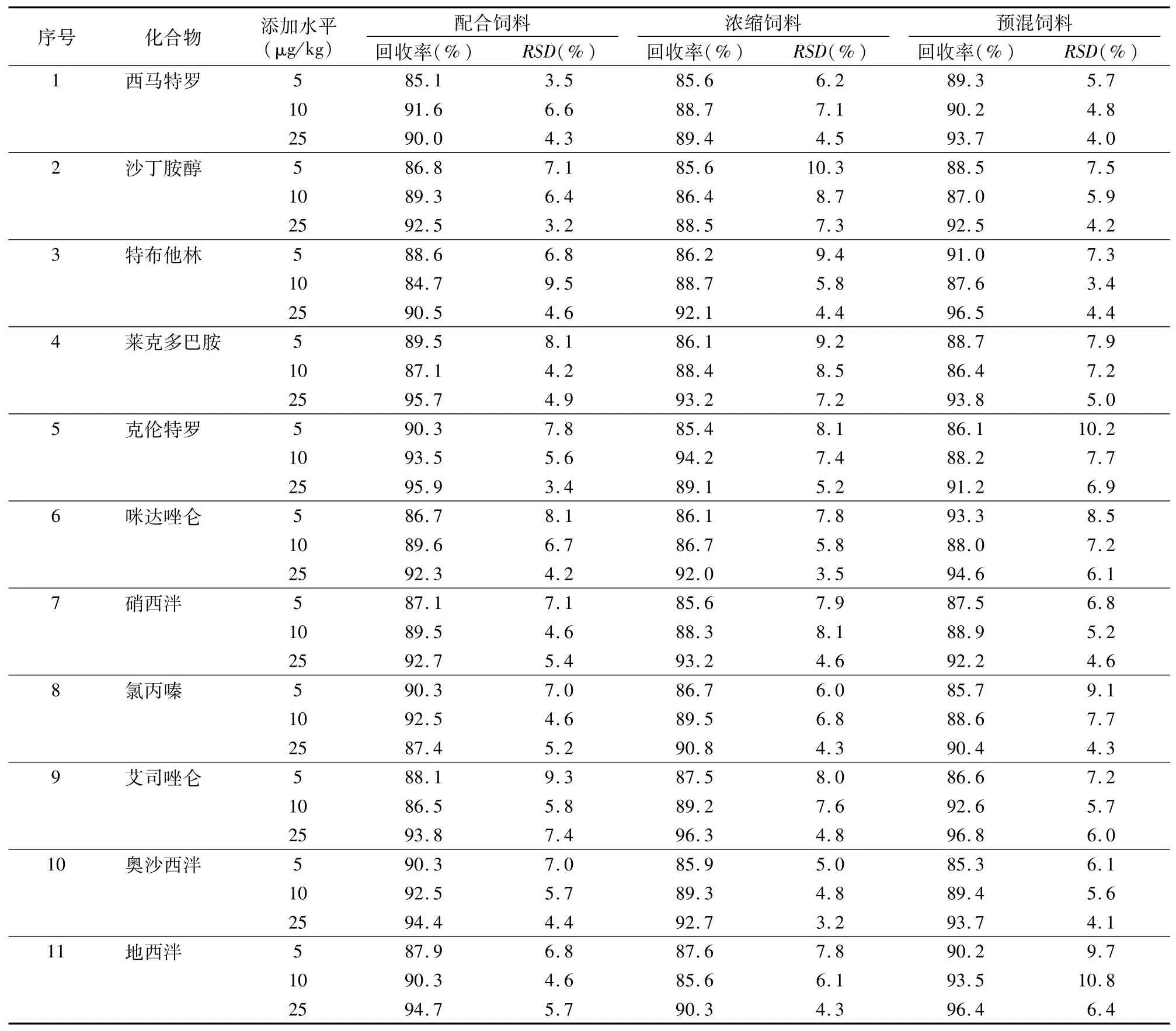
表3 空白樣品中11種待測物的回收率和相對標準偏差(n=6)

