β1受體阻滯劑對早期膿毒性休克病人心肌損傷及預后的影響
沈雯雯,徐前程,錢言,陳尚華
膿毒癥(sepsis)是由感染引起的失控性全身炎癥反應綜合征,可發展為膿毒性休克,最終導致多臟器官衰竭。膿毒癥病人心功能受到抑制,心臟收縮功能降低、順應性下降,對心臟造成一定程度損傷[1]。而β1受體阻滯劑用于膿毒性休克可以穩定循環,改善心肌損傷[2],但由于其對心臟的直接作用有時會導致或加重低血壓,使得應用受限。關于β1受體阻滯劑對膿毒性休克病人心肌損傷及預后的影響,目前國內外研究甚少,為此,筆者回顧性對比分析54例早期膿毒性休克病人β1受體阻滯劑治療后組織代謝指標變化以及影響預后的危險因素,為臨床提供一定參考。
1 資料與方法
1.1一般資料采用回顧性研究方法,收集2013年1月至2015年12月蕪湖市第二人民醫院重癥醫學科54例確診為膿毒性休克病人的臨床資料。
1.2納入標準和排除標準納入標準:(1)符合2016 年美國重癥監護醫學會(SCCM)“拯救膿毒運動:膿毒癥和膿毒性休克的管理國際指南”診斷標準[3];(2)年齡>18歲;(3)各項監測指標資料齊全;(4)治療組入科后48 h開始使用β1受體阻滯劑。排除標準:(1)入科后3 d內死亡或自動出院者;(2)入院前48 h使用過β1受體阻滯劑者;(3)腫瘤晚期及各種疾病的終末期,不可逆轉的臨終狀態。本研究符合《世界醫學協會赫爾辛基宣言》相關要求,征得病人或其近親屬同意并簽署知情同意書。
1.3研究方法以是否使用β1受體阻滯劑將所有病人分為治療組與對照組,再根據28 d的生存結局分為存活組和死亡組。病人均按照2012年嚴重膿毒癥與膿毒性休克治療國際指南給予規范治療,包括液體復蘇,血管活性藥物應用,抗菌藥物治療策略以及其他臟器支持治療,治療組在對照組基礎上加用鼻飼β1受體阻滯劑重酒石酸美托洛爾片12.5 mg,每日兩次。收集所有病人的一般資料,包括性別、年齡、感染部位、合并基礎疾病情況等,記錄入院24 h內急性生理和慢性健康評分(APACHEⅡ評分)和治療72 h后血流動力學指標變化、血清降鈣素原(PCT)、肌鈣蛋白I(CTnI)、血乳酸(Lac)水平,并觀察病人的轉歸情況。
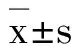
2 結果
2.1一般資料的比較治療組和對照組性別、年齡、APACHEⅡ評分及合并基礎疾病等一般資料比較,差異無統計學意義(P>0.05);治療組住ICU時間縮短,差異有統計學意義(P<0.05)。見表1。
2.2心肌標志物和循環指標的比較72 h后治療組心室率(HR)和CTnI水平低于對照組(P<0.05),兩組病人心指數(CI)、平均動脈壓(MAP)、血管活性藥物去甲腎上腺素(NE)的用量、72 h液體平衡量以及Lac水平差異無統計學意義(均P>0.05),見表2。
2.3不同預后組一般資料的比較死亡組APACHEⅡ評分、CTnI、Lac高于存活組(P<0.05);死亡組β1受體阻滯劑使用率低于存活組(P<0.05);兩組性別、年齡、PCT、PLT、MAP、PaO2(動脈血氧分壓)和基礎疾病等比較差異無統計學意義(P>0.05),見表3。
2.4膿毒癥病人預后影響因素的ROC及logistic回歸分析ROC分析知:APACHEⅡ評分最佳預測值為19.5分,曲線下面積0.92,靈敏度和特異度分別為0.91、0.84。以CTnI水平作預測病人預后的ROC曲線,CTnI水平最佳預測值為1.21 μg/L,曲線下面積0.79,靈敏度和特異度分別為0.84、0.77。以APACHEⅡ評分19.5分、CTnI水平1.21 μg/L作為分界點,logistic回歸顯示APACHEⅡ評分>19.5分、CTnI>1.21 μg/L是早期膿毒性休克病人死亡的危險因素,而β1受體阻滯劑是病人預后的保護性因素(P<0.05),見圖1、圖2、表4。

表1 膿毒性休克54例一般資料兩組比較
注:①肺部②腹腔③血流④軟組織⑤其它;“—”表示采用Fisher確切概率法

表2 膿毒性休克54例心肌標志物和循環指標的分組比較
注:HR為心室率,CI為心指數,MAP為平均動脈壓,NE為去甲腎上腺素,Lac為動脈血乳酸;1 mmHg=0.133 kPa

表3 膿毒性休克不同預后組一般資料的比較
注:PCT為血清降鈣素原,CTnI為肌鈣蛋白I,Lac為血乳酸,MAP為平均動脈壓,PaO2為動脈血氧分壓
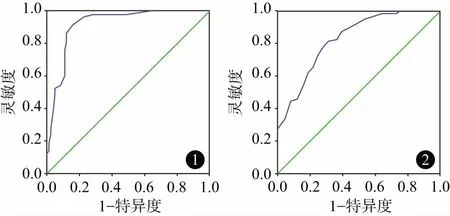
圖1 APACHEⅡ評分預測膿毒性休克病人預后的ROC曲線圖2 CTnI預測膿毒性休克病人預后的ROC曲線
3 討論
膿毒性休克內源性交感系統過度激活,造成交感風暴,β1腎上腺素增多可促進心肌收縮力和心率增加,從而增加心肌氧耗,導致心肌能量供需失衡,另外持續的β1腎上腺素增多亦可刺激白細胞介素-6、腫瘤壞死因子等炎性因子分泌增加,進一步加重心肌損傷[4]。近年來的研究發現β受體阻滯劑可以改善膿毒癥病人的心血管功能、免疫功能和凝血功能[5],但其負性肌力作用又使得應用受到限制。
越來越多的研究已證實β1受體阻滯劑在早期膿毒性休克病人中使用的安全性[5],目前的研究數據支持它的使用主要針對于經過液體復蘇和小劑量血管活性藥物可以穩定血流動力學的病人,在使用β1受體阻滯劑后不增加血管活性藥物的劑量[6]。本研究結果發現治療組住ICU時間縮短,但28 d病死率未下降,與 Galbois等[7]報道的一致。但最近Fuchs C等[6]研究表明長期口服β1受體阻滯劑的病人發生膿毒性休克后繼續服用該藥可以縮短住院時間,降低90 d以內的病死率。動物實驗中,Irada等[8]研究亦發現艾司洛爾可以通過調節CAMP和TNFSF10基因表達,從而抑制膿毒癥誘導的免疫反應,提高生存率。研究結論不一致的可能原因為臨床試驗混雜因素較多,如病人年齡、合并基礎疾病情況、感染部位、感染的病原體類型等均可能影響試驗結果,另外使用β1受體阻滯劑的類型、劑量以及干預時間點的不同也可對試驗結果造成影響。

表4 早期膿毒性休克病人預后影響因素的logistic回歸分析
本研究中,鼻飼美托洛爾顯著地降低了早期膿毒性休克病人的HR,而治療組和對照組病人的液體平衡量、血管活性藥物的使用劑量差異無統計學意義。Lac是體內糖代謝的中間產物,其升高程度及清除率反映膿毒癥病人病情嚴重程度的變化[9],兩組間Lac水平亦差異無統計學意義,提示β1受體阻滯可減少心臟做功、降低心肌耗氧量,且未引起病人血流動力學的惡化,對病人組織灌注無影響,有助于糾正組織氧供需的失衡。本研究還檢測了血CTnI水平,它是心肌細胞受損甚至壞死時血漿診斷標志物,與膿毒癥休克病人的預后密切相關[10]。王春源等[11]研究發現急診膿毒性休克以及老年嚴重膿毒癥病人CTnI水平愈高提示病人預后愈差。本研究中死亡組CTnI水平顯著高于存活組,治療組CTnI低于對照組。近期的meta分析亦顯示,β1受體阻滯可以降低膿毒性休克病人的心率、CTnI水平,但對血流動力學參數影響不大[12],基本支持本研究以上的結論。
本研究還對早期膿毒性休克病人預后影響因素進行logistic回歸分析,顯示APACHEⅡ評分>19.5分、CTnI>1.21 μg/L是影響病人預后的危險因素,而使用β1受體阻滯劑可以改善此類病人預后。推測β1受體阻滯劑改善心功能和預后的可能機制有以下幾點:一方面β1受體阻滯劑上調了心肌 β1受體含量,改變β腎上腺素能受體各亞型的比例,減輕心肌線粒體的損傷,改善心肌的能量代謝,提高心功能[13];另一方面阻斷β1受體將通過下調細胞因子的表達下調炎癥反應[14];此外,膿毒性休克病人感染誘發的高腎上腺素狀態導致機體的代謝由平衡向分解代謝的方向移動,如高血糖、高乳酸血癥及蛋白分解增加,而β1受體阻滯劑在一定程度上可減少底物耗竭[5],這可能為我們后續進一步研究指明方向。
綜上所述,本研究結果表明β1受體阻滯劑組總體上可以改善早期膿毒性休克病人的心肌損傷,縮短住ICU時間,但由于本研究樣本量較小,為回顧性研究,具有局限性,且對于使用的時機、劑量、心率控制范圍和對病人的長期預后仍需更大規模的前瞻性臨床研究。

