基于PC12細胞電化學傳感器檢測苯并(a)芘的研究
,, , ,,,*
(1.揚州大學,食品科學與工程學院,江蘇揚州 225127;2.南京財經大學,食品科學與工程學院,江蘇南京 210023)
多環芳烴(PAHs)是一類具有稠合芳香環的化合物,為重要的大氣污染物[1]。大量研究表明,肺癌、哮喘、支氣管炎和心臟病發病率的增加都與PAHs的暴露有關[2-3]。苯并(a)芘(Benzo(a)pyrene,BaP)為具有五個結構環的PAH化合物,已經被證明為一種致癌物質,表現出很強的致癌活性[4-6]。BaP經細胞色素P450(CYP)代謝活化生成的BaP-7,8-dio-9,10-環氧化物(BPDE)與DNA形成加合物,引起G→T顛換突變為主的基因突變,從而誘發癌癥[7-8]。由于BaP對人體健康的威脅,對BaP進行真實有效地檢測具有重要意義[9]。
細胞電化學傳感技術利用活細胞作為識別元件,將生物信號轉化為容易識別和記錄的電信號,能夠從細胞水平上,對潛在有害物及其毒性進行準確、快速、高效的安全性評價[10-11]。細胞電化學傳感技術還能從分子水平更好地識別多環芳烴類有害產物,實現對苯并(a)芘真實有效的測定。此外,活細胞構建的生物傳感器,能根據細胞在形態和生理上的特殊變化,提供比光譜和色譜方法更多的綜合信息。電化學阻抗譜(EIS)測量具有操作簡便、響應時間短和靈敏度高等優點,近幾年引起了研究人員的關注[12-14]。雖然已有電化學傳感器技術檢測苯并(a)芘的相關研究,但是利用活細胞作為識別原件,以細胞電化學傳感器技術檢測苯并(a)芘的研究仍處于空白階段。
本文利用親生物性的海藻酸鈉凝膠和聚電解質膜(PEM)包裹活細胞作為識別BaP的特殊原件。采用10 μL不同濃度的BaP刺激細胞,通過不同濃度的BaP造成細胞不同程度的損傷,導致電化學信號發生變化。以電化學阻抗譜(EIS),差分脈沖伏安法(DPV)和循環伏安法(CV)檢測電化學信號的變化,以期建立一種基于PC-12細胞電化學傳感器分析檢測BaP的新方法。
1 材料與方法
1.1 材料與儀器
大鼠腎上腺嗜鉻細胞瘤(PC-12)細胞 中科院上海細胞庫;苯并(a)芘 上海阿拉丁生化技術有限公司;RPMI 1640培養基和胎牛血清 美國Gibco公司;殼聚糖、海藻酸鈉 美國Sigma-Aldrich公司;Annexin V-FITC細胞流式凋亡試劑盒:Binding Buffer、Annexin V-FITC、PI Staining Solution 森貝伽生物科技有限公司;胰酶消化液、PBS(pH7.4) 碧云天生物技術有限公司。
Tecnai 12透射電鏡 荷蘭Philips公司;FACSAria IIU流式細胞儀、LIFE Countess全自動細胞計數儀 美國BD公司;S-4800場發射掃描電鏡 日本日立公司;二氧化碳恒溫培養箱 美國Thermo Fisher公司;CHI660e電化學工作站 上海辰華儀器有限公司。
1.2 實驗方法
1.2.1 海藻酸鈉凝膠、聚電解質薄膜的制備 將海藻酸鈉溶解在RPMI 1640培養基中獲得1%(w/v)海藻酸鈉(SA)凝膠后,取0.25 g殼聚糖(CS)溶解于0.5%(v/v)的乙酸,超聲處理4 h獲得殼聚糖溶液。將10 μL海藻酸鈉滴在殼聚糖溶液中反應5 min以制備聚電解質薄膜[15-16]。反應完成后,用超純水清洗后備用。
1.2.2 細胞的常規培養和計數 用PBS(pH7.4)清洗含有細胞的培養瓶,緩慢加入3 mL的胰酶消化液,37 ℃下靜置3 min,加入適量完全培養液終止消化過程。用1 mL移液槍均勻吹打內壁上的細胞后,轉移到滅菌的離心管中,1000 r/min離心5 min,離心結束后棄去上清液,向下層沉淀中加入1 mL完全培養液,用槍輕輕吹打均勻。取1 mL處于對數生長期的細胞用PBS洗滌后重懸,每次計數前用槍吸取200 μL細胞懸液于玻片中,將玻片置于LIFE Countess全自動細胞計數儀中,運行Countess II軟件可自動獲得細胞濃度。
1.2.3 細胞傳感器的構建 取10 μL細胞與制備好的1%(w/v)海藻酸鈉溶液混合均勻,將制備好的海藻酸鈉細胞凝膠按照1.2.1的方法制備聚電解質薄膜。之后,將制備好的細胞凝膠和聚電解質薄膜覆蓋于裸金電極(GE)表面,浸入含有100 mmol/L CaCl2的1640培養基中,并在37 ℃具有5% CO2的培養箱中放置5 min以實現細胞固定。將固定后的細胞凝膠與電極形成的角手架連接至工作線路插口,將鉑絲電極連接至對電極線路插口,并將飽和甘汞電極連接至參比電極的插口。最后打開電化學工作站的開關即可。
1.2.4 BaP對PC-12細胞損傷作用的研究
1.2.4.1 掃描電鏡 用50 μmol/L BaP刺激PC-12神經細胞,將刺激后的細胞與制備好的凝膠混合,形成混合均勻的細胞凝膠。吸取1 mL的細胞凝膠到2.5%的戊二醛中,在4 ℃冰箱中固定4 h以上。用50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇對細胞凝膠依次梯度脫水。最后,使用含有無水硫酸鈉的乙醇再次進行脫水。輕輕撕開脫水后的凝膠,將撕開后的樣品放入CO2干燥器臨界點35 ℃下干燥1 h。干燥后的樣品進行噴金鍍膜即可使用掃描電鏡觀察。
1.2.4.2 透射電鏡 用50 μmol/L BaP刺激PC-12神經細胞,然后1000 r/min離心5 min,瓊脂包裹。用戊二醛(2.5%)在4 ℃冰箱中固定4 h后,用PBS(pH=7.4)清洗3~4次,接著加入1%鋨酸固定。繼續使用PBS清洗3次,依次加入不同濃度的乙醇脫水,在加入100%丙酮、含有無水硫酸鈉的100%丙酮梯度脫水,以上每個脫水步驟最少15 min。用丙酮∶樹脂=1∶1的混合液滲透1 h后,再用丙酮∶樹脂=1∶2的混合液滲透2 h,接著用樹脂滲透2 h并進行包埋和聚合。對處理好的樣品進行切片,用醋酸雙氧鈾和枸櫞酸鉛分別對超薄切片進行染色。將染色后的切片放在金網中,用Tecnai 12透射電鏡對細胞的內部結構進行觀察。
1.2.4.3 流式細胞檢測 50 μmol/L BaP刺激細胞后,用預冷的PBS重懸洗滌細胞2~3次,1000 r/min離心5 min,棄去上清液。加入100 μL 1×Binding Buffer重懸細胞,隨后分別加入5 μL Annexin V-FITC和10 μL PI Staining Solution,用移液槍輕輕吹打混勻后,室溫避光下反應15 min。再加入400 μL 1×Binding Buffer,冰浴30 min后使用流式細胞儀進行檢測。數據由NovoExpress軟件捕獲以供分析。
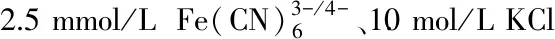
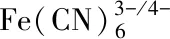
1.3 數據處理

2 結果與分析
2.1 細胞傳感器的構建
使用電化學阻抗譜(EIS),差分脈沖伏安法(DPV)和循環伏安法(CV)來測試細胞傳感器的特征。三種方法檢測出現的信號和圖譜都非常穩定,說明本傳感器已構建成功。圖1(A)循環伏安圖中可逆氧化還原峰在裸露電極表面清晰可見(曲線“a”)。海藻酸鈉水凝膠用于表征,電流顯著下降(曲線“b”)。PEM良好的電導率導致電解質之間電子轉移的加速,其氧化還原峰電流增加(曲線“c”)。最后,當電極被PC-12神經細胞表征時,工作電極的電子轉移速率被阻斷,氧化還原電流迅速下降(曲線“d”)。圖1(B)中的DPV曲線顯示了相同的趨勢。使用CHI660e電化學工作站依次將圖1(C)EIS圖譜中的數據導入,經過如圖1(C)右下方所示的擬合電路電化學工作站可自動擬合得到等效阻抗Ret。裸電極時,阻抗約為256 Ω(曲線“a”)。當使用海藻酸鈉水凝膠時,Ret值增加到2071 Ω(曲線“b”),而當PEM被表征后,奈奎斯特圖半徑顯著降低,其等效阻抗也對應降低,接近959.3 Ω(曲線“c”)。細胞被表征后,Ret值增加到4006 Ω(曲線“d”)。

圖1 不同修飾狀態下的循環伏安圖(A)、差分脈沖伏安圖(B)、奈奎斯特圖(C)、不同細胞濃度修飾下阻抗圖(D)Fig.1 Cyclic voltammograms(A),differential pulse voltammetry(B),Nyquist diagrams ofdifferent modified electrodes(C)and impedance curves(D)for different cell concentrations注:a.裸GE;b. SA/GE;c. CS/SA/GE;d. CS/SA/cells/GE。
細胞濃度影響傳感器的靈敏度,選擇合適的細胞濃度進行實驗非常重要。如圖1(D)所示,阻抗的增加值與細胞的濃度密切相關,這在一定范圍內是線性的。該實驗得出結論,細胞濃度從5×101~ 5×107個細胞/mL具有線性關系,相關系數為0.987。當細胞數量超過5×107個細胞/mL時,阻抗的大小變化不明顯(未顯示),說明即使細胞濃度增加,對傳感器的影響也并不明顯。分析認為,細胞數低于5×107個細胞/mL適合本實驗。
2.2 BaP對PC-12細胞損傷作用的研究
正常的PC-12神經細胞放大10000倍的掃描電鏡圖如圖2A所示,細胞的表面形態結構完好,外周神經突和細胞膜沒有破損。然而,如圖2B所示,經過BaP處理的PC-12神經細胞的細胞膜明顯受到破壞,原有的神經突也受到不同程度的損傷。圖2C為放大16000倍的正常組PC-12神經細胞的透射電鏡圖,細胞內部結構完整,細胞核完好。經BaP處理后的細胞如圖2D所示,細胞核嚴重受損。以上結果證明了BaP對PC-12神經細胞有誘導損傷和壞死的作用,是進行電化學實驗的基礎。
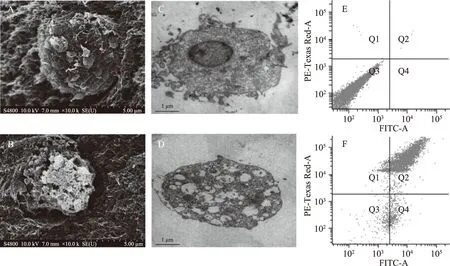
圖2 BaP對PC-12神經細胞形態的影響與細胞流式檢測情況Fig.2 Effects of BaP on the morphology of PC-12 nerve cells and cell flow assays注:A、C、E為正常PC-12細胞;B、D、F為BaP處理后的PC-12細胞。圖中Q1區(FITC+/PI+)是壞死細胞;Q3區(FITC-/PI-)顯示的是活細胞;Q2、Q4區(FITC+/PI-)顯示的是凋亡細胞。
為了估計BaP的細胞毒性相互作用并構建電化學檢測的方法,將BaP處理后的細胞用于流式測定。實驗結果顯示,正常細胞凋亡率為0.15%,壞死率0.09%,而經過BaP處理后的細胞凋亡率高達80.80%,壞死率達4.91%。表明BaP能夠誘導PC-12細胞的凋亡。
2.3 細胞傳感器測定BaP的標準曲線
如圖3B所示,BaP一定濃度下以劑量依賴性方式誘導細胞損傷。用濃度為1~5 μmol/L的BaP處理后,EIS阻抗急劇下降,表明阻抗變化與BaP濃度相關。隨著BaP濃度增加至10 μmol/L,準線性行為消失。隨著BaP濃度的進一步增加,電化學信號變化不明顯。可能是由于較高的BaP濃度誘導細胞溶解,耗盡細胞并導致Ret值的穩定。最終形成了一個準線性關系(y=-418.660x+4234.706,r=0.994)。根據公式LOD=3s/m,其中s表示空白樣品的標準偏差(n=3),m表示BaP的相對校準曲線的斜率,BaP的檢測限為0.21 μmol/L。

圖3 不同濃度的BaP下的奈奎斯特圖(A)與對應的阻抗圖(B)Fig.3 Nyquist diagrams(A)and electrochemical impedance(B)for different concentrations of BaP注:a~j分別為0、1、2、3、4、5、10、15、20、50 μmol/L。
2.4 細胞傳感器的穩定性和重現性
在不同的時間點檢測DPV電流峰值。如圖4,在36 h內,沒有BaP刺激細胞傳感器的峰值幾乎保持穩定,這表明該方法具有良好的穩定性。電流峰值的增加可能是由于48 h后PBS中的營養不足造成的。此外,表1可知,平均回收率為97.88%~99.02%,方差系數為1.46%~2.31%。這些值符合實驗分析所需的準確度,表明制造方案易于重現,具有良好的檢測性能。

表1 檢測的加標樣品的回收率和再現性(CV)Table 1 Recoveries and reproducibility(coefficients of variation)of the spiked samples
圖4 不同時間時細胞傳感器的差分脈沖伏安圖(A)和對應的電流峰值(B)Fig.4 Differential pulse voltammetry(A)and peak currents(B)of the cell sensor at different time
3 結論
本研究開發了一種簡單、廉價的基于PC-12神經細胞的電化學生物傳感器,其將活細胞固定在電極上以監測電子轉移的變化。海藻酸鈉凝膠為細胞提供了穩定的環境,聚電解質薄膜增強了導電性。結果表明,隨著BaP濃度的增加,在一定濃度范圍內,Ret值不斷下降。具體而言,電化學阻抗的值在1~5 μmol/L的濃度范圍內不斷下降,線性方程為:y=-418.660x+4234.706,r=0.994,檢測限為0.21 μmol/L。平均回收率為97.88%~99.02%,檢測結果的RSD低于5%,表明該傳感器具有良好的重現性和穩定性。本研究為BaP的研究提供了一種新的思路。

