表面脫乙酰化甲殼素顆粒固定溶菌酶及酶學性質研究
,,,,,,
(青島科技大學化工學院,山東青島 266042)
溶菌酶可催化降解細菌細胞壁中肽聚糖的β-1,4-糖苷鍵以發揮抗菌作用[1],它廣泛存在于細菌、真菌、植物、鳥類和哺乳動物中,是脊椎動物體內重要的免疫因子。溶菌酶被廣泛用于食品防腐保鮮[2-3]、疾病(白血病、腎病、腦膜炎、腫瘤等)的臨床診斷[4-7]、眼部和口腔等的抗菌藥物[8]以及抗腫瘤藥物等[9-10]。
然而,游離溶菌酶的穩定性較差,且分離純化成本高,使其應用受到極大限制,而將溶菌酶固定化則可部分解決上述問題。溶菌酶的固定化方法一般包括物理法和化學法。物理法盡管也可獲得較好的固定化效果[11-12],但穩定性普遍較化學法低。化學法以共價法為主,如將溶菌酶共價固定于羊毛載體[13]、介孔硅[14]、殼聚糖[15]、氧化石墨烯[16]、AB-8大孔樹脂[17]、聚四氟乙烯膜[18]、尼龍66[19]、纖維素膜[20]等。
殼聚糖是甲殼素部分脫乙酰的衍生物,具有生物相容性、低毒性和抗菌活性[21-22],其分子中的游離氨基可通過雙功能試劑戊二醛與溶菌酶發生偶聯。但殼聚糖溶于酸性溶液[23],不利于溶菌酶(最適pH為酸性)的固定化,因此,本文將甲殼素顆粒進行表面脫乙酰,得到具有一定機械強度的不溶性固定化載體,并將溶菌酶固定于表面脫乙酰化的甲殼素顆粒上,與載體一起共同構成環境友好型抗菌材料,旨在用于食品包裝、清潔用品、創口輔料等中,以延長其保藏期。
1 材料與方法
1.1 材料與儀器
甲殼素(來源于雪蟹) 山東萊州市海力生物制品有限公司;溶菌酶(E.C.3.2.1.17,來源于蛋清,活力153000 U/mg) Sigma-Aldrich(L2879)公司;3-甲基-2-苯丙噻唑啉酮腙(MBTH) Sigma-Aldrich公司;二硫蘇糖醇(DTT)、半脫乙酰殼聚糖(脫乙酰度為49.8%,1H-NMR) 實驗室自制[24];其它試劑均為分析純 國藥集團化學試劑有限公司。
SHZ-82水浴恒溫振蕩器 常州國華電器有限公司;FE 20數字酸度計 梅特勒-托利多儀器有限公司;UNICO 2100紫外-可見光分光光度計 尤尼柯(上海)儀器有限公司;移液器 賽默飛世爾(上海)儀器有限公司。
1.2 底物溶液的配制與固定化方法
1.2.1 底物溶液的配制 以2 mg/mL的半脫乙酰度殼聚糖底物溶液為例,稱取200 mg半脫乙酰度殼聚糖于燒杯中,用0.2 mol/L、pH為4.5的HAc-NaAc緩沖溶液充分溶解,調節pH至4.5,用容量瓶定容至100 mL,轉移至試劑瓶中于4 ℃儲藏備用。
1.2.2 固定化方法
1.2.2.1 甲殼素載體的活化 將甲殼素顆粒(20~40目)按1∶20 (w/v)的比例置于20% NaOH中,于90 ℃水浴分別加熱一定時間后,立即用流水冷卻至室溫,抽濾,用蒸餾水反復洗滌以脫除NaOH,抽干后,將其浸泡在0.2 mol/L的乙酸溶液中過夜,然后用蒸餾水洗至中性,抽干,按照1∶20 (g/mL)的比例浸入一定濃度、一定pH的戊二醛溶液中,于25 ℃恒溫水浴中反應3 h,而后置于冰箱中14 h,用水反復洗滌以除去殘留戊二醛,抽干備用。
1.2.2.2 酶偶聯 將已活化的載體按1∶20 (g/mL)浸入溶菌酶溶液中,于4 ℃過夜,過濾(取濾液測定殘留蛋白濃度),用緩沖液洗滌固定化酶,直至濾液中蛋白濃度為0。
1.2.2.3 固定化條件的正交試驗設計 根據本實驗前期的研究結果[24-25],分別以脫乙酰時間(A)、戊二醛濃度(B)、載體活化pH(C)為三因素,根據表1的水平設置,按照1.5.1和1.5.2的方法進行溶菌酶的固定化,以蛋白利用率、活力回收率、保藏穩定性經過歸一化處理后計算得到的綜合評分Y′作為考察指標進行正交試驗,以優化載體活化條件。給酶量為0.5 mg/mL,酶液pH為4.5。
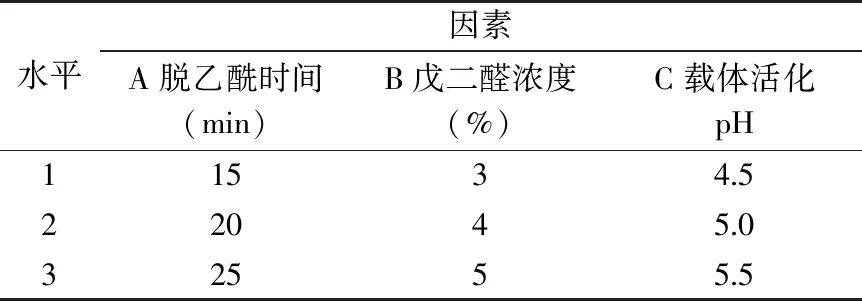
表1 載體活化正交試驗因素水平表Table 1 Factors and levels used in orthogonal test for activation of carrier
1.3 蛋白濃度的測定與蛋白利用率的計算
1.3.1 蛋白濃度的測定 按照Folin酚法[26]配制Folin甲和Folin乙,取1 mL蛋白溶液與5 mL Folin甲充分混勻,于25 ℃下反應10 min,再加入0.5 mL Folin乙,立即混勻,于25 ℃反應30 min后,測定750 nm處吸光度值。
1.3.2 標準曲線的繪制 首先配制250 μg/mL牛血清白蛋白溶液,繼而將其稀釋并配成0、25、50、100、150、200、250 μg/mL蛋白溶液,根據1.3.1的方法測定蛋白質濃度,以蛋白質濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。
1.3.3 蛋白利用率的計算 蛋白利用率是指固定化過程中結合蛋白質的量占總給酶蛋白的百分比。
蛋白利用率(%)=(酶液中酶蛋白初始總質量-固定化后殘液中酶蛋白質量)/酶液中酶蛋白初始總質量×100
式(1)
1.4 酶活力的測定方法
1.4.1 N-乙酰氨基葡萄糖濃度的測定及標準曲線的繪制 參照文獻[27]的方法,稍加修改。取2 mL葡萄糖溶液于試管中,加入2 mL,0.5 mol/L NaOH的溶液,充分混勻后,取三個1.2 mL作三個平行樣,分別加MBTH試劑600 μL,混勻,于80 ℃水浴加熱,趁熱加入1.2 mL的硫酸鐵銨試劑,充分混勻,冷卻至室溫于620 nm測吸光度值。
首先配制19.25 mg/mL N-乙酰氨基葡萄糖溶液,繼而將其配制成0、12.43、24.86、37.30、49.73、62.16、74.59、87.03 μmol/L 8個稀釋梯度的N-乙酰氨基葡萄糖溶液,根據上述方法測定吸光度值,作濃度-吸光度值標準曲線。
1.4.2 游離溶菌酶活力的測定 根據文獻的方法[28]稍加修改。將預熱至35 ℃的9.9 mL的底物溶液與0.1 mL,0.5 mg/mL(以0.2 mol/L的HAc-NaAc溶解)的溶菌酶溶液混合,置于35 ℃水浴搖床中酶解30 min后,從中取2 mL酶解液迅速加入到2 mL 0.5 mol/L NaOH溶液中以終止酶解反應,按照1.4.1的方法測還原糖濃度。以9.9 mL殼聚糖溶液和0.1 mL,0.2 mol/L的HAc-NaAc溶液為空白對照。
溶菌酶活力單位被定義為在上述條件下,每分種內轉化成1 μmol/mL相當于N-乙酰氨基葡萄糖的量為1個酶活力單位。
1.4.3 固定化溶菌酶活力的測定 在錐形瓶中,按照1 g固定化酶/20 mL底物溶液的比例加入已預熱至35 ℃的底物溶液,置于35 ℃的水浴搖床中酶解30 min,從中取上清液2 mL迅速加入到2 mL 0.5 mol/L NaOH溶液中,充分混勻,按照1.4.1的方法測定還原糖濃度。以底物溶液代替酶解液重復如上操作作為酶解空白。
1.4.4 活力回收率計算 活力回收率是指固定化酶的活力所占給酶總活力的百分比。

式(2)
1.4.5 保藏穩定性計算 保藏穩定性是指固定化酶在保存15 d后所占初始固定化酶活力的百分比。

式(3)
1.5 綜合評分的計算
為使正交試驗結果的各指標處于同一數量級,消除各指標量綱,以便綜合評分,需首先分別進行歸一化處理[29]。設同一指標中,最大值為Ymax,對應100分;最小值為Ymin,對應0分,則相應的指標值:
式(4)
1.6 固定化對溶菌酶性質的影響
1.6.1 固定化對溶菌酶最適pH的影響 參照1.4.3的方法,分別測定固定化酶在pH為3、3.5、4.0、4.5、5.0、5.5、6.0、6.5條件下的酶活力;參照1.4.2的方法,分別測定游離溶菌酶在pH為3.5、4、4.5、5四個條件下的酶活力。以相對酶活力為指標對比固定化前后最適pH的改變。
1.6.2 固定化對溶菌酶最適溫度的影響 參照1.4.3的方法,分別測定固定化酶在溫度為35、45、55、65、70、75、80、85、90條件下的酶活力;參照1.4.2的方法,分別測定游離溶菌酶在溫度為55、60、65、70、75、80、90條件下的酶活力。以相對酶活力為指標對比固定化前后最適溫度的改變。
1.6.3 固定化對溶菌酶Km值的影響 根據1.6.1和1.6.2的實驗數據,以及Lineweaver-Burk[30]的原理,作1/v-1/s圖,通過線性回歸計算并求得Km值。
1.6.4 相對酶活力計算 相對酶活力值是指設最大酶活力為100%,求其他酶活力值相對于最大酶活力值的相對比值。

式(5)
1.7 數據處理
用Excel 2016和SPSS 16.0進行數據處理和方差分析。
2 結果與分析
2.1 標準曲線的繪制
評價酶固定化效率的高低包括蛋白利用率、酶活力回收率及固定化酶的穩定性,其中涉及蛋白濃度的測定和溶菌酶活力的測定,分別采用Folin酚法和MBTH法。盡管Folin酚法比紫外法操作繁瑣,但可避開雜質對測定的干擾,其用于蛋白濃度測定的標準曲線如圖1所示,其在0~0.25 mg/mL線性范圍內的標準曲線為y=2.316x+0.0276,R2=0.9912。在酶活力測定方面,與常用的溶壁微球菌法相比,MBTH法采用在堿性條件下可溶的半脫乙酰殼聚糖為底物,以MBTH試劑取代常用的DNS試劑,使方法更靈敏、更準確、更便捷,其用于酶活力計算的標準曲線如圖2所示,其在0~87.03 μmol/L線性范圍內的標準曲線為y=0.0101x+0.0095,R2=0.9992。

圖1 牛血清白蛋白標準曲線Fig.1 Bovine serum albumin standard curve
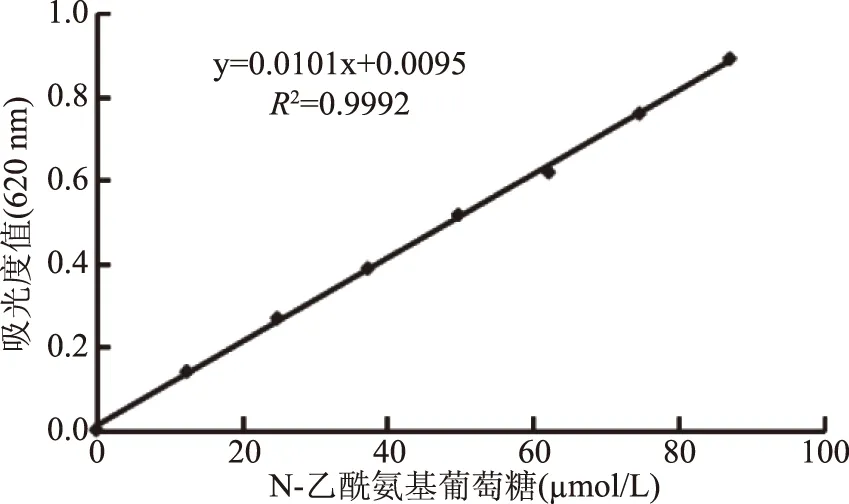
圖2 N-乙酰氨基葡萄糖標準曲線Fig.2 N-acetylglucosamine standard curve
2.2 載體活化條件優化
用于酶固定化的載體必須具有良好的機械性能、生物相容性和含有一定反應性的官能團。來源于蟹殼的甲殼素基本具備上述三個條件,但由于甲殼素結構中,乙酰基含量較高,其脫乙酰度,即氨基含量,基本在20%以下,不利于戊二醛與其偶聯而形成希夫堿,而將甲殼素顆粒脫乙酰化則可解決上述問題。
正交實驗結果見表2,由R值可得,三個因子對指標值的影響次序為A>B>C;由k值可得,最優組合為A3B3C2,恰為正交實驗中的第9組。方差分析見表3,脫乙酰時間影響顯著(p<0.05),而戊二醛濃度和載體活化pH影響不顯著(p>0.05),這與正交試驗的分析結果一致。從9號試驗組得知,溶菌酶固定化的直觀最優條件分別為:脫乙酰時間(A)為25 min,戊二醛濃度(B)為5%,載體活化pH(C)為5.0,在此條件下測得的蛋白利用率為28.7%,活力回收率為91.0%,保藏穩定性為66.0%。由此看來,在固定化實驗中,給酶量(0.5 mg/mL)和酶液pH(4.5)的設定均合理。
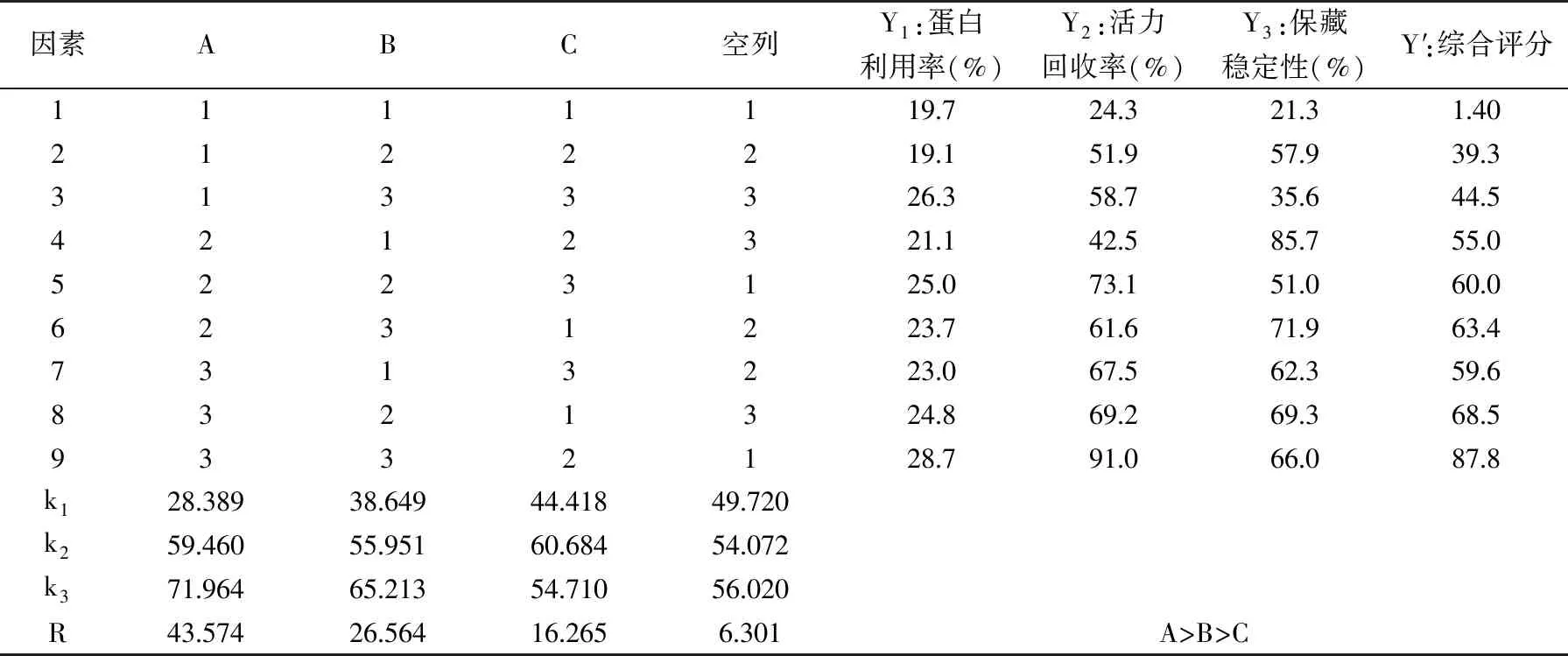
表2 L9(34)正交試驗結果Table 2 L9(34)orthogonal test results
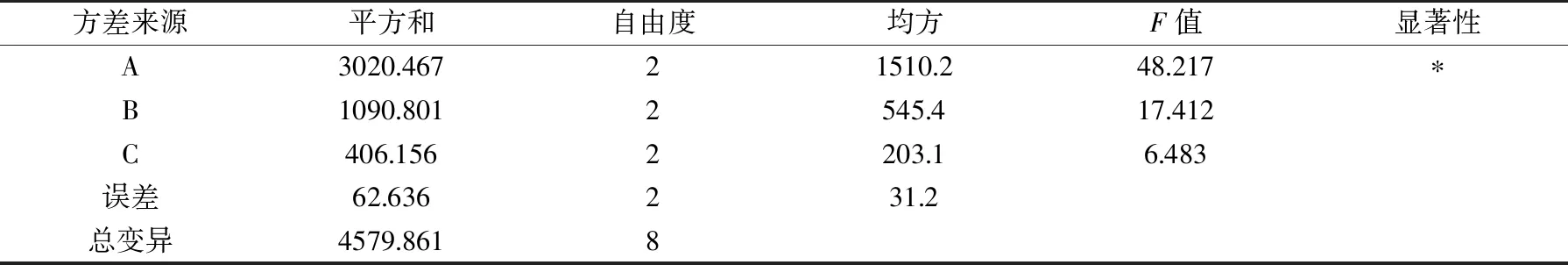
表3 正交試驗方差分析表Table 3 Analysis of variance of overall index score
2.3 固定化對溶菌酶活力的影響
溶菌酶經過固定化后其最適的酶解pH和溫度都有可能會發生偏移[31],根據其酶學性質的變化可推測溶菌酶與載體的結合方式及其對酶活性中心的影響。
2.3.1 固定化對溶菌酶最適pH的影響 結果如圖3所示,游離溶菌酶的最適pH為4,稍有偏離,其活力即明顯下降;而固定化后,盡管溶菌酶的最適pH為3.5,向酸性偏移了0.5個單位,但是,它在較寬的pH范圍內仍能體現酶活力。這是因為殼聚糖為陽離子載體,在將溶菌酶固定化后會使酶微環境的pH增大,只有降低外圍環境的pH抵消這一影響,才能使酶反應的微環境達到最適的pH。此現象與其它以殼聚糖為載體的酶固定化結果相一致[32]。Jiang等[33]將溶菌酶物理吸附于幾丁質晶須,并考察了其抗菌活性,該文采用的固定化溶菌酶的活力測定方法為溶壁微球菌法,文中并無相關酶學性質研究,而本文以半脫乙酰殼聚糖為底物研究固定化溶菌酶的酶學性質尚屬首例。
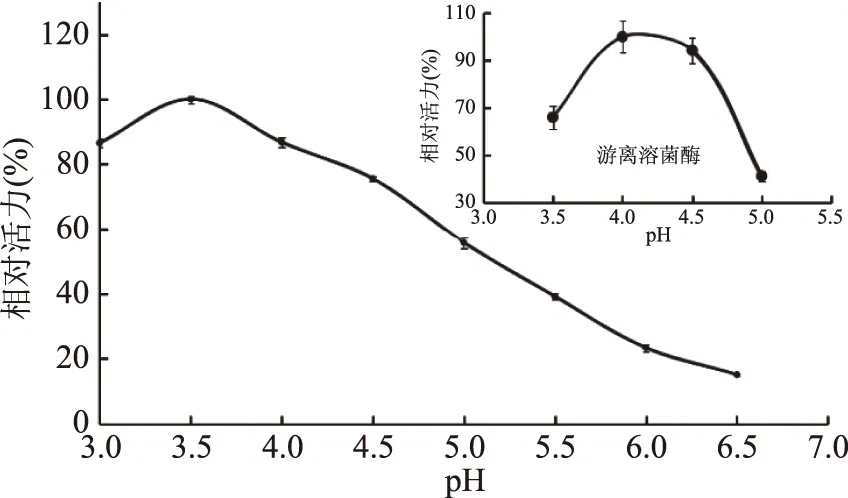
圖3 固定化對溶菌酶最適pH的影響Fig.3 Effect of immobilization on the optimum pH of lysozyme
2.3.2 固定化對溶菌酶最適溫度的影響 如圖4所示,游離溶菌酶的最適溫度為75 ℃,在70~75 ℃范圍內保持較高活力;而固定化溶菌酶的最適溫度為80 ℃,且在70~90 ℃范圍內維持較高的活力達95%,體現較高的溫度穩定性。這可能是由于酶與載體的共價結合位點使溶菌酶的活性中心在高溫下仍能維持應有的空間構象,從而使溶菌酶發揮較高活力。郭慶啟等[17]以戊二醛為交聯劑,將溶菌酶固定于AB-8大孔樹脂上,其最適溫度雖然也升高5 ℃,但45 ℃后酶活力顯著降低。潘軍軍等[34]將溶菌酶固定于羊毛織物上,但并未研究固定化酶的最適溫度,考察了固定化溶菌酶在40 ℃下的熱穩定性,保溫100 min后仍保持96%的熱穩定性。
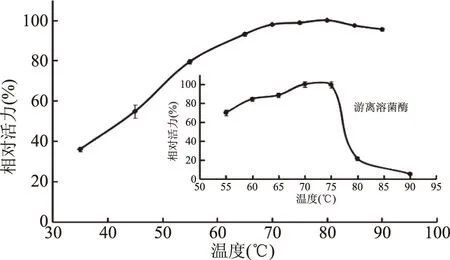
圖4 固定化對溶菌酶最適溫度的影響Fig.4 Effect of immobilization on the optimum temperature of lysozyme
2.3.3 固定化對溶菌酶Km值的影響 Km值表示酶對底物的親和力,Km值越小說明酶對底物的親和力越大,越有利于溶菌酶發揮催化活力。如圖5所示,溶菌酶經固定化后,其表觀Km值(2.69 mg/mL)比游離酶的(1.75 mg/mL)明顯增大。說明溶菌酶分子表面的固定位點較多,固定化后一定程度上束縛了酶與底物之間的相互作用,這是共價固定化酶的普遍現象,但本實驗中Km值的變化幅度并不大,如圖5所示,因此,可認為固定化結合位點及其數量既達到了提高溶菌酶熱穩定性的作用,又沒有顯著影響溶菌酶的酶解性能。目前尚未發現與本文所做的固定化溶菌酶的Km值測定類似的報道。
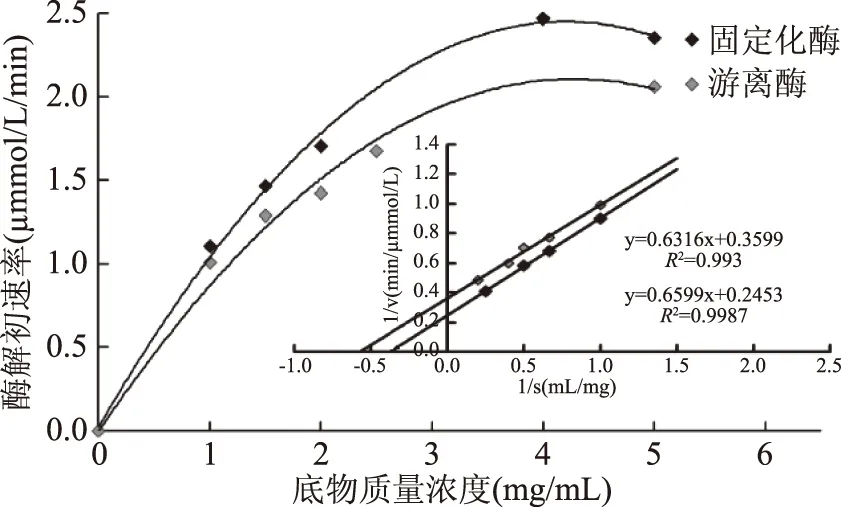
圖5 固定化對溶菌酶Km值的影響 Fig.5 Effect of immobilization on the Km of lysozyme
3 結論
本文以具有一定機械性能的雪蟹甲殼素顆粒為載體,對其表面部分脫乙酰,使其與戊二醛發生交聯后再固定溶菌酶,固定化的最佳脫乙酰時間(A)為25 min,戊二醛濃度(B)為5%,載體活化pH(C)為5.0,且其影響因素A>B>C。所得到的固定化酶的表觀最適pH由4.0降至3.5;最適溫度由75 ℃升高至80 ℃,且在70~90 ℃仍保持95%活力;Km為2.69 mg/mL明顯大于游離酶的1.75 mg/mL;且15 d穩定性保持66%。其兼顧了溶菌酶的抗菌、穩定與應用性能,與載體一起共同構成環境友好型抗菌材料,使其在食品包裝、清潔用品、創口輔料[35]等領域具有廣闊的應用前景。

