細(xì)胞減滅術(shù)聯(lián)合腹腔熱灌注化療治療腹膜假黏液瘤的研究進(jìn)展
李鑫寶,姬忠賀,林育林,李 雁
(首都醫(yī)科大學(xué)附屬北京世紀(jì)壇醫(yī)院腹膜腫瘤外科 北京市腫瘤深部熱療和全身熱療技術(shù)培訓(xùn)基地 首都醫(yī)科大學(xué)腫瘤學(xué)系,北京 100038)
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一種以黏液性腫瘤細(xì)胞產(chǎn)生的黏液在腹腔內(nèi)集聚、再分布為特征的惡性腫瘤臨床綜合征,典型臨床表現(xiàn)為黏液性腹水、持續(xù)性腹脹、進(jìn)行性腸梗阻、腹膜種植、腹腔臟器粘連、網(wǎng)膜及卵巢受累[1-3]。該病最先由Rokitansky于1842年報(bào)道[4],整體發(fā)病率為(1~2)/100萬(wàn)[1,5],且有增高趨勢(shì)[6],但仍屬于罕見(jiàn)病范疇。
PMP來(lái)源廣泛,大部分源于破裂的闌尾黏液性腫瘤,少部分源于卵巢、結(jié)腸、臍尿管等臟器的原發(fā)性黏液性腫瘤。國(guó)際上,腹膜表面腫瘤國(guó)際聯(lián)盟對(duì)PMP病理類(lèi)型達(dá)成共識(shí)[3],分為4類(lèi):無(wú)細(xì)胞性黏液;腹膜低級(jí)別黏液瘤或播散性腹膜黏液腺瘤病;腹膜高級(jí)別黏液癌或腹膜黏液腺癌病;腹膜高級(jí)別黏液癌伴印戒細(xì)胞或腹膜黏液腺癌伴印戒細(xì)胞。現(xiàn)就PMP的國(guó)內(nèi)外治療現(xiàn)狀及研究進(jìn)展予以綜述。
1 PMP進(jìn)展過(guò)程
PMP主要源于闌尾黏液性腫瘤。腫瘤細(xì)胞持續(xù)產(chǎn)生黏液,腫瘤組織阻塞闌尾腔,腔內(nèi)黏液持續(xù)積聚,壓力持續(xù)增高,導(dǎo)致闌尾壁穿孔或破裂;伴或不伴有腫瘤細(xì)胞的黏液突然釋放或緩慢漏出到腹盆腔內(nèi);此后,腹腔內(nèi)游離或種植于腹膜上的腫瘤細(xì)胞持續(xù)增殖并產(chǎn)生黏液性腹腔積液,形成PMP。
腹腔內(nèi)黏液沿液體流動(dòng)路徑(主要為右側(cè)結(jié)腸旁溝),到達(dá)重吸收的主要部位(右側(cè)膈肌、網(wǎng)膜腹膜),經(jīng)腹膜淋巴孔、腹膜下小淋巴管、胸導(dǎo)管進(jìn)入血液循環(huán);此過(guò)程中液體被重吸收,黏液性腫瘤細(xì)胞積聚在重吸收部位,被腹膜淋巴孔捕獲,形成大量腫瘤組織;這就是“再分布現(xiàn)象”。另外,重力作用促進(jìn)了黏液性腫瘤細(xì)胞及黏液在盆腔內(nèi)堆積[1,6],見(jiàn)圖1。
終末階段,大量腫瘤組織及黏液充滿(mǎn)整個(gè)腹盆腔,導(dǎo)致胃腸道蠕動(dòng)受限、癌性粘連,出現(xiàn)腸梗阻癥狀,不能進(jìn)食或排泄,營(yíng)養(yǎng)消化,最終死于惡病質(zhì)。
PMP作為惰性、慢性進(jìn)展性疾病,中位生存時(shí)間為5.9~6.3年,長(zhǎng)期生存最高可達(dá)20年。但隨著疾病的進(jìn)展、治療后多次復(fù)發(fā),需重復(fù)減瘤術(shù)緩解腸梗阻癥狀,無(wú)進(jìn)展生存期較短,中位無(wú)進(jìn)展生存期為2.5年,5年、10年生存率分別僅為53%~75%、10%~32%[1,7]。
2 PMP治療現(xiàn)狀
2.1國(guó)內(nèi)治療現(xiàn)狀 目前國(guó)內(nèi)對(duì)PMP認(rèn)識(shí)不足,具體表現(xiàn)在以下幾點(diǎn)。①臨床誤診現(xiàn)象常見(jiàn):PMP的黏液性腹腔積液常被誤診為肝硬化腹水、卵巢腫瘤、結(jié)核性腹膜炎、腹腔轉(zhuǎn)移癌等[8-10];②治療時(shí)機(jī)延誤:很多患者闌尾切除術(shù)后病理診斷為闌尾黏液性腫瘤,尤其是T4期腫瘤、T3期黏液腺癌或闌尾源性PMP,存在腹膜種植轉(zhuǎn)移高危因素、已形成PMP,未采取專(zhuān)業(yè)化細(xì)胞減滅術(shù)(cytoreductive surgery,CRS)+腹腔熱灌注化療(hyperthermic intraperitoneal chemotherapy,HIPEC)積極干預(yù),錯(cuò)過(guò)最佳治療時(shí)機(jī);③臨床漏診:卵巢黏液性腫瘤未按照臨床常規(guī)和指南切除闌尾,可能漏診闌尾源性PMP。
國(guó)內(nèi)對(duì)PMP研究較匱乏。近10年(2009—2018年)國(guó)內(nèi)發(fā)表的主要臨床研究11篇[9,11-20],主要特點(diǎn):①多數(shù)研究樣本量較小,7~92例;②均為單中心研究;③4篇[11-13,19](36.4%)為非隨機(jī)對(duì)照研究,7篇[9,14-18,20](63.6%)為觀察性研究;④隨訪(fǎng)時(shí)間較短,無(wú)長(zhǎng)期生存分析;⑤僅3篇[14-15,17](27.3%)進(jìn)行生存預(yù)后分析,篩選獨(dú)立預(yù)后因素,指導(dǎo)臨床治療。綜上所述,目前國(guó)內(nèi)缺乏大樣本量、多中心、隨機(jī)對(duì)照等系統(tǒng)性研究。
國(guó)內(nèi)對(duì)PMP治療不規(guī)范,在外科治療方面主要采取減瘤術(shù),切除大部分腫瘤,以緩解腹脹、呼吸困難、營(yíng)養(yǎng)障礙等癥狀,甚至只采取活檢術(shù),明確病理診斷;輔助治療方面,主要采取全身化療、腹腔化療等。隨著CRS+HIPEC為主的整合治療技術(shù)體系建立,CRS+HIPEC中國(guó)專(zhuān)家共識(shí)的制訂[21]、臨床推廣,逐漸被國(guó)內(nèi)各腫瘤診療中心接受,但規(guī)范性較差:①未完全CRS,不能有效阻斷腫瘤進(jìn)展;②HIPEC灌注時(shí)機(jī)、化療藥物、劑量選擇、溫度控制、灌注時(shí)間、灌注方式、灌注次數(shù)等尚未程序化,未認(rèn)識(shí)到HIPEC是綜合診療技術(shù)的有機(jī)部分,而非象征性補(bǔ)充。
郗頌文[19]報(bào)道,減瘤術(shù)組、減瘤術(shù)+HIPEC組5年生存率分別為23.81%、85.71%(P<0.05),認(rèn)為HIPEC可顯著延長(zhǎng)患者生存期。周海濤等[11]報(bào)道,CRS組、減瘤術(shù)組5年生存率分別為70.0%、21.7%(P=0.015),CRS可提高患者生存率。此為目前國(guó)內(nèi)PMP治療效果最佳的研究報(bào)道。

A.闌尾腫瘤,腫瘤局限于闌尾腔內(nèi);B.闌尾腔阻塞、黏液積聚,圓框內(nèi)插圖為闌尾囊腫實(shí)景圖;C.闌尾壁穿孔或破裂,圓框內(nèi)插圖顯示闌尾穿孔,黏液釋放;D.再分布現(xiàn)象,黏液沿兩側(cè)結(jié)腸旁溝再分布播散至整個(gè)腹盆腔
圖1闌尾黏液性腫瘤形成PMP過(guò)程示意圖
2.2國(guó)際治療現(xiàn)狀 早期有文獻(xiàn)報(bào)道PMP采取保守治療[22]、黏液溶解藥物[23]、光療[24]、系統(tǒng)化療、放療等措施[25],臨床療效均較差。
Spratt等[26]首次采用CRS+HIPEC治療PMP患者1例,術(shù)后未出現(xiàn)嚴(yán)重不良事件,術(shù)后8個(gè)月無(wú)進(jìn)展生存,提示區(qū)域性綜合治療策略有效且安全性較好,為PMP治療提供了新思路。Sugarbaker[27]對(duì)接受CRS+HIPEC的PMP患者進(jìn)行回顧性分析,認(rèn)為CRS+HIPEC是PMP的最佳治療方案。2008年,國(guó)際上各主要腹膜癌診療中心[28]就CRS+HIPEC治療PMP達(dá)成專(zhuān)家共識(shí)。2012年,Chua等[29]詳細(xì)分析國(guó)際上多中心2 298例PMP患者治療數(shù)據(jù),顯示規(guī)范性CRS+HIPEC可使總生存期達(dá)到196個(gè)月(16.3年),無(wú)進(jìn)展生存期達(dá)到98個(gè)月(8.2年),10年、15年生存率分別為63%、59%。由于這些突出的臨床療效,2014年腹膜表面腫瘤國(guó)際聯(lián)盟在荷蘭召開(kāi)第九屆國(guó)際腹膜癌大會(huì),正式推薦CRS+HIPEC作為PMP的標(biāo)準(zhǔn)治療[30]。
近10年(2009—2018年),各國(guó)腹膜癌診療中心已廣泛采用規(guī)范性CRS+HIPEC治療PMP,并逐步開(kāi)展臨床研究[2,29,31-45],多為單中心或多中心大樣本量病例分析,仍缺乏隨機(jī)對(duì)照研究。
2.3國(guó)內(nèi)外治療對(duì)比 對(duì)比國(guó)內(nèi)國(guó)際研究可發(fā)現(xiàn)我國(guó)CRS+HIPEC治療PMP的水平與國(guó)際最佳水平仍存在不小差距,見(jiàn)圖2,突出表現(xiàn)在以下幾點(diǎn)。①臨床病期較晚:大多數(shù)PMP的腹膜癌指數(shù)(peritoneal cancer index,PCI)[46]在30分以上,而國(guó)際上中位PCI為19~24分[2,31-32,40-41],PCI>30者約13%[29];②細(xì)胞減滅程度(completeness of cytore-duction,CC)[27]0~1切除率較低:大多數(shù)行減瘤術(shù),而國(guó)際上CC0~1可達(dá)66%~95%[2,29,31,35,39-41];③HIPEC技術(shù)方案不統(tǒng)一:HIPEC灌注時(shí)機(jī)、化療藥物、溫度控制、灌注時(shí)間、灌注方式、灌注次數(shù)等尚未程序化。
鑒于這些問(wèn)題還需做出以下努力。①PMP自然病程早期診斷、接受治療:大量研究表明[29,32,41-44],PCI是PMP患者總生存期、無(wú)進(jìn)展生存期以及嚴(yán)重不良事件的獨(dú)立預(yù)后因素,故應(yīng)提高對(duì)PMP的認(rèn)識(shí),尤其是腫瘤科醫(yī)師,能夠在PMP自然病程早期鑒別診斷,并采取規(guī)范性CRS+HIPEC,患者不僅延長(zhǎng)生存期,而且減少?lài)g(shù)期嚴(yán)重不良事件發(fā)生的可能性;②規(guī)范CRS:研究表明CC是PMP患者總生存期、無(wú)進(jìn)展生存期的另一個(gè)獨(dú)立因素[29,31,37, 41-44],故應(yīng)規(guī)范CRS,盡可能達(dá)到完全CRS,即CC0~1;③規(guī)范HIPEC[47-48],即選擇PMP敏感性藥物、腹腔高濃度而全身不良反應(yīng)小(絲裂霉素C、紫杉醇、順鉑等)、腹腔內(nèi)溫度43 ℃、持續(xù)60 min、CRS后立即行術(shù)中HIPEC、循環(huán)灌注以均勻分布藥物等,并程序化,保證熱療與化療,以及與完全CRS的協(xié)同作用最大化。
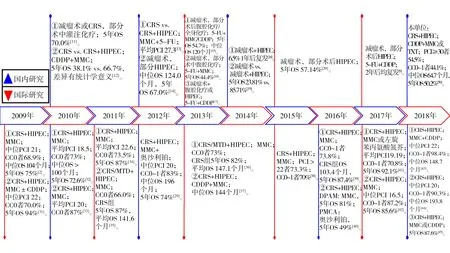
CRS:細(xì)胞減滅術(shù);HIPEC:腹腔熱灌注化療;OS:總生存期;CDDP:順鉑;MMC:絲裂霉素C;5-FU:5-氟尿嘧啶;TXT:多西他賽;PCI:腹膜癌指數(shù);CC:細(xì)胞減滅程度;MTD:最大程度減瘤術(shù);DPAM:播散性腹膜黏液腺瘤病;PMCA:腹膜黏液腺癌病
圖22009—2018年國(guó)內(nèi)外關(guān)于PMP主要臨床研究結(jié)果
3 標(biāo)準(zhǔn)治療
從病理學(xué)上講,腹膜黏液腺癌病、腹膜黏液腺癌
伴印戒細(xì)胞應(yīng)立即行規(guī)范性CRS+HIPEC;而低級(jí)別PMP(無(wú)細(xì)胞性黏液、播散性腹膜黏液腺瘤病)應(yīng)如何治療仍存在爭(zhēng)議。大量研究發(fā)現(xiàn)[44,49-52],無(wú)細(xì)胞性黏液PMP患者4年腹膜復(fù)發(fā)率為1.8%;闌尾漿膜面腫瘤細(xì)胞侵犯的PMP者4年腹膜復(fù)發(fā)率高達(dá)26.5%;這些情況下需行搶救性CRS+HIPEC,以避免腫瘤細(xì)胞腹膜播散加重。根據(jù)大樣本病理資料系統(tǒng)分析,國(guó)際上已達(dá)成共識(shí),低級(jí)別PMP(無(wú)細(xì)胞性黏液、播散性腹膜黏液腺瘤病)、高級(jí)別PMP(腹膜黏液腺癌病、腹膜黏液腺癌伴印戒細(xì)胞)均需行規(guī)范性CRS+HIPEC治療。
3.1理論基礎(chǔ) CRS+HIPEC體現(xiàn)了以手術(shù)為主的綜合治療優(yōu)勢(shì),整合了手術(shù)切除、區(qū)域化療、熱療、大容量液體灌洗的協(xié)同作用,通過(guò)手術(shù)徹底清除肉眼可見(jiàn)的腫瘤組織,HIPEC的熱化療協(xié)同作用清除殘余微轉(zhuǎn)移灶[53]和游離癌細(xì)胞[21,47-48,54-55]。
按照腫瘤治療學(xué)的原則,CRS+HIPEC的主要理論依據(jù)包括以下幾點(diǎn)。①手術(shù)切除:CRS通過(guò)腹膜切除聯(lián)合腹盆腔臟器,切除肉眼可見(jiàn)的腫瘤組織,最大限度地降低腫瘤負(fù)荷。②HIPEC藥代動(dòng)力學(xué)優(yōu)勢(shì):腹膜間皮細(xì)胞層、基膜、細(xì)胞外基質(zhì)網(wǎng)格結(jié)構(gòu)、血管內(nèi)皮等形成“腹膜-血漿屏障”,腹腔灌注化療藥物濃度可達(dá)到同一時(shí)間血漿藥物濃度的20~1 000倍,增強(qiáng)了藥物對(duì)腹膜癌細(xì)胞的直接殺傷作用,又減輕了全身不良反應(yīng)。③HIPEC熱療效應(yīng):在組織水平使癌組織內(nèi)微血管阻塞,引起腫瘤組織缺血性壞死;在細(xì)胞水平,破壞細(xì)胞自穩(wěn)機(jī)制,激活溶酶體、破壞胞質(zhì)和胞核,干擾能量代謝;在分子水平使癌細(xì)胞膜蛋白變性,干擾蛋白質(zhì)、DNA合成。④協(xié)同作用:熱療與化療協(xié)同抗腫瘤在43 ℃時(shí)明顯增強(qiáng);化療藥物的滲透深度可達(dá)5 mm,而且熱療可提高腫瘤細(xì)胞對(duì)某些抗癌藥物的反應(yīng)率。⑤液體沖洗:大劑量液體持續(xù)循環(huán)灌注,對(duì)腹腔內(nèi)游離癌細(xì)胞和微轉(zhuǎn)移灶起到機(jī)械沖刷作用,并將熱量與藥物均勻分布于整個(gè)腹盆腔。
3.2臨床療效 近10年(2009—2018年)國(guó)際主要臨床研究中[2,29,31-45],行規(guī)范性CRS+HIPEC,中位總生存期可達(dá)100~196個(gè)月,中位無(wú)進(jìn)展生存期可達(dá)40~110個(gè)月,5年生存率可達(dá)73%~94%,10年生存率可達(dá)36%~85%,3、5、10年無(wú)進(jìn)展生存率分別為51%~87%、38%~80%、61%~70%。其中,Chua等[29]進(jìn)行的國(guó)際多中心大樣本研究,中位總生存期為196個(gè)月,中位無(wú)進(jìn)展生存期為98個(gè)月,5年、10年生存率分別為74%、63%,是目前國(guó)際上最理想、最有代表性的臨床療效。首都醫(yī)科大學(xué)附屬北京世紀(jì)壇醫(yī)院腹膜腫瘤外科前期研究[56],182例接受CRS+HIPEC治療PMP患者,中位總生存期65個(gè)月,5年生存率為50%。可見(jiàn),CRS+HIPEC可以顯著延長(zhǎng)PMP患者總生存期、無(wú)進(jìn)展生存期,既能延長(zhǎng)PMP患者生存期、改善患者癥狀及生活質(zhì)量,又能減少患者反復(fù)手術(shù)次數(shù)、經(jīng)濟(jì)壓力。
3.3安全性 為達(dá)到完全CRS,常需行多部位、多臟器、多區(qū)域腹膜聯(lián)合切除,多處淋巴結(jié)清掃,術(shù)后腹盆腔臟器復(fù)雜重建[57];手術(shù)時(shí)間較長(zhǎng),平均約10 h;HIPEC可在一定程度上抑制胃腸道吻合口的愈合[58];上述因素增加了CRS+HIPEC不良事件發(fā)生率及死亡率[59]。綜合近10年國(guó)際主要臨床研究,嚴(yán)重不良事件發(fā)生率為7%~53%,再手術(shù)率4%~18%,圍術(shù)期死亡率0%~4%,主要嚴(yán)重不良事件為敗血癥、肺部感染、胸腔積液、氣胸、胃腸瘺、胰瘺、膽瘺、腸梗阻、腹腔膿腫、腹腔出血、泌尿系瘺、切口感染、骨髓抑制、靜脈血栓栓塞癥、心肌梗死等[2,29,31-45]。隨著學(xué)習(xí)曲線(xiàn)發(fā)展,手術(shù)技術(shù)、圍術(shù)期管理水平提高,圍術(shù)期嚴(yán)重不良事件發(fā)生率、死亡率將進(jìn)一步降低,而且應(yīng)認(rèn)識(shí)到未接受該綜合治療的PMP患者預(yù)后更差。
3.4學(xué)習(xí)曲線(xiàn) CRS操作難度大、技術(shù)要求水平高;HIPEC要求精準(zhǔn)控制溫度(≤0.5 ℃)、流量(≤±5%)及灌注時(shí)間;手術(shù)時(shí)間長(zhǎng),血流動(dòng)力學(xué)管理及麻醉管理要求高;圍術(shù)期多臟器功能維護(hù)難度大;這些導(dǎo)致CRS+HIPEC治療PMP的學(xué)習(xí)曲線(xiàn)較長(zhǎng)。
Kusamura等[60]研究發(fā)現(xiàn),腫瘤中心完成中位100(78~284)例、腫瘤外科醫(yī)師完成中位96(86~284)例CRS+HIPEC才能達(dá)到技術(shù)穩(wěn)定。同樣,Andreasson等[61]研究提示,需完成220±10例CRS+HIPEC才能實(shí)現(xiàn)技術(shù)穩(wěn)定,患者CC0~1率顯著提高(P=0.000 2),術(shù)中出血量顯著降低(P<0.000 1),術(shù)后再手術(shù)率降低(P=0.020),總生存期顯著改善(P=0.020)。提示PMP患者在有經(jīng)驗(yàn)的腹膜癌診療中心接受CRS+HIPEC治療生存明顯獲益,圍術(shù)期嚴(yán)重不良事件發(fā)生可能性較小;腹膜癌專(zhuān)科醫(yī)師應(yīng)在專(zhuān)業(yè)腹膜癌診療中心進(jìn)行嚴(yán)格的技術(shù)訓(xùn)練,達(dá)到技術(shù)穩(wěn)定,使PMP患者生存獲益。
4 小 結(jié)
隨著國(guó)際腫瘤學(xué)界逐漸開(kāi)展CRS+HIPEC治療PMP的臨床研究,已積累了一些循證醫(yī)學(xué)證據(jù),表明CRS+HIPEC可延長(zhǎng)PMP患者的總生存期、無(wú)進(jìn)展生存期,最佳總生存期達(dá)196個(gè)月(約19年),最佳無(wú)進(jìn)展生存期達(dá)98個(gè)月(約8年),10年、15年生存率分別達(dá)到63%、59%[29],臨床療效顯著,推薦規(guī)范性CRS+HIPEC作為PMP的標(biāo)準(zhǔn)治療。綜合目前臨床研究,仍需隨機(jī)對(duì)照研究、Meta分析等高級(jí)別循證醫(yī)學(xué)證據(jù)證實(shí),并進(jìn)一步完善該綜合診療技術(shù)。
規(guī)范性CRS+HIPEC綜合診療技術(shù)作為PMP的有效治療措施,國(guó)內(nèi)只有少數(shù)腫瘤中心開(kāi)展,且規(guī)范性較差,因此亟需臨床推廣,并在腫瘤學(xué)界形成治療指南,以改善目前國(guó)內(nèi)PMP治療現(xiàn)狀。首都醫(yī)科大學(xué)附屬北京世紀(jì)壇醫(yī)院腹膜腫瘤外科長(zhǎng)期致力于以CRS+HIPEC為主的腹膜癌綜合診療技術(shù),進(jìn)行了大量的基礎(chǔ)[62]、轉(zhuǎn)化[63]、臨床研究[64],有近千例的治療經(jīng)驗(yàn),并形成了術(shù)后高肌紅蛋白血癥[65]、胃腸道瘺[66]、靜脈血栓栓塞癥[67]等嚴(yán)重不良事件預(yù)防與治療技術(shù)體系;牽頭制訂了我國(guó)首個(gè)治療腹膜表面腫瘤的專(zhuān)家共識(shí)[21],并被評(píng)為北京市目前唯一的腫瘤深部熱療培訓(xùn)基地和國(guó)際合作中心,將在CRS+HIPEC治療PMP方面開(kāi)展更多全方位技術(shù)培訓(xùn),以整體提高我國(guó)治療PMP的療效。

