阿帕替尼聯合吉西他濱對Lewis肺癌的實驗研究
李 源,秦蓉聲,范 娟
(西南醫科大學附屬醫院腫瘤科,四川 瀘州 646000)
血管內皮生長因子(vascular endothelial growth factor,VEGF)又稱血管通透因子,是一種高度特異性的促血管內皮細胞生長因子,具有促進血管通透性增加、細胞外基質變性、血管內皮細胞遷移、增殖和血管形成等作用,因此VEGF信號通路在血管生成過程中發揮重要作用[1]。多項研究顯示[1-2],血管生成是腫瘤生長和轉移的必要條件,抑制腫瘤血管形成,阻斷腫瘤營養的供給,即可達到抑制腫瘤生長的目的,因此抑制腫瘤新生血管生成已成為目前治療腫瘤相關疾病的重要手段之一。阿帕替尼,一種口服的新型的小分子酪氨酸激酶抑制劑,主要與血管內皮生長因子受體2(vascular endothelial growth factor receptor 2,VEGFR-2)結合,從而抑制VEGFR-2磷酸化,以達到抑制血管生成的目的[3-4]。阿帕替尼主要用于晚期胃癌的治療,但相關研究已證明其對肺癌具有明顯的抑制作用[5]。肺癌作為一種常見的惡性腫瘤,發病率及病死率長期居第1位[6]。肺癌的常見治療手段包括手術、放療、化療及靶向治療,其中化療是大多數晚期肺癌的主要治療手段,吉西他濱、紫杉醇、順鉑等均是肺癌常用的化療藥物,盡管可選擇的化療方案多樣,但由于患者不耐受以及耐藥問題的出現,單純化療療效仍欠佳。目前國內外有關阿帕替尼聯合化療治療肺癌的研究較少,本實驗旨在阿帕替尼聯合吉西他濱作用于Lewis肺癌的抑制作用及可能機制,為臨床研究提供理論依據。
1 材料與方法
1.1材料 Lewis細胞由西南醫科大學附屬醫院實驗中心提供。C57/BL6小鼠28只,雌性,6~8周齡,體重18~22 g,購自重慶騰鑫生物生物技術有限公司,在無特定病原體級條件下統一飼養[實驗動物許可證編號:SYXK(渝)2015-0002]。RPMI-1640培養基購自美國Sigma公司,甲磺酸阿帕替尼片由江蘇恒瑞醫藥股份有限公司提供,VEGFR-2抗體購自德國Bio-world公司。
1.2方法
1.2.1Lewis肺癌模型建立與實驗設計 取處于對數期Lewis肺癌細胞,調整細胞濃度至1×106個/mL,以0.1 mL/只接種于C57/BL6小鼠右大腿。腫瘤體積增長到100~200 mm3(接種前通過細胞計數板對細胞懸液計數,接種時確保細胞懸液無外滲,以確保每只小鼠成瘤;接種后隔天觀察小鼠,用游標卡尺測量小鼠瘤體積,約10 d 28只小鼠均成瘤),采用隨機數字法分為空白對照組、阿帕替尼組、吉西他濱組、阿帕替尼聯合吉西他濱組,每組7只。空白對照組:0.9%氯化鈉注射液0.2 mL/d,灌胃,第1~7天;阿帕替尼組:阿帕替尼200 mg/(kg·d),灌胃,第1~7天;吉西他濱組:吉西他濱50 mg/(kg·d),腹腔注射,每周2次;阿帕替尼聯合吉西他濱組:阿帕替尼200 mg/(kg·d),灌胃,第1~7天,吉西他濱50 mg/(kg·d),腹腔注射,每周2次。成瘤后隔天采用游標卡尺測量腫瘤的最長徑及最短徑,根據公式V=1/2ab2(a:最長徑,b:最短徑)計算瘤體積[7]。治療結束次日每組隨機選取3只行小動物正電子發射計算機斷層顯像(positron emission tomography,PET)/CT。治療后第13天采用頸椎脫臼法處死所有小鼠,處死后取出腫瘤組織,行免疫組織化學法檢測,計算腫瘤生長抑制率:(對照組平均瘤體積-治療組平均瘤體積)/對照組平均瘤體積(×100%)[7]。
1.2.2PET/CT掃描 治療結束次日,每組隨機選取3只,禁食6~8 h,次日予以1%戊巴比妥鈉腹腔注射麻醉,麻醉滿意后,經尾靜脈注氟代脫氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)150~200 uCi 30 min后,固定于PET掃描架上掃描,獲得衰減校正后小鼠18F-FDG 分布融合圖像,沿腫瘤邊緣勾畫感興趣區后通過計算機測出腫瘤最大標準化攝取值(standardized uptake value max,SUVmax)。
1.2.3免疫組織化學檢測 小鼠處死后立即取出腫瘤組織,用4%甲醛溶液固定、石蠟包埋,采用鏈霉素抗生物素蛋白-過氧化物酶鏈免疫組織化學法檢測VEGFR-2,所有操作嚴格按照試劑何說明書進行。結果判定[8]:以VEGFR-2陽性所占百分比作為標準,在低倍鏡(×100)下隨機選擇5個VEGFR-2密集分布區域,再在高倍鏡(×400)下計數,棕黃色或棕褐色為陽性,淡黃色或無色為陰性。

2 結 果
2.1荷瘤小鼠一般情況 阿帕替尼組、吉西他濱組、阿帕替尼聯合吉西他濱組小鼠腫瘤生長均受到不同程度抑制,見圖1。空白對照組、阿帕替尼組一般情況可,飲食,大便正常,未見消瘦、皮下脂肪減少,吉西他濱組、阿帕替尼聯合吉西他濱組出現一過性消瘦,皮下脂肪減少,但整個實驗期間未出現小鼠死亡事件。
2.2小鼠腫瘤生長情況 空白對照組、吉西他濱組、阿帕替尼組、阿帕替尼聯合吉西他濱組腫瘤體積分別為(5 010±334) mm3、(3 101±217) mm3、(3 413±349) mm3、(2 063±289) mm3,各組比較差異有統計學意義(F=114.393,P<0.01),吉西他濱組、
阿帕替尼組、阿帕替尼聯合吉西他濱組腫瘤體積小于空白對照組(P<0.01),阿帕替尼聯合吉西他濱組小于吉西他濱組和阿帕替尼組(P<0.01),而阿帕替尼組和吉西他濱組腫瘤體積比較差異無統計學意義(P>0.05)。吉西他濱組、阿帕替尼組、阿帕替尼聯合吉西他濱組抑制率分別為38.1%、31.9%、58.5%。見圖1。

圖1 各組小鼠腫瘤生長曲線圖
2.3PET/CT掃描結果 空白對照組、吉西他濱組、阿帕替尼組、阿帕替尼聯合吉西他濱組SUVmax值分別為4.08±0.26、3.53±0.19、3.33±0.22、2.28±0.18,各組比較差異有統計學意義(F=36.914,P<0.01),吉西他濱組、阿帕替尼組、阿帕替尼聯合吉西他濱組SUVmax值均低于空白對照組(P<0.01),阿帕替尼聯合吉西他濱組低于吉西他濱組和阿帕替尼組(P<0.01),而阿帕替尼組與吉西他濱組比較差異無統計學意義(P>0.05)。見圖2。
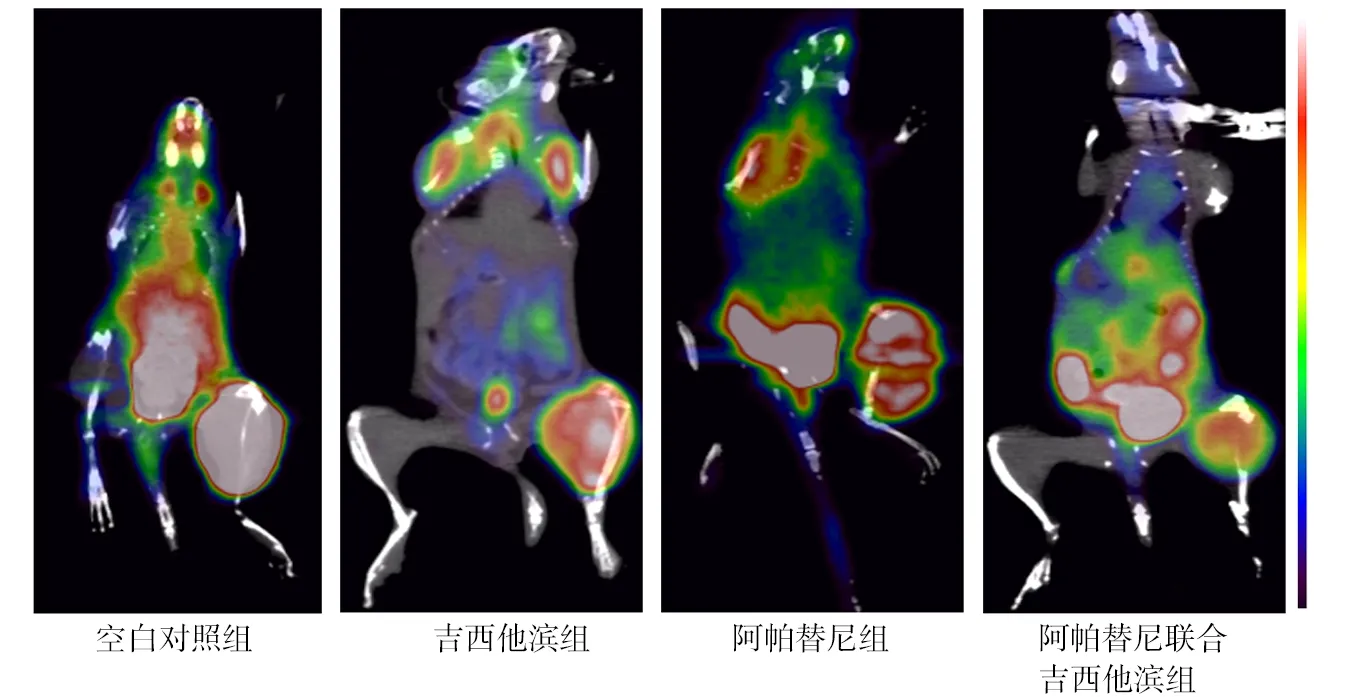
圖2 各組荷瘤小鼠PET/CT圖像
2.4免疫組織化學結果 空白對照組、阿帕替尼組、吉西他濱組、阿帕替尼聯合吉西他濱組VEGFR-2陽性表達率平分別為(90±6)%、(61±8)%、(86±6)%、(29±7)%,各組比較差異有統計學意義(F=117.293,P<0.01),阿帕替尼組、阿帕替尼聯合吉西他濱組低于空白對照組和吉西他濱組(P<0.01),阿帕替尼聯合吉西他濱組低于阿帕替尼組(P<0.01),但吉西他濱組與空白對照組比較差異無統計學意義(P>0.05)。見圖3。
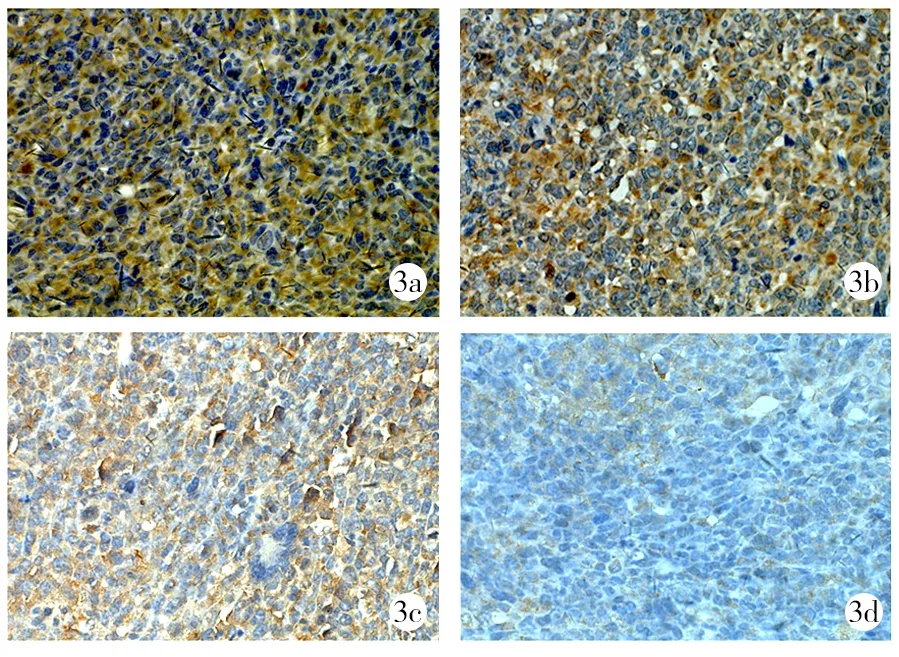
3a:空白對照組;3b:吉西他濱組;3c:阿帕替尼組;3d:阿帕替尼聯合吉西他濱組
圖3各組免疫組織化學血管內皮生長因子受體2陽性表達(×400)
3 討 論
長期以來,肺癌的發病率居我國第1位,其中80%為非小細胞肺癌[6],由于其惡性程度高,且大部分患者發現時已處于晚期,化療成為大部分肺癌患者的主要治療手段,然而由于化療藥物的不良反應以及腫瘤血管的無序性阻礙了化療藥物進入腫瘤組織等使化療的治療效果受到一定程度的限制[9-10]。
隨著Folkman“餓死腫瘤”理論的提出[1,11],發現腫瘤血管形成可以為腫瘤提供營養,這成為腫瘤生長、侵襲、轉移的重要條件,因此抑制腫瘤血管生成即可達到抑制腫瘤生長的目的。Escudier等[12]研究發現索拉菲尼可以延長晚期腎癌患者的無進展生存率,相關研究也表明舒尼替尼可明顯提高腫瘤患者的生活質量[10],由此可見抗血管生成治療在腫瘤的治療中取得了良好的療效。阿帕替尼作為我國自主研發的新型抗血管生成藥物,在晚期胃癌的治療中取得良好療效。而相關研究表明,阿帕替尼對非小細胞肺癌、乳腺癌、肝癌、結腸癌也表現出顯著的療效[13-16]。目前晚期非小細胞肺癌的主要治療手段包括化療及酪氨酸激酶抑制劑靶向治療,吉西他濱作為非小細胞肺癌一線用藥,為細胞周期特異性抗代謝藥物,主要作用于DNA合成期,常與鉑類藥物聯合化療,然而部分患者身體不能耐受聯合化療,因此降低了肺癌患者的療效。研究證實抗血管生成可以提高化療療效[17],因此本研究將阿帕替尼與化療藥物吉西他濱聯合應用,初步探討其對非小細胞肺癌移植瘤的治療效果。
本研究結果顯示,阿帕替尼組腫瘤生長曲線較空白對照組明顯延緩,與Wu等[18]關于阿帕替尼Ⅱ期臨床試驗結論類似,均證實了阿帕替尼對晚期非小細胞肺癌治療有效。從本研究中的腫瘤生長曲線中可以看出,阿帕替尼組和吉西他濱組較空白對照組腫瘤生長得到明顯延緩,這也證實了單用阿帕替尼可以抑制腫瘤的生長,同時,阿帕替尼聯合吉西他濱組腫瘤生長抑制較單藥組更顯著,充分說明阿帕替尼聯合吉西他濱治療可明顯提高抗腫瘤效應。18F-FDG是目前臨床最常用的PET顯像劑,18F-FDG可反映腫瘤細胞糖代謝水平,通過PET/CT探測18F-FDG SUV的大小可以反映腫瘤惡性程度。SUV值越高,糖代謝水平越高,提示腫瘤的惡性程度越高,療效越差,否則反之[19-20]。本研究結果顯示,阿帕替尼組和吉西他濱組SUVmax較空白對照組明顯降低,表明在單阿帕替尼、單吉西他濱的治療下腫瘤代謝降低,單藥治療有一定抗的腫瘤效應,而阿帕替尼聯合吉西他濱組中SUVmax最低,較其他各組差異有統計學意義,再次證明阿帕替尼聯合化療藥物吉西他濱具有協同抗腫瘤效應。這與Qiu等[21]的阿帕替尼聯合紫杉醇在宮頸癌移植瘤治療中產生協同效應類似。
腫瘤血管的生成受到許多促血管生成因子的調控,其中VEGF/VEGFR成為腫瘤血管生成的關鍵因素,通過抑制VEGF/VEGFR即可抑制腫瘤生長。VEGFR家族包括VEGFR-1、VEGFR-2、VEGFR-3,其中VEGFR-2在血管生成中發揮重要作用。阿帕替尼對細胞內VEGFR-2高度親和,通過抑制VEGF與VEGFR-2結合,進而達到抑制血管生成“餓死腫瘤”的目的[22-24]。本研究結果顯示,阿帕替尼組和阿帕替尼聯合吉西他濱組VEGFR-2陽性表達率均低于空白對照組,且阿帕替尼聯合吉西他濱組較阿帕替尼組降低更顯著(P<0.01)。由此表明,阿帕替尼通過下調VEGFR-2表達,從而抑制腫瘤的生長,同時說明聯合用藥可產生聯合效應,增強抗腫瘤的效果。
綜上所述,阿帕替尼聯合吉西他濱可以明顯縮小Lewis肺癌的腫瘤體積,降低SUVmax值,兩者具有協同作用,這為今后臨床治療非小細胞肺癌提供了新思路。然而,受限于研究時間、研究條件,本研究未進一步探討其分子機制,但課題組通過查閱文獻推測此種協同作用可能與阿帕替尼可以使腫瘤血管正常化有關,因為已有研究表明,腫瘤血管畸形生長可導致腫瘤組織間壓力和乏氧增加,從而降低腫瘤組織對化療藥物的敏感性[25-27]。此外,本研究樣本量較少,研究結論需更多大樣本、多中心研究進一步論證。

