緊密連接蛋白維持上呼吸道黏膜屏障完整性的研究進展*
李 爽,晏雪梅,肖 純,李秀芳
(云南中醫學院,云南 昆明 650500)
上呼吸道感染通常具有自限性特點,患者經過1周左右的休息即可恢復。但對于新生兒、老年人或患有代謝性疾病的患者,則容易出現上呼吸道感染向下發展的情況,嚴重者可引發肺炎等并發癥[1-3]。上呼吸道是機體直接與外界相通的門戶,覆蓋于除鼻前庭外鼻腔結構的鼻黏膜,是機體與吸入抗原、異物、微生物等接觸的第1個部位,鼻黏膜不僅具有一般的物理屏障功能,還是機體固有免疫的重要組成部分,也是連接機體固有免疫與獲得性免疫的橋梁。因此,由鼻黏膜激發的免疫效應對于防御病原體經鼻進入機體至關重要。急性上呼吸道感染絕大多數與鼻病毒、呼吸道合胞病毒和腺病毒等病毒感染有關,亦可由肺炎支原體、溶血性鏈球菌和肺炎鏈球菌等直接引起或繼發感染[4]。也有研究表明,鼻黏膜屏障被破壞或其免疫功能低下是上呼吸道感染發生的重要原因[5-6]。鼻黏膜屏障主要由物理屏障和免疫屏障構成,其中細胞間緊密連接(tight junction,TJ)作為鼻黏膜物理屏障的組成部分,在維持上呼吸道黏膜屏障的完整性中發揮了極為重要的作用。
緊密連接是上皮細胞和內皮細胞間一種重要的黏附形式,主要是呈連續的帶狀結構圍繞著上皮細胞或內皮細胞[7]。緊密連接具有較復雜的分子結構,其主要作用是通過旁細胞途徑調節離子和分子的細胞間通道,維持上皮細胞和內皮細胞的質膜極性。同時,緊密連接可形成機械屏障[8],阻止溶質和水等大分子自由通過上皮細胞或內皮細胞間的細胞間隙,維持細胞內環境的穩態。依據結構的差異,緊密連接主要分為胞漿蛋白和跨膜蛋白,其中胞漿蛋白包含 ZO(zonula occludens)蛋白家族和Cingulin。胞漿蛋白的主要作用是將跨膜蛋白與細胞骨架蛋白F-actin相連接,形成緊密連接網絡,在上皮細胞和內皮細胞頂端和基底外側區域起到阻塞溶質自由進出的作用。跨膜蛋白包括Occludin,Claudins和Tricellulin等,其細胞外環可相互融合起到封閉細胞間隙的作用。因為2個細胞之間是直接接觸且相互融合,所以在緊密連接的水平,細胞間隙幾乎不存在[9]。因而,緊密連接是上皮細胞或內皮細胞維持細胞極性的重要結構蛋白。緊密連接并不是不可滲透的結構,經由水性孔隙和轉運蛋白的過程,緊密連接蛋白會表現出對離子和分子的特異性選擇[10]。
有報道指出,細菌、病毒等可通過損壞上呼吸道黏膜緊密連接蛋白的結構來改變細胞間緊密連接的通透性,降低上呼吸道黏膜屏障功能,這可能是上呼吸道感染的重要原因之一[11-12]。本研究中對緊密連接蛋白維持上呼吸道黏膜屏障完整性的作用及其與上呼吸道感染關系的研究進展進行了綜述。
1 胞漿蛋白
胞漿蛋白在緊密連接中主要起阻塞上皮細胞和內皮細胞頂端和基底外側溶質自由進出的作用。其中,Cingulin是一個相對分子質量為140×103的胞漿蛋白,其N-端能與ZO-1和細胞骨架蛋白F-actin相結合,發揮銜接細胞骨架和其余胞漿蛋白的作用。而ZO蛋白家族則負責調節細胞物質轉運和維持上皮細胞極性,在上呼吸道黏膜免疫中起著至關重要的作用。
ZO蛋白家族:按結構劃分屬膜相關鳥苷酸激酶樣同系物(membrane associated guanylate kinase,MAGUK),目前發現的主要有 ZO-1,ZO-2和 ZO-3。ZO-1是一種針對肝臟的富結點部位產生的單克隆抗體的抗原[13];ZO-1免疫共沉淀的ZO-2[14],相對分子質量約為160×103;ZO-3是一個磷酸化異構體[15],相對分子質量約為130×103。上述3個蛋白結構中都具有1個SH3結構域,3個PDZ結構域和1個 GUK結構域,從NH2端點開始按相對分子質量由大到小依次排列(見圖1)[16]。其中,ZO-1是構成緊密連接網絡的樞紐蛋白,參與調節物質的轉運和維持上皮細胞極性、腫瘤細胞的轉移和基因轉錄等多個重要過程[17]。
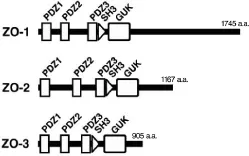
圖1 ZO-1,ZO-2和 ZO-3的蛋白結構示意圖
ZO-1的結構:ZO-1是 1個相對分子質量為210~225×103的緊密連接相關蛋白[18],其結構中含有1個長的羧基末尾區域和富含脯氨酸結構域的酸性模塊,幾個選擇性剪接點。在緊密連接網絡的構成中,ZO-1主要是通過與其同源體的ZO-2和ZO-3相結合[18],為跨膜蛋白和胞漿蛋白搭建具備銜接作用的“腳手架樣平臺”。通過ZO-1的作用可使細胞骨架、信號和完整的蛋白質連接固定在膜的特定區域,維持細胞的柵欄和屏障功能。由于ZO-1的結構和功能與緊密連接的形成密切相關,因此當ZO-1結構受到破壞時,緊密連接的結構也會隨之變化,故常以ZO-1作為評價細胞間屏障功能的主要指標。
上呼吸道感染過程中ZO-1的變化:克雷伯桿菌感染初期可引發呼吸道上皮細胞ZO-1和Occludin蛋白表達下降[19],感染后第 2天,大鼠細支氣管上皮ZO-1蛋白表達開始下降,細支氣管壁和肺泡隔內可見中性粒細胞浸潤,但上皮細胞連接緊密;感染第4~16天,細支氣管上皮細胞、肺泡上皮細胞ZO-1和Occludin蛋白表達均明顯下降,且2種蛋白降低趨勢基本相似,中性粒細胞浸潤增多,少數上皮細胞排列松散,也見上皮細胞明顯脫落。表明隨著細菌的感染,ZO-1和Occludin蛋白受到破壞,細胞間的緊密連接結構也隨之改變,黏膜屏障功能受損,可能是導致上呼吸道感染發生并發展的重要原因。當極化的正常人鼻上皮細胞(human nasal epithelial cells,HNECs)感染呼吸道合胞病毒(respiratory syncytial virus,RSV)后[20],鼻病毒(rhinovirus,RV)可通過將ZO-1從細胞膜異位致細胞質中,通過解離緊密連接來破壞氣道上皮細胞的屏障功能。
2 跨膜蛋白
2.1 Occludin蛋白的結構與功能
跨膜蛋白主要包括 Claudin蛋白家族、Occludin、Tricellulin和連接黏附分子(Junctional Adhesion Molecule,JAM)。Claudin作為緊密連接中主要的跨膜蛋白家族,目前已發現27名成員。緊密連接中第1個被發現的整合蛋白是Occludin。而Tricellulin被認為是細胞緊密連接的中心成分,能參與調控旁細胞途徑的大分子物質轉運。JAM屬Ⅰ型整合蛋白,主要功能是可選擇性地集中在不同來源的內皮細胞和上皮細胞的細胞間連接處,參與單核細胞的遷移。研究發現,Occludin蛋白、Claudin蛋白家族和JAM與上呼吸道黏膜免疫功能的調節密切相關[21-23]。
Occludin的結構與功能:Occludin是緊密連接中第1個被識別出來的整合蛋白,相對分子質量約為60×103,其名稱來源于拉丁詞“occludere”[18],即封閉的意思,其結構包括2個富含酪氨酸殘基的細胞外環、3個細胞質結構和4個跨膜結構[18]。其中,2個細胞外環大小不等,第1個細胞外環中的1/2以上是由酪氨酸殘基和甘氨酸形成,具有維持緊密連接穩定性及屏障功能的作用。其 C,N端伸進胞漿內與 ZO-1,ZO-2,ZO-3銜接并彼此互相作用后,才能使相鄰的細胞外環相互作用而形成緊密連接網絡。Occludin進入緊密連接復合體后,連接部位的細胞膜通透性就會降低,僅容許小分子物質進出。故Occludin蛋白在緊密連接維持上皮細胞及內皮細胞的通透性中扮演著至關重要的角色[24]。
上呼吸道感染過程中Occludin的變化:在病毒入侵過程中,Occludin可能通過增加巨噬細胞或類似胞吞的作用調節病毒的繁殖速度[21]。而在HNECs感染RSV的實驗中觀察到,Occludin,ZO-2,Cingulin等緊密連接蛋白的表達上調[25],這可能是防止細菌及病毒感染上呼吸道的重要途徑。在RT-PCR和實時PCR中,Claudin-4和Occludin的mRNA在RSV感染24 h后增加,而在未感染的對照組和具有紫外線(UV)滅活的RSV組中未觀察到變化。Western印跡法檢測結果顯示,在RSV感染72 h后,僅Claudin-1減少,而Claudin-7,ZO-1,JAM-A和E-鈣黏蛋白無變化。結果表明,在上皮細胞感染RSV后,緊密連接蛋白在屏障功能中起關鍵作用。
2.2 Claudin蛋白家族的結構與功能
Claudin的結構:Claudin是1998年在雞肝臟中首次被發現的一種相對分子質量為20×103~27×103的蛋白,名稱來源于拉丁詞“claudere”,即關閉的意思[18]。目前,已發現27個成員,是緊密連接中重要的跨膜蛋白家族,具有柵欄和屏障功能。Claudin蛋白的結構主要由4個疏水的跨膜結構區、大小不等的2個細胞外環和位于細胞質中的羧基端和氨基端構成[17]。其中,羧基上的氨基酸高度保護內部構成PDZ聯合基序。PDZ是1個由80~90個氨基酸組成的模塊,存在于羧基末端,與特定的位點結合。通過這些位點,Claudin可與細胞質內含PDZ結構域的蛋白質相結合,構成緊密連接結構,起到柵欄和屏障功能[18]。由圖2可知,以Claudin-3為例,其N端和C端都朝向側翼細胞質。跨細胞膜顯示,2個細胞外環(EL)結構域,Claudin-3與 ZO -1/ZO -2的PDZ結合基序“COOH-YV”序列結合并通過支架ZO-1與細胞骨架如肌動蛋白的蛋白質連接,而ZO-1則可通過其他PDZ-結構基序與ZO-2相連接,構成緊密連接網絡,封閉細胞間隙[26]。

圖2 細胞中Claudin-3信號的圖解
上呼吸道感染過程中Claudin的變化:產氣莢膜梭菌腸毒素(CPE)可通過其N-尾端聚合形成孔隙,并通過C-尾端與緊密連接蛋白結合,破壞上皮層的屏障功能[22],靶向的與鼻咽相關淋巴組織(nasopharynx associated lymphoid tissue,NALT)的黏膜上皮細胞中緊密連接蛋白相互作用,引起細胞毒性。而Claudin-4則可通過優先與NALT的黏膜上皮細胞作用,包括M細胞[27-29],將抗原直接遞呈至上皮而不誘導細胞毒性[27-28,30]。該免疫反應足以預防呼吸道肺炎球菌的感染,而Claudin-4在此過程中有至關重要的作用。
2.3 JAM蛋白家族的結構與功能
JAM蛋白家族的結構:連接黏附因子(JAM)[31]隸屬于免疫球蛋白超家族成員,最初在血小板中發現的是1個相對分子質量約為40×103的單跨膜蛋白-JAM-A,是JAM蛋白家族的經典成員。目前,已發現7名成員,包括 3種經典 JAM(JAM -A,JAM -B,JAM -C)和 4種相關蛋白(JAM -4,JAM -L,CAR,ESAM)。其中,AM -A,JAM-B和JAM-C細胞質的C-尾端所具有的Ⅱ型PDZ結合基序可與各種細胞內支架蛋白相互作用,并形成極性復合物[31-34]。非經典 JAM 家族(CAR,ESAM 和JAM-4)的成員含有Ⅰ型PDZ結合基序。2種基序都可結合多種細胞內配體(AF-6,MUPP-1,ZO -1,PAR -3,MAGI-1,LNX 和 CASK),詳見圖 3。分子 JAM -L 是唯一不含有PDZ結合基序的JAM家族成員,因此被認為不與任何PDZ蛋白結合。JAM可在黏附連接處與緊密連接蛋白形成同嗜性和異嗜性的相互作用,還可與其他JAM家族成員或整聯蛋白形成順式或反式的相互作用[8]。JAM在多種細胞和組織中表達,包括上皮細胞和內皮細胞、白細胞、雄性生殖系統細胞、中樞和外周神經系統細胞和成纖維細胞[35-37],其主要作用是選擇性地集中在不同來源的內皮細胞和上皮細胞的細胞間連接處,調控單核細胞的遷移。研究發現,JAM-A對鼻黏膜屏障功能的調節具有重要作用。

圖3 JAM蛋白家族及作用
JAM-A的結構和功能:屬于免疫球蛋白超家族中的糖蛋白,其結構主要包括2個細胞外免疫球蛋白樣的結構域[38]。ZO-1等緊密連接支架蛋白可與JAM-A的C-尾端的PDZ結合基序相互作用,形成一個大的蛋白質復合物[39-41],參與到緊密連接的分子組成中,調節小溶質物質的進出[37,42]。有研究提出,在慢性炎癥過程中,促炎性細胞因子(如IFN-γ和TNF-α)的釋放會導致JAM-A的表達降低,JAM-A依賴性信號傳導途徑遭到破壞可能是疾病惡化的重要原因[37,42-43]。JAM - A 還參與了調節上皮細胞和內皮細胞的旁細胞通透性、細胞的增殖和遷移等重要環節[44]。
呼吸系統疾病中JAM-A的變化:JAM-A通常出現在緊密連接建立的早期,通過在上皮細胞緊密連接連接處聚集Occludin等蛋白而構成細胞機械屏障[23]。在RSV傳染的HNECs中,蛋白質和mRNA的表達水平證實了Claudin-4和Occludin的蛋白表達和mRNA的表達上調導致緊密連接屏障功能的增強,而Claudin-1的減少是在RSV感染72 h后。在RSV感染24 h后的免疫細胞組化中,與對照組相比,ZO-1,JAM-A和E-鈣黏蛋白增加。這些都表明,緊密連接蛋白在維持上皮細胞或內皮細胞屏障性能的完整性中發揮著至關重要的作用[25]。
3 展望
作為與外界接觸的第一道屏障,上呼吸道肩負了防止病原體入侵的重要責任,而緊密連接蛋白作為上皮細胞及內皮細胞機械屏障的重要構成部分,阻止溶質和水等大分子物質自由通過上皮細胞或內皮細胞之間的細胞間隙,在保持細胞內環境的穩態中發揮著關鍵作用。相鄰細胞的緊密連接跨膜蛋白(Occludin等)經由細胞外環互相聯合,構成“成對”的結構,封鎖細胞間隙;ZO等則作為骨架連接跨膜蛋白和細胞骨架蛋白形成緊密連接,緊密連接蛋白的結構是否完整直接決定了上皮細胞屏障功能的完整性。緊密連接受到破壞,上皮細胞和內皮細胞通透性增加,可能是上呼吸道感染發生和發展的重要原因。受涼、氣候突變、淋雨、過度疲勞等外界因素都會加快本來已經存在于上呼吸道或從外界入侵上呼吸道的病毒或細菌的繁殖速度,造成患者全身或上呼吸道局部防御功能降低,進而誘發上呼吸道感染[45]。上述因素是否可導致緊密連接的破壞,尚缺乏強有力的證據支持。維持上呼吸道緊密連接的完整性,對于防治上呼吸道感染具有重要意義。但目前對緊密連接蛋白的研究大部分都集中于下呼吸道肺泡上皮細胞,對緊密連接蛋白在上呼吸道黏膜免疫中的作用機制尚不明確,值得進一步系統地深入研究。

