比色法測定巴西人參中齊墩果酸型皂苷含量*
韋貴云 ,李 芳 ,黃 程 ,許崇搖 △
(1.廣西壯族自治區婦幼保健院,廣西 南寧 530003; 2.廣西醫科大學藥學院,廣西 南寧 530021)
巴西人參 Pfaffia paniculata Pedersen為莧科巴西人參屬植物,原產于中美洲和南美洲,主要分布于巴西等熱帶雨林氣候帶的原生態地區[1],具有抗腫瘤[2]、抗缺血缺氧、抗炎鎮痛、保護胃黏膜、降血糖等藥理作用。其化學成分主要有琺菲亞酸及其苷類、三萜苷類、脫皮甾醇類激素(如脫皮甾酮)及苷類等[3],其中三萜類的齊墩果酸型皂苷是主要有效成分,含量較高,具有抗腫瘤、降血糖血脂、保肝、抑制胰脂肪酶和抗肥胖[4]等作用。有學者認為,可以單體皂苷(人參皂苷Ro)或以皂苷元作為對照品測定總皂苷含量[5],由于使用不同的對照品,皂苷含量測定結果也有不同。本研究中擬提取皂苷與皂苷元,分別采用人參皂苷Ro和齊墩果酸作為對照品,測定巴西人參中齊墩果酸型皂苷含量,比較2種方法的差異,為藥材質量控制與評價提供參考。現報道如下。
1 儀器與試藥
儀器:TV-1901型紫外-可見分光光度計(北京普析通用儀器有限公司);ATY224型電子分析天平(日本島津公司);ZRD-5210型電熱恒溫鼓風干燥箱(上海智城分析儀器制造有限公司);R1001N型旋轉蒸發儀(鄭州長城科工貿有限公司);KQ-500DE型數控超聲波清洗器(昆山市超聲儀器有限公司)。
試藥:巴西人參采集于廣西隆安縣廣西寶塔工業園小林基地,由廣西醫科大學朱丹副教授鑒定為莧科植物巴西人參 Pfaffia paniculata pedersen的干燥根,粉碎過篩干燥后,密封保存,備用;齊墩果酸標準品(上海阿拉丁生化科技股份有限公司,批號為0110088,純度為98%);人參皂苷Ro標準品(上海源葉生物科技有限公司,批號為 B21068,純度為 98%);石油醚、正丁醇、香草醛、冰醋酸、高氯酸均為分析純。
2 方法與結果
2.1 溶液制備
皂苷提取液[6]:取藥材粗粉1 g,精密稱定,置圓底燒瓶中,加入25 mL 80%乙醇回流提取2次,每次90 min,合并2次提取液,回收乙醇得到浸膏,加20 mL水溶解,用石油醚萃取3次,每次10 mL,棄石油醚層,水層用水飽和的正丁醇萃取4次,每次10 mL,合并正丁醇液,減壓回收正丁醇至干,用甲醇溶解并定容至100 mL。
皂苷元提取液:取巴西人參粗粉1 g,精密稱定,置圓底燒瓶中,加入25 mL 80%乙醇回流提取2次,每次90 min,過濾,取濾液,濾液合并減壓濃縮至約12 mL,加20%硫酸和水配成含質量體積比為2%H2SO4的溶液25 mL,加熱回流60 min,冷卻析晶,過濾,濾紙及不溶物用純水洗至中性,產物用甲醇溶解,并定容至50 mL。
對照品溶液:取人參皂苷Ro對照品10 mg,精密稱定,置10 mL容量瓶中,用甲醇溶解后定容,備用。取齊墩果酸對照品7.5 mg,精密稱定,置25 mL容量瓶中,用甲醇溶解后定容,備用。
2.2 薄層色譜鑒別
皂苷提取液:以皂苷對照品和皂苷提取液點板,以三氯甲烷-甲醇-水(12∶7∶1)為展開劑,展開,取出,晾干,噴10%硫酸乙醇,于105℃下加熱至斑點顯色清晰。結果顯示,雖然皂苷提取液中出現了與人參皂苷Rb1和人參皂苷Ro對照品比移值(Rf)相近的斑點,但是兩者在10%硫酸乙醇顯色出來的斑點顏色與皂苷提取液中的斑點顏色均有差異,結合文獻[7]報道的化學成分,并未見有分離到這2個化合物的報道,故該兩處顯現的斑點可能不是人參皂苷Rb1和Ro(見圖1)。
皂苷元提取液[8]:以皂苷元齊墩果酸對照品和皂苷元提取液點板,以三氯甲烷-乙酸乙酯-乙酸(10∶4∶0.2)為展開劑,展開,取出,晾干,噴10%硫酸乙醇,于105℃加熱至斑點顯色清晰。結果顯示,皂苷提取液經過水解成苷元后,明顯看出齊墩果酸的斑點(見圖1)。
2.3 最大吸收波長選擇
精密吸取皂苷和皂苷元提取液各0.2 mL,稀釋為0.4 g/L人參皂苷Ro和齊墩果酸對照品溶液各0.2 mL,分別置干燥試管中,揮干,加入5%香草醛-冰醋酸溶液 0.2 mL,高氯酸 0.8 mL,置 60 ℃水浴上加熱 15 min,流水冷卻后加入5 mL冰醋酸,搖勻,在400~700 nm波長范圍內掃描[7];另取未加入顯色劑的提取液和對照品溶液在同樣波長范圍內掃描,確保無吸收、干擾,以確定檢測波長[8-9]。顯色后,各提取液和對照品溶液在548 nm波長處均有最大吸收,而未加入顯色劑的提取液和對照品溶液在此處無吸收,故選擇548 nm作為測定波長。
2.4 方法學考察
顯色后溶液穩定性試驗[10]:分別取皂苷樣品溶液和皂苷元樣品溶液適量,揮干,按2.3項下方法操作顯色后,分別在 0,15,30,60,90,120 min 時測定吸光度。結果皂苷和苷元提取液吸光度的 RSD分別為1.12%和1.61%(n=6),表明樣品溶液顯色后在2 h內較穩定。
標準曲線制備:分別精密吸取人參皂苷Ro對照品貯備液 0.1,0.2,0.3,0.4,0.6 mL,分別置 5 支試管中,按2.3項下操作顯色后,以未加樣品的試劑作空白,在548 nm波長處測定,以吸光度(Y)為縱坐標、對照品質量濃度(X)為橫坐標繪制標準曲線,得標準曲線方程Y=0.008 9 X+0.004 2,R2=0.999 5(n=5)。分別精密吸取齊墩果酸對照品貯備液 0.1,0.2,0.3,0.4,0.5 mL,按上述方法操作,得標準曲線方程 Y=0.023 4 X-0.001 4,R2=0.999 5(n=5)。結果表明,人參皂苷 Ro與齊墩果酸質量濃度分別在 16.83~100.98 μg /mL 和5.07~30.40 μg /mL 范圍內與吸光度線性關系良好。
精密度試驗:精確吸取對照品溶液各0.2 mL,按2.3項下操作顯色后,于確定的波長下連續測定6次吸光度。結果的 RSD均為0(n=6),表明儀器精密度良好。
重復性試驗:取樣品1 g,精密稱定,共10份,分別按皂苷提取液和皂苷元提取液制備方法制備供試品溶液,各5份。按2.3項下方法顯色后,測定吸光度,計算皂苷含量。結果皂苷比色法測得平均含量為9.86%,RSD為 2.03%(n=5);苷元比色法測得平均含量為3.31%,RSD 為 1.81%(n=5)。表明方法重復性良好。
加樣回收試驗[11]:取6份藥材粗粉各1 g,依法制備皂苷提取液,按2.3項下方法顯色后,于548 nm波長處測定吸光度,計算齊墩果酸型皂苷含量,另取5 mL,分別加入提取液含量的80%,100%,120%的人參皂苷Ro對照品溶液,用甲醇定容于100 mL,每組平行2份。顯色后,測定,計算回收率。取6份藥材粗粉各1 g,提取,按2.3項下方法操作顯色后,于548 nm波長處測定吸光度,計算1 g巴西人參中齊墩果酸的含量。另取15 mL,分別加入提取液含量的80%,100%,120%的齊墩果酸對照品溶液,用甲醇定容于50 mL,每組平行2份,顯色后測定吸光度,計算回收率。結果見表1。
2.5 樣品含量測定
皂苷法及皂苷元法:取巴西人參樣品1 g,精密稱定,共取5份,依法提取,按2.3項下方法操作顯色后,于548 nm波長處測定吸光度,計算齊墩果酸型皂苷及齊墩果酸含量[12-13]。齊墩果酸型皂苷含量 =齊墩果酸含量×齊墩果酸型皂苷平均分子量/齊墩果酸分子量。
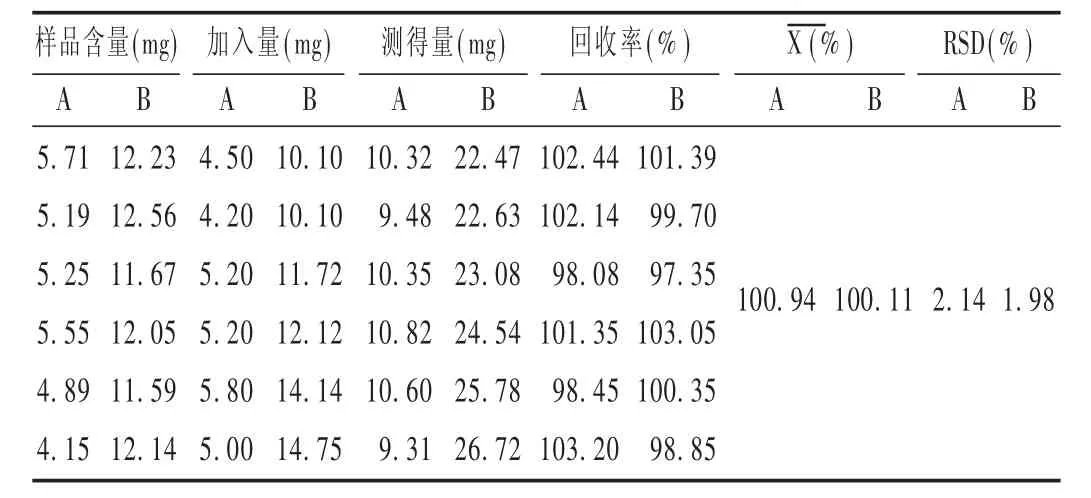
表1 加樣回收試驗結果(n=6)
巴西人參中齊墩果酸型皂苷主要有3種[7],即齊墩果酸-3-O-β-D-葡萄糖醛酸甲酯苷、齊墩果酸-3-O-β-D-葡萄糖醛酸苷、齊墩果酸-28-O-β-D-吡喃葡萄糖酯苷,相對分子質量分別為648,632,618,相差不大,液相峰強度相近,可認為藥材中齊墩果酸型皂苷的平均相對分子質量為三者平均值[13],即632.67。齊墩果酸的相對分子質量為456,齊墩果酸換算成齊墩果酸型皂苷的換算系數為1.39。結果見表2。

表2 皂苷比色法與苷元比色法測定齊墩果酸型皂苷含量結果(n=5)
3 討論
齊墩果酸型皂苷為具有明顯藥理活性的天然產物,目前認為甲戊二羥酸(MVA)途徑為其主要的生物合成途徑。巴西人參很可能也是通過MVA途徑合成的皂苷,即以糖酵解產物乙酰輔酶A為起始物,經甲戊二羥酸中間體一系列反應生成皂苷元齊墩果酸,再經過糖基化等反應產生皂苷。合成過程中,反應底物的不同將能形成結構相似而又不完全相同的一系列具有相似活性的代謝產物。因此,天然產物中皂苷的成分較復雜,難以選用單一或多個對照品對總皂苷含量進行評價[14]。皂苷的定量測定常用方法有高效液相色譜法、氣相色譜法和比色法等,前兩者可準確檢測各單一成分皂苷的含量;采用構型相似的皂苷作為對照品時,因其在紫外特定波長下具有共同的吸收,采用顯色法排除干擾后再用比色法檢測可得到較為合理的評價結果。
在巴西人參齊墩果酸型皂苷的含量測定中,人參皂苷Rb1屬原人參二醇型皂苷,人參皂苷Ro屬齊墩果酸型皂苷,選用人參皂苷Ro作為皂苷法測定的對照品比用Rb1更合理,但人參皂苷Ro的相對分子質量遠高于巴西人參中齊墩果酸型皂苷,將使結果比真實值要高很多。齊墩果酸型皂苷的水解產物為齊墩果酸,在適宜的水解條件下,參照藥材的化學成分分析[7]選用齊墩果酸作為苷元法的對照品測定巴西人參中齊墩果酸型皂苷的含量,結果更合理。本研究中采用皂苷法測得巴西人參中齊墩果酸型皂苷含量為9.956%,苷元法測得含量為3.232%。凌征柱等[15]研究發現,巴西人參中總皂苷含量為6.54%。可見,齊墩果酸型皂苷作為總皂苷的一部分,以苷元比色法測得的含量更準確,即巴西人參中齊墩果酸型皂苷的含量為3.232%。

