四味顆粒微生物限度檢查方法學驗證*
胡 婧,鄧 莉,胡 斌,馬 攀,陳勇川
(陸軍軍醫大學第一附屬醫院藥學部,重慶 400038)
藥品的微生物限度檢查是控制藥品質量的一項重要檢查項目,是制劑安全性檢查的重要組成部分[1]。自2005年版《中國藥典》開始,就對微生物限度檢查法的驗證提出了具體要求:“當進行藥品無菌檢查或微生物限度檢查時,應進行方法學驗證,否則不能出具符合《中國藥典》規定的結論。”2015年版《中國藥典》相對于2010年版在非無菌產品微生物限度檢查方面做了較大改動,修訂后的微生物限度檢查方法與《美國藥典》要求基本一致[2-3],在中國制藥的國際化進程上又向前邁進了一大步。四味顆粒作為我院自制制劑,功能活血化瘀、軟堅散結、鎮痛消脹,臨床運用在各種乳腺增生性疾病的治療已多年,療效確切。為確保其微生物限度檢查質量安全性達到要求[4],按照 2015年版《中國藥典(四部)》附錄 1105,1106,1107 項下要求[5],對四味顆粒的微生物限度檢查法進行驗證。由于四味顆粒為中藥復方制劑,其含有多種中藥成分,其中山楂對微生物具有抑菌作用,應消除其抑菌性后再進行檢查,故采用稀釋法和常規法相結合進行四味顆粒的微生物限度檢查,以消除制劑中山楂的抑菌性。現報道如下。
1 儀器與材料
儀器:Thermo Scientific-1381 A2型生物安全柜(美國Thermo公司);BL-150型電子天平(梅特勒托利多儀器<上海 >有限公司);LRH-150F型生化培養箱(重慶四達實驗儀器公司);MJ-180-Ⅱ型霉菌培養箱(上海躍進醫療器械有限公司);LDZX-75KBS型、LDZF-30KB-Ⅱ型立式壓力蒸汽滅菌器(上海申安醫療器械有限公司)。
試藥:四味顆粒(醫院制劑,批號分別為180205,180319,180402,規格為每包 10 g);pH 7.0 氯化鈉 - 蛋白胨緩沖液(北京三藥科技開發公司,批號為170519);0.9%無菌氯化鈉溶液(西南藥業股份有限公司,批號為17034002)。
菌種:金黃色葡萄球菌[CMCC(B)26003]、枯草芽孢桿菌[CMCC(B)63501]、銅綠假單胞菌[CMCC(B)10104]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、大腸埃希菌[CMCC(B)44102],均由中國食品藥品檢定研究院提供,試驗所用菌株均為第3代。
培養基:胰酪大豆胨液體培養基(批號為161205),胰酪大豆胨瓊脂培養基(批號為1612192),沙氏葡萄糖液體培養基(批號為170815),沙氏葡萄糖瓊脂培養基(批號為1702134),麥康凱液體培養基(批號為161205),麥康凱瓊脂培養基(批號為161212),均由北京三藥科技開發公司提供。
2 方法與結果
2.1 計數培養基適應性檢查[6]
分別取金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌及黑曲霉菌的菌液,均不大于100 cfu,分別注入無菌平皿中,立即傾注胰酪大豆胨瓊脂培養基,每株試驗菌平行制備2個平皿,混勻,凝固,置35℃培養3 d,計數;分別取白色念珠菌、黑曲霉的菌液,均不大于100 cfu,分別注入無菌平皿中,立即傾注沙氏葡萄糖瓊脂培養基,每株試驗菌平行制備2個平皿,混勻,凝固,置25℃ 培養5 d,計數。同時,用相應對照培養基替代被檢培養基進行上述試驗。結果見表1。
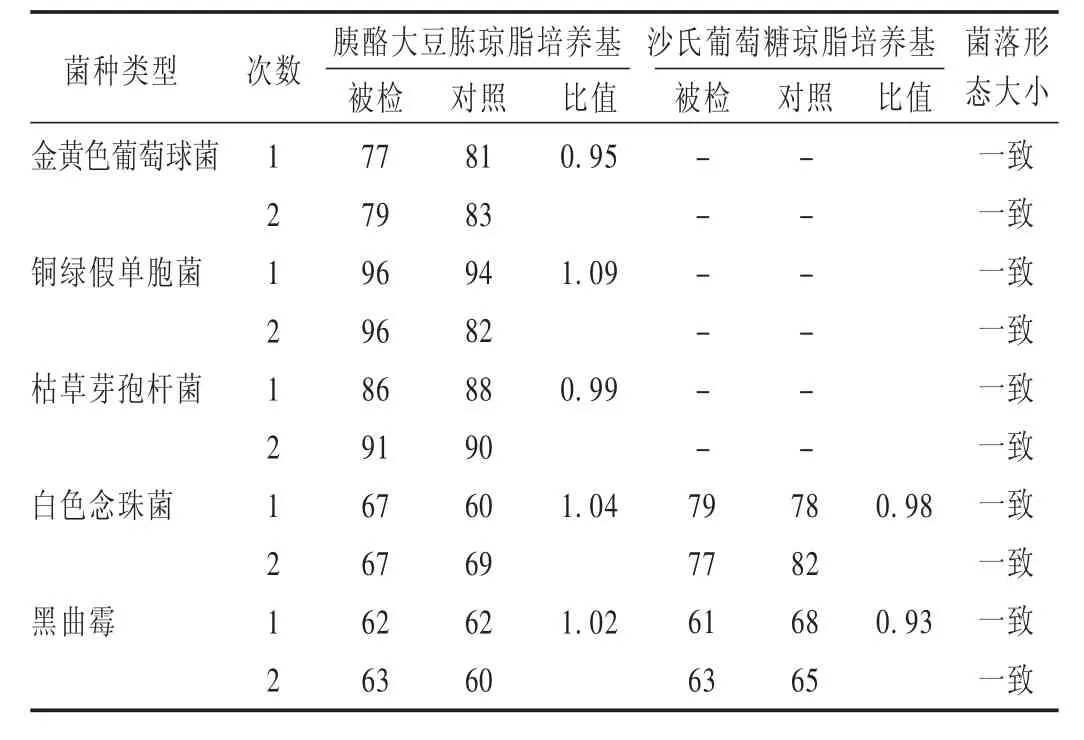
表1 培養基適用性檢查結果(cfu,n=2)
2.2 常規法適用性試驗
2.2.1 菌液制備
取經胰酪大豆胨液體培養基35℃培養24 h的金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、大腸埃希菌液體培養物,分別用0.9%無菌氯化鈉溶液稀釋成適宜濃度的菌懸液,作活菌計數備用。
取經沙氏葡萄糖液體培養基25℃培養48 h的白色念珠菌液體培養物,用0.9%無菌氯化鈉溶液稀釋成適宜濃度的菌懸液,作活菌計數備用。
取經沙氏葡萄糖瓊脂培養基25℃培養7 d的黑曲霉菌斜面培養物,加入含0.05%(mL/mL)聚山梨酯80的0.9%無菌氯化鈉溶液,將孢子洗脫,吸出孢子懸液(用管口帶有薄的無菌棉花或紗布能過濾菌絲的無菌毛細吸管),置無菌試管內,用0.9%無菌氯化鈉溶液制成適宜濃度的孢子懸液。
2.2.2 供試品溶液制備
取樣品(批號為 180205)10 g,加 pH 7.0 無菌氯化鈉-蛋白胨緩沖液至100 mL,搖勻,制成1∶10的供試品溶液。
2.2.3 回收率測定
試驗組:取上述1∶10供試品溶液9.9 mL,共5份,每份分別加入金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌及黑曲霉菌菌懸液各0.1 mL,使每1 mL含菌落數不大于100 cfu,混勻,吸取各染菌供試品溶液1 mL注入平皿中,每份平行制備2個平皿,傾注胰酪大豆胨瓊脂培養基,置35℃培養3 d,測定需氧菌總數。取上述1∶10供試品溶液 9.9 mL,共 2份,每份分別加入白色念珠菌和黑曲霉試驗菌菌懸液各0.1 mL,使每1 mL含菌數不大于100 cfu,混勻,吸取各染菌供試品溶液1 mL置平皿中,每份平行制備2個平皿,傾注沙氏葡萄糖瓊脂培養基,置25℃培養5 d,測定霉菌及酵母菌總數。
菌液對照組:吸取pH 7.0無菌氯化鈉-蛋白胨緩沖液9.9 mL,共5份,每份分別加入金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉菌菌懸液各0.1 mL,使每 1 mL含菌落數不大于100 cfu,混勻,分別吸取1 mL置平皿中,每株試驗菌平行制備2個平皿,傾注胰酪大豆胨瓊脂培養基;另取pH 7.0無菌氯化鈉-蛋白胨緩沖液9.9 mL,共2份,每份分別加入白色念珠菌、黑曲霉菌菌懸液各0.1 mL,使每1 mL含菌數不大于100 cfu,混勻,分別吸取1 mL置平皿中,每株試驗菌平行制備2個平皿,傾注沙氏葡萄糖瓊脂培養基。
供試品組:吸取上述1∶10供試品溶液1 mL置平皿,平行制備4個平皿,其中2個傾注胰酪大豆胨瓊脂培養基,作為測定需氧菌總數的供試品組;另外2個傾注沙氏葡萄糖瓊脂培養基,作為測定基霉菌和酵母菌總數的供試品組。
稀釋液組:取相應量稀釋液替代供試品溶液,同試驗組操作,按試驗組方法測定其菌落數,平行制備2個平皿。
結果:依照公式計算加菌回收率。試驗組菌比值=(試驗組平均菌落數-供試品組的平均菌落數)/菌液對照組的平均菌落數。按2015年版《中國藥典(四部)》附錄 1105,1106,1107項下[4]規定進行結果判斷,回收率比值應為0.5~2。需氧菌總數驗證試驗結果見表2,霉菌和酵母菌總數見表3。可見,常規法可用于霉菌和酵母菌的計數,回收率為 0.5~2.0;而對于細菌的計數,采用常規法檢查時,供試品溶液對金黃色葡萄球菌、枯草芽孢桿菌的回收率均低于0.5,不符合規定。故本品對細菌的計數應重新選擇適當的方法,先消除其抑菌活性后再進行驗證。
2.3 稀釋法(1∶50)適用性試驗
2.3.1 菌液制備
制備方法同 2.2.1 項。
2.3.2 供試品溶液制備
取樣品10 g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 mL,搖勻,制成1∶10的貯備液;再取20 mL,加 pH 7.0無菌氯化鈉 -蛋白胨緩沖液至 100 mL,搖勻,制成1∶50的供試品溶液。
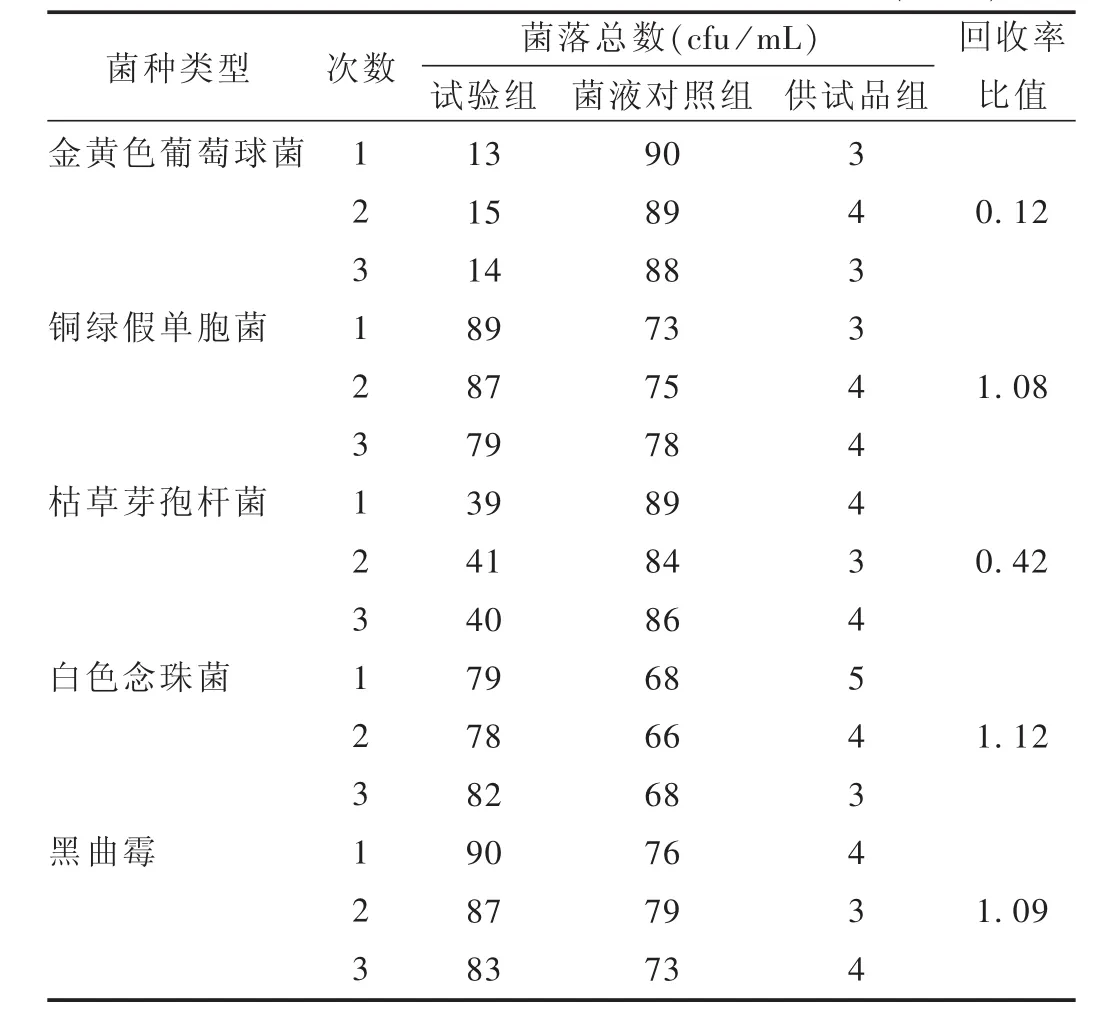
表2 1∶10供試品溶液需氧菌總數回收率比值(n=3)
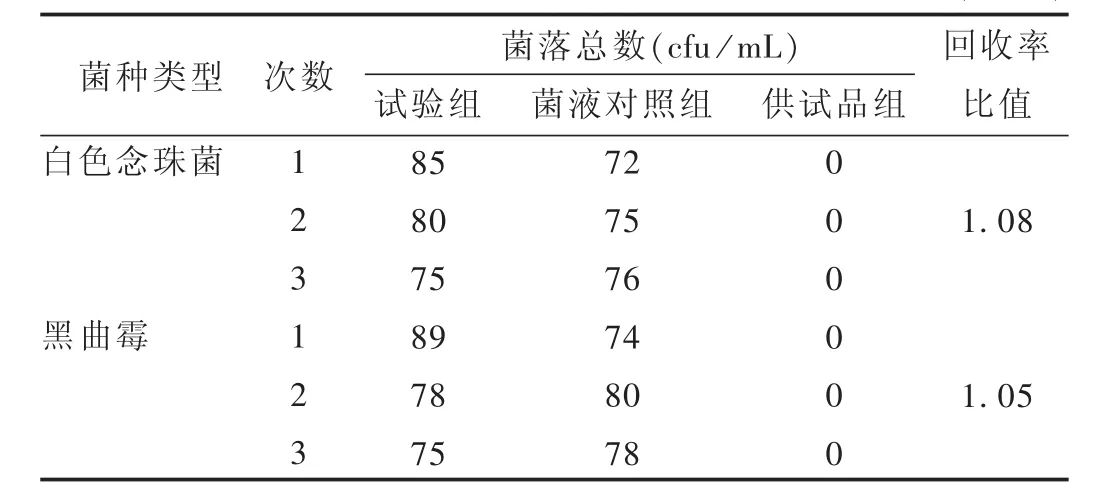
表3 1∶10供試品溶液霉菌和酵母菌回收率比值(n=3)
2.3.3 回收率測定
試驗組:取上述1∶50供試品溶液9.9 mL,共5份,每份分別加入金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌及黑曲霉菌菌懸液各0.1 mL,使每1 mL含菌落數不大于100 cfu,混勻,吸取各染菌供試品溶液1 mL置平皿中,每份平行制備2個平皿,傾注胰酪大豆胨瓊脂培養基,置35℃培養3 d,測定需氧菌總數。
菌液對照組:吸取pH 7.0無菌氯化鈉-蛋白胨緩沖液9.9 mL,共5份,每份分別加入金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉菌菌懸液各 0.1 mL,使每1 mL含菌落數不大于100 cfu,混勻,分別吸取1 mL置平皿中,每株試驗菌平行制備2個平皿,傾注胰酪大豆胨瓊脂培養基。
供試品組:吸取上述1∶50供試品溶液1 mL置平皿中,平行制備2個平皿,傾注胰酪大豆胨瓊脂培養基,作為測定需氧菌總數的供試品組。
稀釋液組:取相應量稀釋液替代供試品溶液,同試驗組方法操作,依法測定其菌落數,平行制備2個平皿。
結果:需氧菌總數稀釋法驗證試驗結果見表4。可見,采用常規法,控制菌能正常檢出,陰性對照未檢出。符合2015年版《中國藥典(四部)》微生物限度檢查控制菌檢查驗證要求,所以常規法可用于四味顆粒的控制菌檢查。可見,金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌的回收率為 0.5~2.0,符合規定,本品細菌計數可采用稀釋法(1∶50)。

表4 1∶50供試品溶液需氧菌總數回收率比值(n=3)
2.4 控制菌(大腸埃希菌)檢查
試驗組:取2.2.2項下 1∶10供試品溶液 10 mL及每1 mL含菌量不大于100 cfu的大腸埃希菌菌懸液,同時加入100 mL胰酪大豆胨液體培養基中,混勻,35℃培養24 h。取上述培養物1 mL接種至100 mL麥康凱液體培養基中,42℃培養24 h。取麥康凱液體培養物劃線接種至麥康凱瓊脂培養基平板上,35℃培養24 h,觀察結果。
菌液對照組:不加供試品溶液,其余操作與試驗組相同。
供試品組:取2.2.2項下 1∶10供試品溶液10 mL,以稀釋液代替菌液,同試驗組方法操作。
稀釋液組:以稀釋液代替供試品溶液,不加菌液,其余操作方法與試驗組相同。
結果:觀察其菌落形態。驗證結果見表5。

表5 大腸埃希菌檢查結果
2.5 樣品微生物限度檢查
采用稀釋法(1∶50)進行需氧菌總數的檢查,常規法進行霉菌和酵母菌總數及控制菌的檢查,對3批樣品進行檢驗,結果見表6。可見,四味顆粒的微生物限度檢查方法為需氧菌總數檢查采用稀釋法(1:50),霉菌和酵母菌總數及控制菌檢查可采用常規法。結果表明,建立的檢查方法符合規定,可用于四味顆粒微生物限度的檢查。

表6 3批樣品微生物限度檢查結果(cfu/mL)
3 討論
中成藥組分復雜,劑型眾多,微生物檢測方法的適用性試驗就顯得更為重要[6-8]。四味顆粒為我院治療乳腺增生類疾病的常用藥物,臨床用量極大,必須對制劑的安全性加以控制,而微生物限度檢查則是安全性檢查的重要環節。相對于前幾版藥典,2015年版《中國藥典》在微生物限度檢查方法和指導原則上均做出了較大修訂,增加了供試品制備中的稀釋液種類,采用胰酪大豆胨液體培養基和胰酪大豆胨瓊脂培養基取代了營養肉湯和營養瓊脂培養基;采用沙氏葡萄糖瓊脂培養基取代了玫瑰紅鈉培養基檢測霉菌與酵母菌總數,相對于2010年版所采用的培養基具有良好的廣譜性,對目標微生物的選擇性低,有利于微生物的修復與生長,提高了檢出率[9-10];在染菌方式上由試驗菌最后加入改為配制樣品時即加入試驗菌,充分模擬了樣品受微生物污染的狀態,更能真實地體現樣品的受污染程度,從而減少實驗室之間和檢驗人員之間對結果的判斷誤差[11]。本研究中則是在原有微生物限度檢查方法基礎上按照新版指導要求重新建立四味顆粒的微生物限度檢查方法,并對其進行驗證,建立了符合規定的微生物限度檢查方法,以便在日常生產中更好地對藥物制劑質量進行監督和把控,保證制劑質量的安全性和穩定性,保障廣大人民群眾的用藥安全。
四味顆粒由山楂、雞血藤、麥芽、通草4味中藥制成。山楂具有一定的抗菌活性,對多數致球菌和桿菌具有抑制作用,以山楂核提取物為主要殺菌成分的皮膚消毒劑,對大腸桿菌,金黃色葡萄球菌、銅綠假單胞菌、白色念珠菌具有較好的殺菌效果,且穩定性較好[12];在對14種中藥乙醇提取物對大腸桿菌的體外抑菌試驗中,山楂表現出了良好的抑菌能力[13]。本研究中,采用常規法進行需氧菌總數檢查時,回收率均低于0.5,制劑顯示出了對金黃色葡萄球菌、枯草芽孢桿菌等需氧菌的抑菌作用,因此需抑制其抗菌活性。一般來說,中藥制劑采用稀釋法和薄膜過濾法以消除其抑菌活性[14-15],采用稀釋法(1 ∶20,1 ∶50,1 ∶100)3 個稀釋級考察,結果 1 ∶50的回收率可達到0.5~2.0,可消除其抑菌活性;而在進行控制菌檢查時,采用常規法制劑卻未顯示出對大腸埃希桿菌的抑菌活性,推測本制劑在制備過程中,抑制大腸桿菌的成分濃度未達到有效地最低抑菌濃度。由于中成藥大多為復方制劑,且經過制備過程,藥理活性也會發生變化,因此個性化地對中藥制劑進行微生物限度檢查方法的建立及驗證顯得尤為重要,不僅能避免由于其本身的抑菌活性掩蓋了藥品制劑本身的受污染程度,還能簡化操作步驟,提高檢出效率。

