IL-31通過調控TGF-β1/Smad4信號通路促進骨質疏松的機制研究
郝 喆 楊文靜 倪 娟
(武漢市第四醫院風濕免疫科,武漢 430033)
骨質疏松是骨代謝障礙的一種全身性骨骼疾病,其特征在于骨組織的微小結構退化和骨量的減少[1]。過度的骨吸收和/或不充分的骨形成易出現骨脆性增加和骨折發生[2]。破骨細胞和成骨細胞的動態改變在骨質平衡和骨質疏松的過程中發揮著重要的作用[3]。機體免疫細胞分泌的細胞因子可通過促進破骨細胞生成和抑制成骨細胞分化而促進骨質丟失[4]。IL-31屬于gp130/IL-6細胞因子家族,其受體在各器官組織中分布廣泛,免疫細胞和非免疫細胞中均存在IL-31受體,IL-31參與免疫調節、炎癥反應、髓系造血等多種生理及病理過程[5],但IL-31在骨質疏松中的作用尚不清楚。因此本研究主要探討IL-31在骨質疏松患者血清中的表達情況,并通過骨質疏松小鼠模型及細胞學實驗探討IL-31調控骨質疏松的分子機制。
1 材料與方法
1.1材料
1.1.1病例資料 共納入2015年1月~2016年12月我院收治的100例骨質疏松癥患者為研究對象(研究組),其中男性29例、女性71例,年齡51~84歲,平均(66.4±13.3)歲。另按年齡、性別配對選取100例同期在本院健康體檢中心體檢的健康人群(對照組),其中男性29例、女性71例,年齡51~84歲,平均(65.1±12.9)歲。
1.1.2納入及排除標準 研究組患者均符合骨質疏松診斷標準:即:①臨床表現:出現周身疼痛、身高降低、駝背、脆性骨折和呼吸系統受損等;②骨密度檢查:骨密度在年輕成人平均值2.5 SD以下(T值<-2.5 SD)。排除標準:①長期營養不良或低鈣飲食;②伴有系統性疾病;③惡性腫瘤;④影響骨代謝藥物服用史;⑤代謝性疾病;⑥長期臥床。
1.1.3試劑與儀器 主要試劑包括高糖DMEM培養基、胎牛血清(Gibco,美國),鏈霉素、青霉素鼠二抗和兔二抗、CCK8檢測試劑盒(碧云天,上海),人IL-31 ELISA試劑盒轉染試劑Lipofectamine 2000(Thermo Fisher,美國),ALP檢測試劑盒(Beckman,美國),IL-31、TGF-β1、Smad4、p-Smad4和Actin抗體(Cell Signaling technology,美國),Annexin V/PI凋亡檢測試劑盒(BD,美國)。鼠源IL-31 qPCR引物(正向5′-TCCTGATGTTCCCAA-CCCTG-3′、反向5′-TTAGGACCACGTCTTCTGTGT-3′)由上海生工生物合成。IL-31 shRNA (shIL-31)及對照shRNA(shCon)購自上海吉凱基因。C57BL/6J野生型小鼠、C57BL/6J背景的IL-31基因敲除小鼠購自武漢大學實驗動物中心,小鼠成骨細胞MC3T3-E1購自武漢大學典型培養物保藏中心。主要設備包括細胞培養箱、生物安全柜、Biotek酶標儀、流式細胞儀、Bio-Rad垂直電泳儀、Bio-Rad Western blot化學發光成像系統、Roche LightCycler 480實時熒光定量PCR儀。
1.2方法
1.2.1人外周血IL-31濃度測定 收集研究組和健康對照組志愿者的空腹血,離心分離上清,嚴格按照IL-31 ELISA試劑盒說明書進行操作、定量。
1.2.2骨質疏松小鼠模型構建 取健康的C57BL/6J野生型和IL-31敲除小鼠各30只,均為雌性、4~5周齡,隨機分為2組,即卵巢切除術組(OVX)15只、假手術組(Sham)15只,分別進行手術操作。術后8周通過眼球取血獲得并分離小鼠血清,測定血清鈣離子、磷、ALP濃度;取OVX及Sham組小鼠的雙側股骨進行病理切片分析股骨組織形態學結構,分離脊柱并通過骨密度儀檢測脊柱骨密度值。
1.2.3BMSCs的體外培養與檢測 采用全骨髓法培養BMSCs細胞。細胞分離后置于37℃、5%CO2的培養箱中培養,每3 d換液1次,待細胞密度達到80%~90%時,用0.25%的胰酶進行消化傳代。當細胞傳至第3代時,取各組BMSCs,計數細胞并調整濃度至1×105個/ml,接種于96孔板中,每孔100 μl細胞懸液、設置6個復孔。接種后每48 h換液一次,并于第2、4、6天以CCK8法檢測各組細胞在450 nm波長處的吸光度值,判斷細胞增殖活力。在細胞培養第4天,移除培養基,裂解細胞后通過全自動生化分析儀測定每孔細胞的ALP濃度。另取第3代BMSCs細胞,提取總蛋白并進行蛋白定量,Western blot法檢測TGF-β1、Smad4和p-Smad4的表達,并以Actin為內參。
1.2.4MC3T3-E1細胞轉染及檢測 采用脂質體Lipofectamine 2000轉染法將shIL-31和shCon轉染至MC3T3-E1細胞,轉染48 h后,計數細胞并接種于96孔板中,每隔48 h通過CCK8法測定細胞增殖;另通過流式細胞儀檢測細胞凋亡,提取細胞總RNA和總蛋白,檢測IL-31的敲除效率和相應蛋白表達水平。
1.3統計學分析 本研究所有實驗組均重復3次,所有數據采用SPSS22.0軟件分析,計量資料以獨立樣本t檢驗進行兩兩比較,P<0.05為差異具有統計學意義。
2 結果
2.1骨質疏松患者與健康人血清IL-31濃度比較 骨質疏松患者的血清IL-31平均濃度(43.12±4.97)pg/ml顯著高于健康對照組人群的血清IL-31平均濃度(19.58±2.09)pg/ml,差異具有統計學意義(P<0.05,圖1A)。進一步將骨質疏松患者分為輕度骨質疏松(37例,T值<-2.5 SD)和重度骨質疏松(63例, T值<-2.5 SD且有一次以上的骨質疏松性骨折)后發現,重度骨質疏松患者的血清IL-31平均濃度(51.52±6.90)pg/ml顯著高于輕度骨質疏松患者的血清IL-31平均濃度(33.75±6.16)pg/ml,差異具有統計學意義(P<0.05,圖1B)。
2.2骨質疏松小鼠模型的建立 通過Sham和OVX手術建立骨質疏松及對照模型小鼠。術后8周血清學指標檢測顯示,野生型小鼠、IL-31敲除小鼠的OVX手術組的血鈣離子和血磷均高于Sham手術組、但ALP水平顯著低于Sham手術組(均P<0.05,見表1)。接受OVX手術的IL-31敲除小鼠血鈣離子和血磷濃度均明顯低于接受OVX手術的野生型小鼠、而ALP高于野生型小鼠(均P<0.05,見表1)。
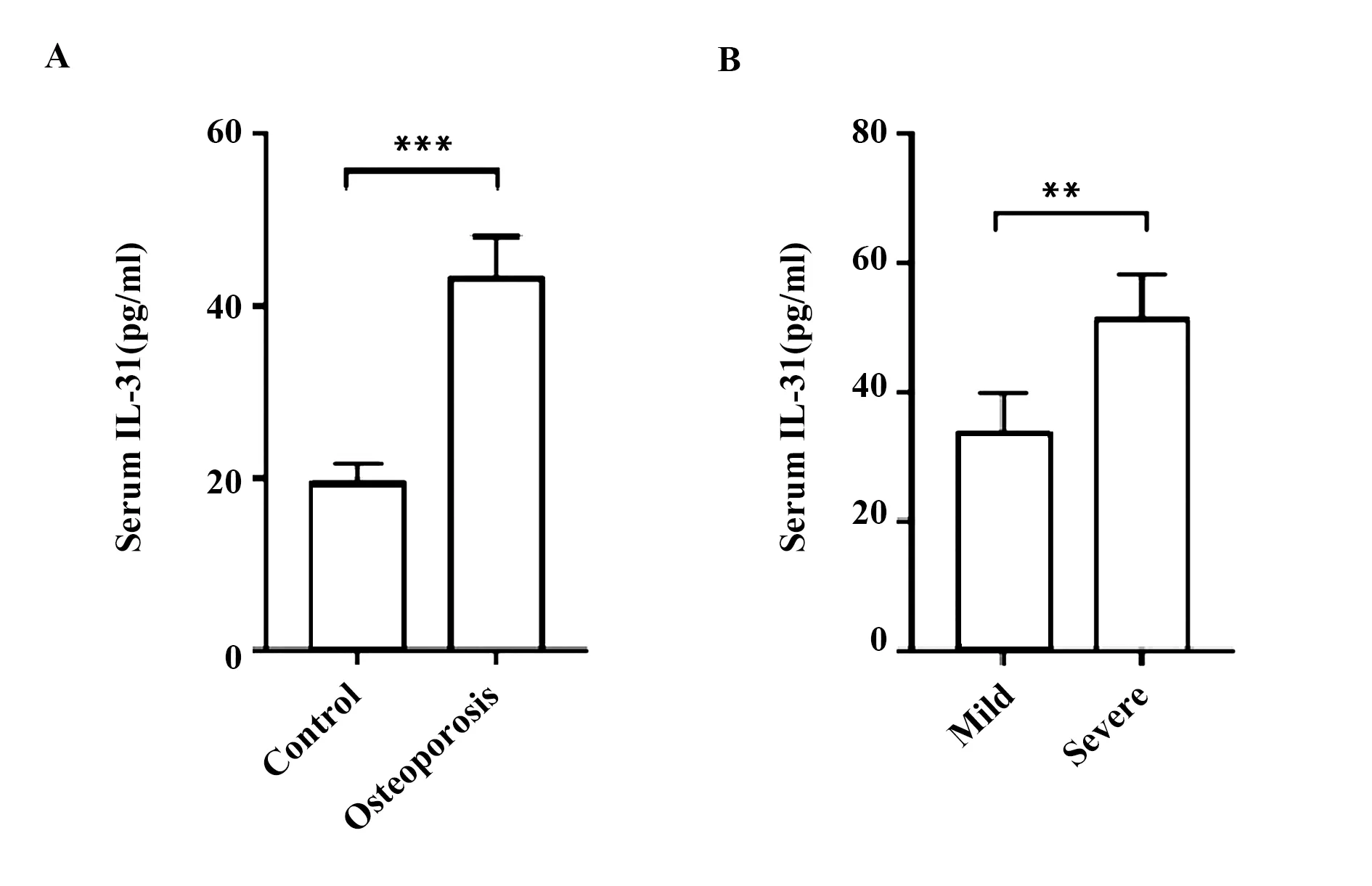
圖1 骨質疏松患者與健康人血清IL-31濃度比較Fig.1 Comparison of serum IL-31 between osteoporosis patients and healthy control groupNote: **.P<0.01,***.P<0.001.
術后8周小鼠股骨組織(圖2A)病理切片及脊柱骨密度結果(圖2B)顯示,接受OVX手術的野生型小鼠和IL-31敲除小鼠均出現骨組織形態結構破壞和骨密度降低,但IL-31敲除小鼠的骨組織形態學結構破壞程度和骨密度降低程度均較野生型小鼠輕(P<0.05)。
2.3BMSCs增殖及相關蛋白水平檢測 細胞增殖檢測結果顯示接受OVX手術的IL-31敲除小鼠組BMSCs的體外增殖能力顯著高于Sham手術的IL-31敲除小鼠組和接受OVX手術的野生型小鼠組(P<0.05,圖3A);ALP檢測結果顯示IL-31能夠抑制ALP的合成(P<0.05,圖3B)。Western blot結果顯示接受OVX手術的IL-31敲除小鼠BMSCs細胞的TGF-β1、Smad4磷酸化水平均顯著高于接受OVX手術的野生型小鼠組(圖3C)。
2.4IL-31對小鼠成骨細胞MC3T3-E1凋亡影響 MC3T3-E1細胞轉染IL-31 shRNA后,IL-31的mRNA水平顯著降低(圖4A),MC3T3-E1細胞增殖加快(圖4B)、凋亡減少(圖4C),TGF-β1和Smad4磷酸化水平升高(圖4D)。
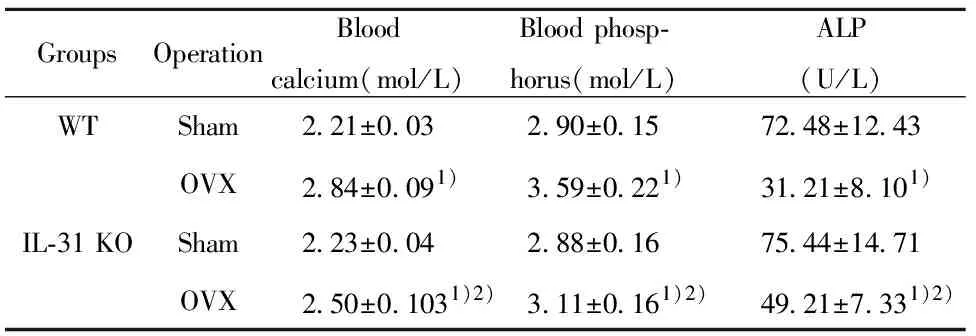
表1 術后8周小鼠血清學指標(n=15)Tab.1 Serum biomarker in mouse model in 8 weeks post-surgery(n=15)
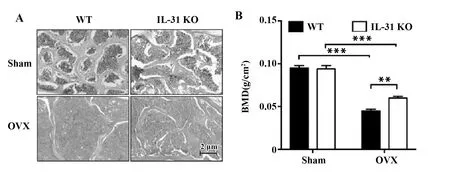
圖2 小鼠股骨病理切片及脊柱骨密度比較Fig.2 Comparison of pathological sections of femur and spinal bone density
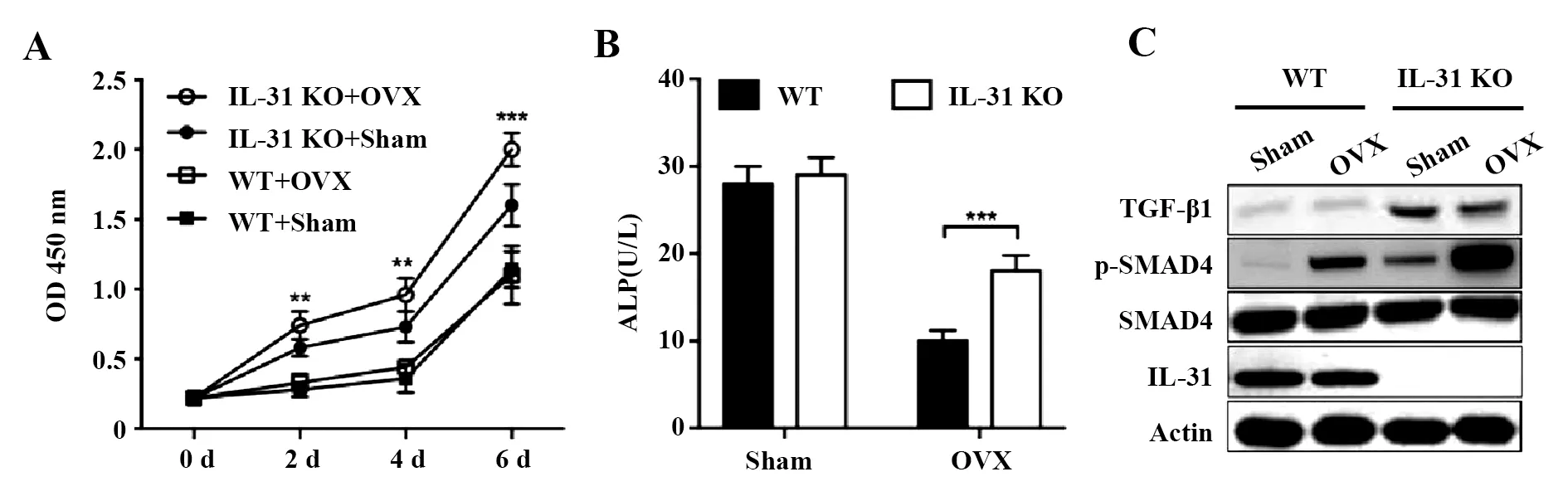
圖3 BMSCs的增殖、ALP合成、TGF-β1表達和Smad4激活檢測比較Fig.3 Comparison of BMSCs proliferation,ALP synthesis,TGF-β1 expression and Smad4 activation of BMSCs
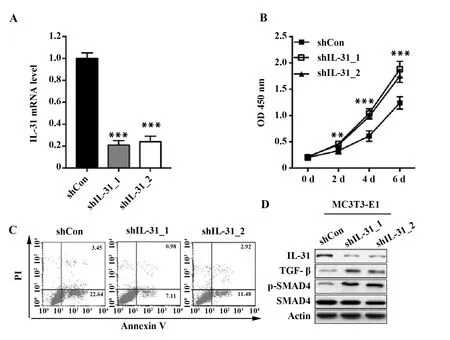
圖4 IL-31對小鼠成骨細胞MC3T3-F1增殖和凋亡的影響Fig.4 Influence of IL-31 on proliferation and apoptosis of mice osteoblast MC3T3-E1
3 討論
近年來研究認為,機體免疫系統能夠通過生理和病理過程調節骨骼重塑而介導骨質疏松的發生,從而提出了骨質疏松是一種慢性免疫性疾病的概念[6]。盡管骨密度降低與多種病理狀態有關,但衰老和雌激素缺乏被普遍認為是骨質疏松發生的兩個重要危險因素[7]。但也有研究報道了血清中的部分細胞因子與骨質疏松癥的發生發展密切相關,如絕經后骨質疏松患者可發現血清IFN-γ、IL-6和IL-17等細胞因子的升高[8]。而在本研究中,我們發現骨質疏松患者的血清IL-31水平顯著高于健康人群,并且隨著骨質疏松嚴重程度的增加,血清IL-31水平也明顯增加,提示IL-31水平的升高可能促進骨質疏松的發生和惡化。另外,通過骨質疏松小鼠模型的建立,我們發現IL-31敲除小鼠骨質疏松嚴重程度顯著低于野生型小鼠,提示抑制IL-31的生成和分泌能夠減緩骨質疏松的進展。
多種細胞因子和轉錄因子參與骨質疏松的發生進展,其中一些因子受IL-31的調節。如IL-31與細胞膜上的受體形成受體配體復合物后能夠激活受體酪氨酸激酶,從而激活細胞內的信號轉導,包括STAT3、Akt、NF-κB、MAPK和PI3K等細胞內信號轉導通路[9],而這些信號通路已被證實參與骨骼重塑和炎癥發生、介導破骨細胞增殖和活化、促進成骨細胞衰老和凋亡[10]。也有研究表明,IL-31能夠通過免疫細胞分泌促炎因子(如IL-1β、IL-6)、趨化因子(如CXCL1、CXCL8、CCL2和CCL18等)和基質金屬蛋白酶等,從而作用于破骨細胞而促進其分化、趨化,并增強破骨細胞的功能而介導骨骼重塑發生,提示IL-31在促進破骨細胞前體細胞的分化過程起到重要的作用[11]。
TGF-β1是細胞和組織中含量最豐富的TGF-β超家族成員。在骨代謝過程中,TGF-β能夠介導骨形成和骨吸收之間的偶聯,增強成骨細胞的數量和活性,并刺激其增殖和分化,調節骨重建,維持骨代謝平衡[12]。另外,TGF-β1還能夠促進破骨細胞凋亡、抑制破骨細胞的增殖。骨質疏松患者骨小梁內TGF-β 含量下降,如果給予外源性TGF-β補充,可使骨形成增加、破骨細胞的破骨作用減弱[13]。而Smad蛋白家族是TGF-β細胞內信號轉導因子,能夠通過與細胞核內其他轉錄因子結合或直接調控DNA轉錄而介導TGF-β的信號轉導。Smad4是TGF-β1各類信號轉導通路中的共同介質,磷酸化的Smad4是其活性形式,介導TGF-β1的信號傳遞[14]。在本研究中,通過原代BSMCs細胞和小鼠MC3T3-E1成骨細胞的體外研究發現,抑制IL-31后能夠增強細胞內TGF-β1的表達,并增強TGF-β1下游的Smad4的磷酸化從而促進BSMCs細胞和MC3T3-E1成骨細胞增殖,并抑制凋亡發生,提示IL-31能夠通過反向調控成骨細胞內的TGF-β1/Smad4通路來抑制成骨細胞的增殖和活性。
綜上所述,本研究發現骨質疏松患者體內IL-31水平明顯升高,并且升高程度與骨質疏松的嚴重程度相關。通過骨質疏松小鼠模型和細胞學研究證實,IL-31的下調能夠活化TGF-β1/Smad4信號通路而增強成骨細胞增殖活力而抑制骨質疏松發生。因此抑制患者IL-31水平可能是預防骨質疏松形成或程度加重的潛在治療靶點。

