陌生氧化還原反應方程式考查的多維視角
洪茲田 陳女婷

氧化還原反應是高中化學的基本概念和基本理論。縱觀近幾年的全國卷或各省市自主命題的高考化學試題,對氧化還原反應知識的考查力度極大。所以,得氧化還原反應者得天下。在氧化還原反應知識考查的多個視角中,涉及陌生氧化還原反應方程式(含電極反應式)的書寫所占比例較大。陌生氧化還原反應方程式的書寫常涉及以下四種類型:課本方程式的類比遷移;給出部分反應物和生成物;從流程中尋找反應物和生成物;陌生的電極反應式。結合近幾年全國卷及各省市自主命題的經典考題,對該類題型的考查視角和解題方法進行總結歸納,并通過變式訓練進行鞏固,希望為陌生氧化還原反應方程式的復習提供參考。
視角一、課本方程式的類比遷移——似曾相識燕歸來
【典例剖析】(2014·全國Ⅱ卷,節選)PbO2與濃鹽酸共熱生成黃綠色氣體,反應的化學方程式為__________________。
解析:根據題給信息,黃綠色氣體為氯氣。將實驗室用二氧化錳和濃鹽酸反應制取氯氣的原理MnO2+4HCl(MnCl2+Cl2↑+2H2O進行類比遷移,即可寫出PbO2與濃鹽酸反應的化學方程式。
答案:PbO2+4HClPbCl2+Cl2↑+2H2O
【方法歸納】重視研究課本中知識、原理或方法的原型,探析并建立所考查的內容與所學內容原型之間的聯系,并對原型進行合理的遷移應用,以此來解決“新問題”。
【變式訓練】(2015·全國I卷,改編)碘及其化合物在合成殺菌劑、藥物等方面具有廣泛用途。大量的碘富集在海藻中,用水浸取后濃縮,再向濃縮液中加MnO2和H2SO4,即可得到I2。該反應的離子方程式為_____________。
解析:海藻中的碘元素以碘化物(I-)形式存在,反應中I-被MnO2氧化為I2,氧化劑MnO2被還原為MnSO4。由于反應在酸性介質(H+)中進行可將二氧化錳和濃鹽酸反應生成氯氣原理進行類比遷移,即可得到該反應的離子方程式: 2I-+MnO2+4H+=Mn2++I2+2H2O。
答案:2I-+MnO2+4H+=Mn2++I2+2H2O
視角二、給出部分反應物和生成物——猶抱琵琶半遮面
【典例剖析】(2016·全國Ⅱ卷,節選)丁組同學向盛有H2O2溶液的試管中加入幾滴酸化的FeCl2溶液,溶液變成棕黃色,發生反應的離子方程式為_________________________。
解析:(1)根據題給信息,FeCl2→FeCl3,Fe由+2價→+3價,FeCl2做還原劑,FeCl3做氧化產物。根據氧化還原反應規律,推出H2O2做氧化劑,O的化合價由-1價→-2價,得到的還原產物為H2O2。即:Fe2++H2O2→Fe3++H2O;(2)Fe由+2價→+3價(升1),O的化合價-1價→-2價(降1)。根據化合價升降總數相等,Fe2+、Fe3+、H2O2、H2O的相應化學計量數分別為2、2、1、2,即2Fe2++H2O2→2Fe3++2H2O;(3)上式中,左邊的電荷總數為+4,右邊的電荷總數為+6。根據題給信息:溶液的介質環境為酸性,故可在方程式的左邊添加2個H+以使方程式的兩端電荷守恒,即2Fe2++H2O2+2H→2Fe3++2H2O;(4)檢查方程式兩端原子是否守恒。本題所有原子已守恒,故直接變“→”為“=”,即2Fe2++H2O2+2H+=2Fe3++2H2O。
答案:2Fe2++H2O2+2H+=2Fe3++2H2O
【方法歸納】陌生氧化還原反應離子方程式的書寫步驟(4步法)
(1)根據化合價規律及題給信息和已知元素化合物性質確定相應的還原產物、氧化產物。
(2)標出變價元素的化合價,分別確定出化合價升高數和化合價降低數。根據化合價升降總數相等確定參與氧化還原反應的物質(兩劑和兩產物)的相應化學計量數。
(3)結合溶液介質的酸堿性和反應方程式兩端電荷的差異,在離子方程式的某一端添加H+(或OH-)的形式使離子方程式兩端的電荷守恒(即“缺項配平”)。“缺項配平”可能出現的情況:H+→H2O(酸性)、OH-→H2O(堿性)、H2O→H+(中性或酸性)、H2O→OH-(中性或堿性)。絕不可能出現的情況:H+→OH-或者OH-→H+。
(4)根據原子守恒,通過在離子方程式兩端添加H2O(或其他小分子)使方程式兩端各原子的種類相同和數目相等,最后補上反應條件,變“→”為“=”。
注意:若是陌生氧化還原反應的化學方程式,則第(1)(2)步相同,第(3)(4)步應改為根據原子守恒,在通過在化學方程式的兩端補上適當的物質,使化學方程式兩端各原子的種類相同和數目相等。最后補上反應條件,變“→”為“=”。
【變式訓練】(2017·全國Ⅰ卷,節選)已知FePO4LiFePO4,請寫出“高溫煅燒②”中由FePO4制備LiFePO4的化學方程式_______________________。
解析:(1)根據題給信息,FePO4→LiFePO4,Fe由+3價→+2價,FePO4做氧化劑,LiFePO4為還原產物;根據氧化還原反應規律,推出H2C2O4做氧化劑,C的化合價由+3價→+4價,得到的氧化產物為CO2。即: FePO4+H2C2O4→LiFePO4+CO2;(2)Fe由+3價→+2價(降1),C的化合價+3價→+4價(升1)。根據化合價升降總數相等,FePO4、LiFePO4、H2C2O4、CO2的相應化學計量數分別為2、2、1、2,即2FePO4+H2C2O4→2LiFePO4+2CO2;(3)根據Li守恒,則上式的左邊應增加1個Li2CO3,即2FePO4+Li2CO3+H2C2O4→2LiFePO4+3CO2;(4)根據原子守恒,右邊應增加1個H2O。同時,將反應條件和“↑”補齊,變“→”為“=”,即2FePO4+Li2CO3+H2C2OePO4+3CO2↑+H2O
答案:2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O
視角三、從流程中尋找反應物和生成物——眾里尋他千百度
【典例剖析】(2018·校考,節選)許多含氯物質與生活密切相關,如HClO、ClO2、NaClO2等都是重要的殺菌消毒劑和漂白劑。其中制備NaClO2的工業流程如圖1所示:
請回答下列問題:
(1)反應器Ⅰ中反應的氧化劑是____________________。
(2)反應器Ⅱ中發生反應的離子方程式為____________。
(3)通入反應器Ⅱ中的SO2能用H2O2代替,請簡要說明理由:___________。
解析:(1)由NaO2可知,NaClO3為氧化劑。
(2)由工藝流程圖反應器Ⅱ中箭頭所表示的物料流向,通入到反應器Ⅱ中的反應物有NaOH、SO2、H2O、ClO2,生成物有NaClO2。由ClO2→NaClO2的過程中,Cl的化合價由+4價→+3價,ClO2做氧化劑,得到電子。故SO2做還原劑,S的化合價由+4價→+6價,即SO2→SO42-。最后按照陌生氧化還原反應方程式的書寫步驟,即可得到反應的離子方程式為2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O。
(3)根據以上分析反應器Ⅱ中,SO2做還原劑。H2O2也具有還原性,能夠像SO2一樣把ClO2還原為NaClO2。
答案:(1)NaClO3 (2)2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O
(3)H2O2有還原性,也能把ClO2還原為NaClO2
【方法歸納】樹立整體意識和局部意識,快速瀏覽整個工業流程,根據實驗原理和目的分析核心化學反應。先根據流程圖中箭頭所表示的物料流向,尋找反應物和生成物。再根據化合價規律及題給信息和已知元素化合物性質確定兩劑和兩產物,最后按照陌生氧化還原反應方程式的書寫步驟完成相應的方程式書寫。
【變式訓練】(2016·全國I卷,改編)NaClO2是一種重要的殺菌消毒劑,也常用來漂白織物等,其一種生產工藝如下:
(1)寫出“反應”步驟中生成ClO2的化學方程式______
____________________________;
(2)寫出“電解”步驟的總反應的化學方程式_________
____________________________;
(3)“尾氣吸收”是吸收“電解”過程排出的少量ClO2。此吸收反應中,氧化劑與還原劑的物質的量之比為________,該反應中氧化產物是_________。
解析:(1)由工藝流程圖“反應”步驟中箭頭所表示的物料流向,反應物為NaClO3、SO2、H2SO4,生成物為ClO2、NaHSO4,最后按照陌生氧化還原反應方程式的書寫步驟即可。
(2)結晶、干燥為物理變化,故結晶、干燥前的物質NaClO2,即為電解后的產物之一和產品液的成分。由工藝流程圖“電解”步驟箭頭所表示的物料流向,反應物為NaCl、ClO2,生成物為NaClO2、Cl2(),最后按照陌生氧化還原反應方程式的書寫步驟即可。
(3)由工藝流程圖“尾氣吸收”步驟中箭頭所表示的物料流向,反應物為ClO2、NaOH、H2O2,生成物之一為NaClO2。根據氧化還原反應的規律反應過程中,ClO2為氧化劑,NaClO2為還原產物,則H2O2應為還原劑,氧化產物為O2。根據化合價升降總數相等,可得到氧化劑(ClO2)與還原劑(H2O2)的物質的量之比為2 ∶ 1。
答案:(1)2NaClO3+SO2+H2SO4=ClO2+2NaHSO4? (2)2NaCl+2ClO2NaClO2+Cl2
(3)2 ∶ 1? ?O2
視角四、陌生的電極反應式——不畏浮云遮望眼
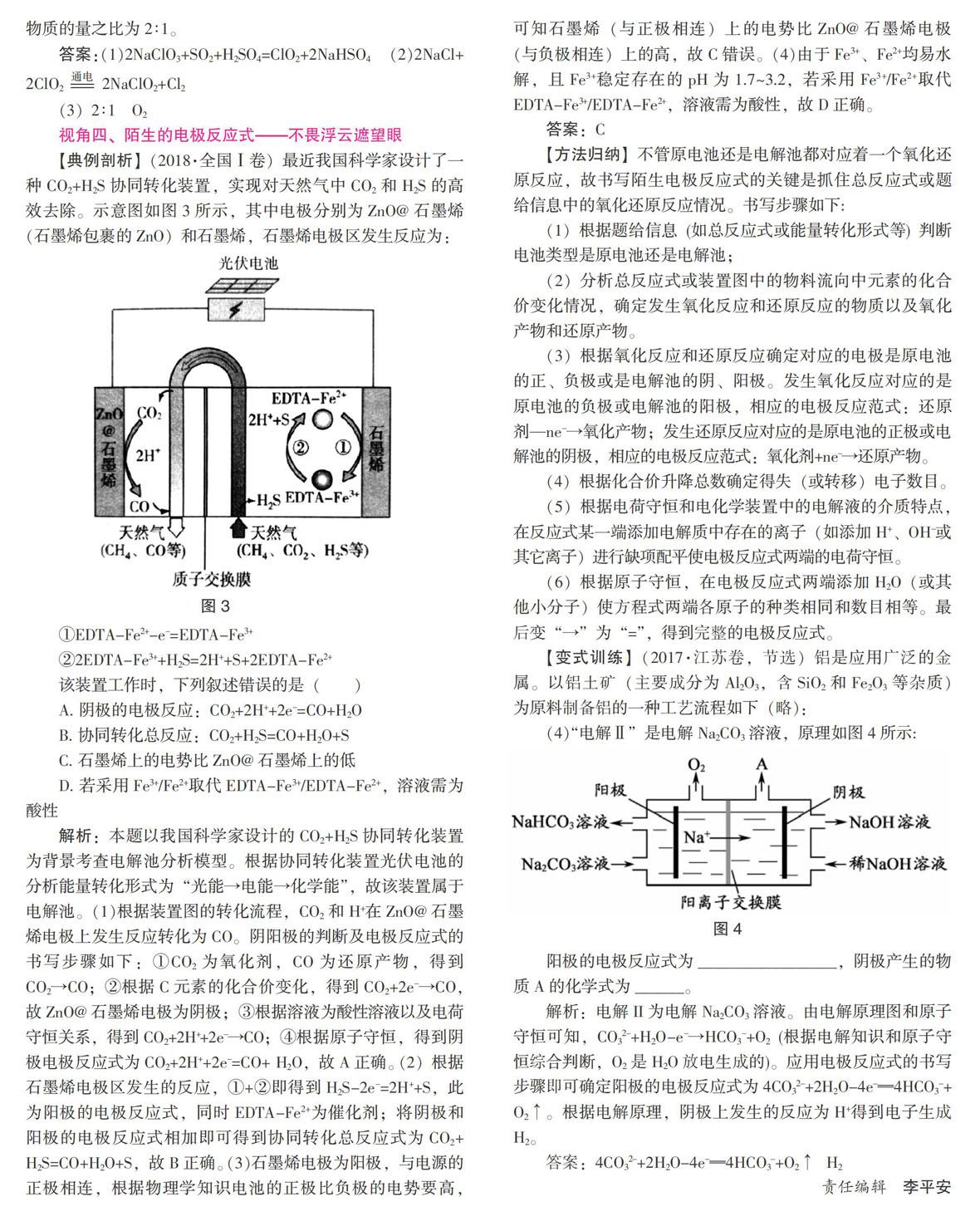
【典例剖析】(2018·全國Ⅰ卷)最近我國科學家設計了一種CO2+H2S協同轉化裝置,實現對天然氣中CO2和H2S的高效去除。示意圖如圖3所示,其中電極分別為ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯電極區發生反應為:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
該裝置工作時,下列敘述錯誤的是(? )
A. 陰極的電極反應:CO2+2H++2e-=CO+H2O
B. 協同轉化總反應:CO2+H2S=CO+H2O+S
C. 石墨烯上的電勢比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需為酸性
解析:本題以我國科學家設計的CO2+H2S協同轉化裝置為背景考查電解池分析模型。根據協同轉化裝置光伏電池的分析能量轉化形式為“光能→電能→化學能”,故該裝置屬于電解池。(1)根據裝置圖的轉化流程,CO2和H+在ZnO@石墨烯電極上發生反應轉化為CO。陰陽極的判斷及電極反應式的書寫步驟如下:①CO2為氧化劑,CO為還原產物,得到CO2→CO;②根據C元素的化合價變化,得到CO2+2e-→CO,故ZnO@石墨烯電極為陰極;③根據溶液為酸性溶液以及電荷守恒關系,得到CO2+2H++2e-→CO;④根據原子守恒,得到陰極電極反應式為CO2+2H++2e-=CO+ H2O,故A正確。(2)根據石墨烯電極區發生的反應,①+②即得到H2S-2e-=2H++S,此為陽極的電極反應式,同時EDTA-Fe2+為催化劑;將陰極和陽極的電極反應式相加即可得到協同轉化總反應式為CO2+H2S=CO+H2O+S,故B正確。(3)石墨烯電極為陽極,與電源的正極相連,根據物理學知識電池的正極比負極的電勢要高,可知石墨烯(與正極相連)上的電勢比ZnO@石墨烯電極(與負極相連)上的高,故C錯誤。(4)由于Fe3+、Fe2+均易水解,且Fe3+穩定存在的pH為1.7~3.2,若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需為酸性,故D正確。
答案:C
【方法歸納】不管原電池還是電解池都對應著一個氧化還原反應,故書寫陌生電極反應式的關鍵是抓住總反應式或題給信息中的氧化還原反應情況。書寫步驟如下:
(1)根據題給信息(如總反應式或能量轉化形式等)判斷電池類型是原電池還是電解池;
(2)分析總反應式或裝置圖中的物料流向中元素的化合價變化情況,確定發生氧化反應和還原反應的物質以及氧化產物和還原產物。
(3)根據氧化反應和還原反應確定對應的電極是原電池的正、負極或是電解池的陰、陽極。發生氧化反應對應的是原電池的負極或電解池的陽極,相應的電極反應范式:還原劑—ne-→氧化產物;發生還原反應對應的是原電池的正極或電解池的陰極,相應的電極反應范式:氧化劑+ne-→還原產物。
(4)根據化合價升降總數確定得失(或轉移)電子數目。
(5)根據電荷守恒和電化學裝置中的電解液的介質特點,在反應式某一端添加電解質中存在的離子(如添加H+、OH-或其它離子)進行缺項配平使電極反應式兩端的電荷守恒。
(6)根據原子守恒,在電極反應式兩端添加H2O(或其他小分子)使方程式兩端各原子的種類相同和數目相等。最后變“→”為“=”,得到完整的電極反應式。
【變式訓練】(2017·江蘇卷,節選)鋁是應用廣泛的金屬。以鋁土礦(主要成分為Al2O3,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如下(略):
(4)“電解Ⅱ”是電解Na2CO3溶液,原理如圖4所示:
陽極的電極反應式為_________________,陰極產生的物質A的化學式為______。
解析:電解II為電解Na2CO3溶液。由電解原理圖和原子守恒可知,CO32-+H2O-e-→HCO3-+O2(根據電解知識和原子守恒綜合判斷,O2是H2O放電生成的)。應用電極反應式的書寫步驟即可確定陽極的電極反應式為4CO32-+2H2O-4e-═4HCO3-+O2↑。根據電解原理,陰極上發生的反應為H+得到電子生成H2。
答案:4CO32-+2H2O-4e-═4HCO3-+O2↑? H2




