鯉浮腫病檢測方法實驗室間比對的結(jié)果與評價
陳孝宇,陳 鑫,王津津,范引光,曾憲東,鄭 劍
(1.武漢海關(guān),武漢 430050;2.深圳海關(guān),深圳 518045;3.安徽醫(yī)科大學(xué)公共衛(wèi)生學(xué)院,合肥 230032)
鯉浮腫病毒(carp edema virus)于1974年在日本新瀉的一個錦鯉養(yǎng)殖場首次發(fā)現(xiàn),自2009年開始,在英國、法國、德國、波蘭等歐洲國家,陸續(xù)發(fā)生了鯉科魚類因感染CEV而爆發(fā)性死亡[1-3]。在亞洲的印度和韓國也相繼出現(xiàn)鯉浮腫病感染病例報道[4,5]。2014年7月,在北京房山某養(yǎng)殖場發(fā)現(xiàn)鯉浮腫病臨床癥狀疑似病例,經(jīng)電鏡觀察和PCR產(chǎn)物測序及比對,確診該病是由CEV感染引起的鯉魚浮腫病[6]。感染CEV的發(fā)病魚身體浮腫,表現(xiàn)出強(qiáng)烈的嗜睡癥狀,浮于水面或沉入池底,器官水平可見鰓損害、凹眼、皮膚損害等癥狀,因此該病又被命名為錦鯉昏睡癥(koi sleepy disease, KSD),該病發(fā)病水溫范圍廣,7~25 ℃均有報道。CEV是一種雙鏈DNA病毒,屬于痘病毒科,根據(jù)CEV 4a基因片段遺傳分析,將其分為三個基因型:基因型I和IIb型僅感染普通鯉,IIa型感染普通鯉和錦鯉[3,7]。錦鯉感染CEV后有典型的臨床癥狀,導(dǎo)致很高的致死率;但普通鯉對CEV卻有很強(qiáng)的耐受性,種群致死率較低[8]。隨著CEV的流行趨勢漸廣,在不同應(yīng)用場景下,最適檢測方案的選擇尤為重要,但目前尚未有CEV現(xiàn)場快速檢測的方法報道。本研究旨在利用實驗室間比對,比較鯉浮腫病不同檢測方法的檢出限,為防疫機(jī)構(gòu)提供有效的檢測手段,為開展流行病監(jiān)測奠定方法基礎(chǔ)。
1 材料與方法
1.1 病魚樣品
2017年6月收到來自湖南省的3個樣品,每個樣品隨機(jī)采樣錦鯉150尾,采樣水溫25~27 ℃。部分錦鯉有昏睡癥狀,以及眼球凹陷和體表潰爛等其他臨床癥狀。
1.2 主要試劑與儀器
基因組DNA提取試劑盒購自天根公司;Taq酶購自Takara公司,Bst酶購自NEB公司;引物、探針均由Invitrogen公司合成。PCR儀和熒光PCR儀購自ABI公司,電泳儀和凝膠成像系統(tǒng)購自Bio-rad公司。
1.3 核酸提取
取魚鰓和肝脾腎等內(nèi)臟組織,低溫研磨,采用基因組DNA提取試劑盒抽提DNA,方法參見說明書,-40 ℃保存?zhèn)溆谩?/p>
1.4 CEV的套式PCR檢測方法
采用Matras等[3]建立的CEFAS套式PCR方法,第一輪擴(kuò)增引物序列為:F1:5′-ATGGAGTATCCAAAGTACTTAG-3′,R1:5′- CTCTTCACTATTGTGACTTTG -3′;第二輪擴(kuò)增引物序列為:F2:5′- GTTATCAATGAAATTTGTGTATTG -3′ R2:5′- TAGCAAAGTACTACCTCATCC -3′。兩輪擴(kuò)增反應(yīng)條件一致:95 ℃預(yù)變性5 min;95 ℃變性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35個循環(huán);72 ℃延伸10 min。配置1.5%瓊脂糖膠, PCR擴(kuò)增產(chǎn)物電泳后,凝膠成像系統(tǒng)觀察結(jié)果。
1.5 CEV的 LAMP檢測方法
采用經(jīng)鑒定的CEV核酸,以及選取錦鯉皰疹病毒,鯉皰疹I(lǐng)I型病毒和鯉春病毒血癥病毒等常見鯉科魚病毒作為參照進(jìn)行特異性實驗。LAMP擴(kuò)增的外引物為F3:5′- GTTATCAATGAAATTTGTGTATTG-3′,B3:5′- CAAATTTGAGATTACATTCTGTGG -3′;內(nèi)引物為FIP:5′- TGGGAAGGATTTTATGCTAATGGAAATCGTTTGTTACCTTTTGTAGT-3′,BIP:5′- TGTAGCATTTCCTAGTTTGTATGGCCAAATTCCTCAAGGAGTTGC -3′。反應(yīng)條件為63 ℃等溫擴(kuò)增60 min,80 ℃終止反應(yīng)5 min。瓊脂糖電泳觀察結(jié)果。
1.6 CEV的熒光定量檢測方法
熒光定量PCR采用Matras等[3]建立的CEFAS qPCR方法,引物為F:5′-AGTTTTGTAKATTGTAGCATTTCC-3′,R:5′-GATTCCTCAAGGAGTTDCAGTAAA-3′,探針為5′-FAM-AGAGTTTGTTTCTTGCCATACAAACT-BHQ1-3′,反應(yīng)條件為:95 ℃預(yù)變性10 min;95 ℃變性30 s,60 ℃退火30 s,共40個循環(huán)。
1.7 室間比對方案
參試實驗室需分別對所分配到的4份樣品進(jìn)行核酸濃度測量,并選擇不同的基因擴(kuò)增方法進(jìn)行檢測,對4份樣品分別作出定性的判定,并且要求10倍梯度稀釋陽性樣品,進(jìn)一步比較方法之間檢出限的差異。
1.7.1 樣品
設(shè)計陰性和陽性兩種CEV核酸樣品:陽性樣品為含CEV病毒核酸的基因組,由感染CEV的病魚鰓組織中提取;陰性樣品為感染白斑綜合征(white spot disease,WSD)的克氏原螯蝦基因組。將提取的核酸溶于TE溶液中,混勻后再分裝而成,-40 ℃冷凍保存。按照《能力驗證樣品均勻性和穩(wěn)定性評價指南》所規(guī)定的檢驗方法和要求,隨機(jī)選取待檢樣品進(jìn)行定性檢測,并對陽性樣品進(jìn)行核酸濃度的均勻性和穩(wěn)定性檢測。
分別從陽性樣品中隨機(jī)抽取了10份樣品進(jìn)行均勻性檢測。穩(wěn)定性檢驗跨度6 d,測定時間為每天,設(shè)置三個模擬環(huán)境:低溫組4 ℃,常溫組25 ℃,高溫組37 ℃。每份樣品采用紫外分光光度法進(jìn)行濃度檢測,重復(fù)檢測2次。
1.7.2 檢測方法:
套式PCR、LAMP和熒光定量方法參照1.4、1.5和1.6。
1.7.3 參試實驗室
對每個參試實驗室賦予唯一性代碼,參試實驗室均以代碼表示,樣品分發(fā)、結(jié)果報告等也均以代碼傳遞。全國有10家實驗室報名參加本次室間比對(表1),其中原檢驗檢疫系統(tǒng)實驗室7個,以及水產(chǎn)科研院所2個和地方水產(chǎn)機(jī)構(gòu)的實驗室1個。

表1 參試實驗室地區(qū)分布Tab.1 Regional distributions of the inter-laboratory comparison

續(xù)表
2 結(jié)果
2.1 樣品CEV檢測鑒定
電泳可見第一輪套式PCR無明顯擴(kuò)增(圖1
左),第二輪產(chǎn)物大小約為478 bp(圖1右),使用DNAman軟件進(jìn)行序列比對,PCR產(chǎn)物測序結(jié)果與編碼CEV膜蛋白的4a基因的同源性(登錄號:KX25404.1;分離株:55-2013)高達(dá)97.90%(圖2),顯示三個錦鯉樣品均被CEV感染。
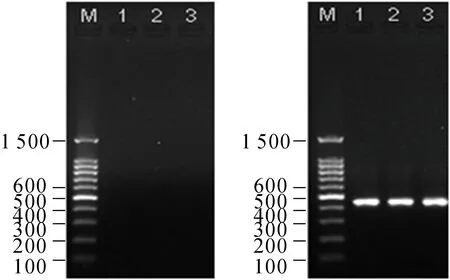
圖1 CEV套式PCR檢測結(jié)果Fig.1 Nest-PCR results of CEV detection
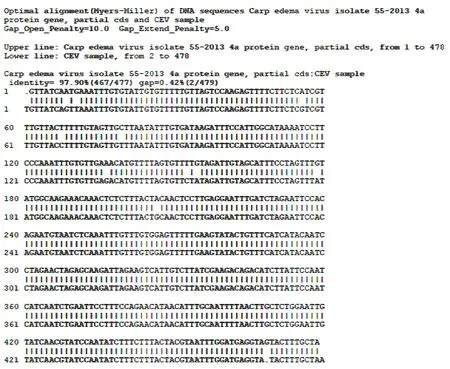
圖2 套式PCR產(chǎn)物序列比對Fig.2 Sequence alignment of nest-PCR products
2.2 LAMP特異性
CEV病毒核酸擴(kuò)增出明顯梯形條帶,錦鯉皰疹病毒(koi herpesvirus,KHV)、鯉皰疹2型病毒(cyprinid herpesvirus 2,cyHV-2)、鯉春病毒血癥病毒(spring viraemia of carp virus,SVCV)樣品均未產(chǎn)生有效擴(kuò)增(圖3),顯示LAMP方法特異性良好。
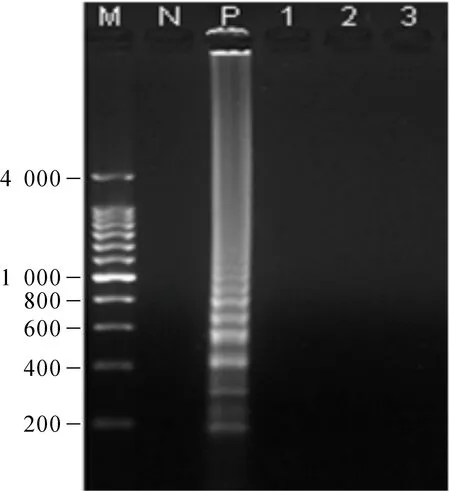
圖3 LAMP特異性結(jié)果Fig.3 Specific results of LAMP
2.3 測試樣品的均勻性和穩(wěn)定性評價
陽性和陰性樣品的CEV定性檢測結(jié)果全部相符,對陽性樣品核酸濃度值經(jīng)單因子方差統(tǒng)計分析:計算得F陽=0.650,查表得F0.05(9,10)=2.35,F(xiàn)陽顯著小于F0.05(9,10),結(jié)果表明在0.05顯著性水平時,陽性樣品是均勻的,平均濃度為679.659 μg/mL(表3)。
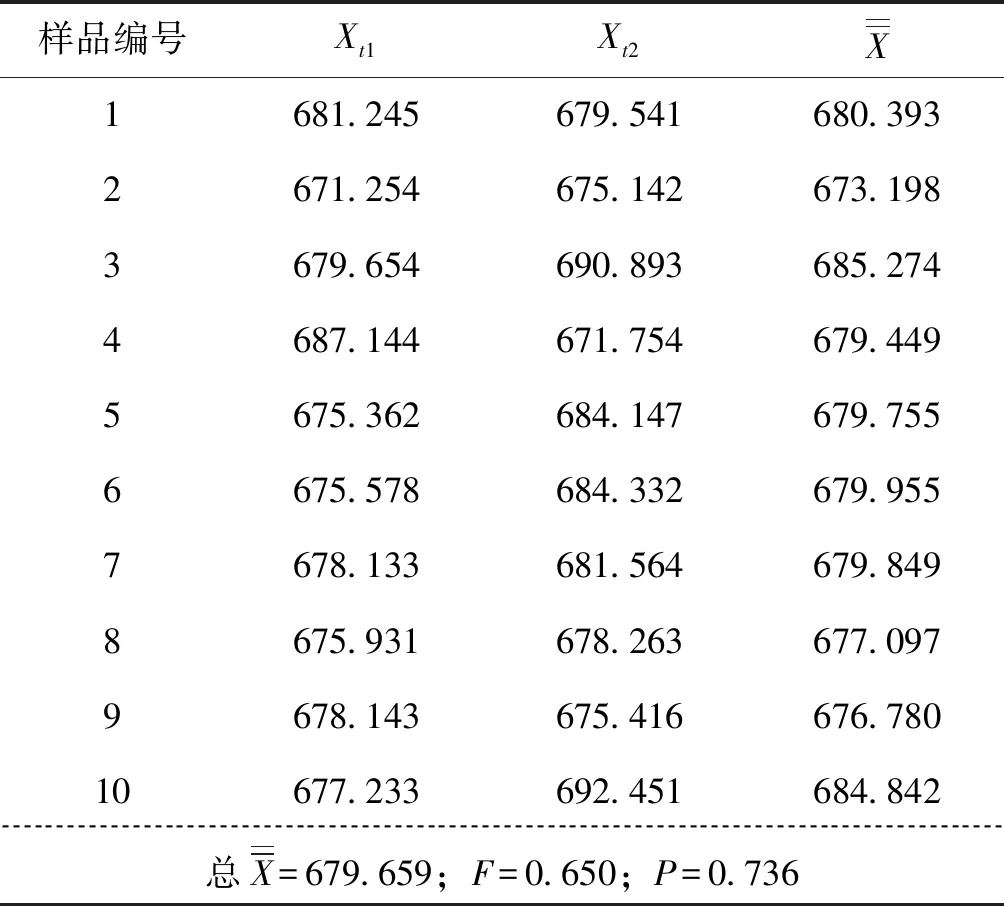
表3 陽性樣品核酸濃度均勻性實驗Tab.3 Test for homogeneity of nucleic acid concentration of positive samples
采用t檢驗法評定樣品的穩(wěn)定性,樣品存放6d后檢測結(jié)果計算:t低溫=0.732,t常溫=0.491,t高溫=0.466,均小于t0.05/2,12=2.179。表明所有樣品經(jīng)模擬低溫、常溫、高溫運(yùn)輸6 d,檢測結(jié)果無顯著性變化,樣品穩(wěn)定性良好(表4)。
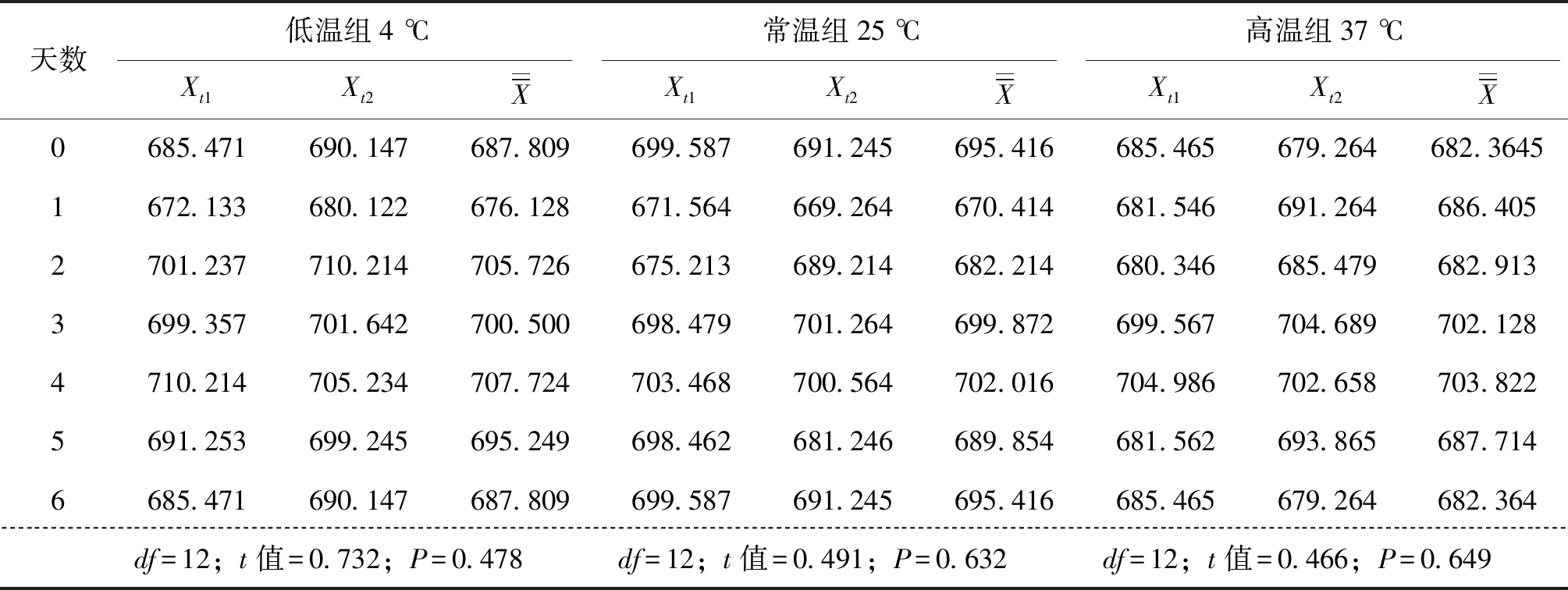
表4 陽性樣品核酸濃度穩(wěn)定性實驗Tab.4 Test for stability of nucleic acid concentration of positive samples
2.4 實驗室比對結(jié)果統(tǒng)計
本次室間比對共收到10個參試實驗室的結(jié)果報告,經(jīng)與已知結(jié)果值對照,參試實驗室均上報了正確的定性檢測結(jié)果,其中有9家選擇了套式PCR檢測方法,10家全部都選擇了熒光PCR檢測方法,2家選擇了LAMP方法。所有檢測限判定的有效結(jié)果統(tǒng)計見圖4,計算其稀釋倍數(shù)的加權(quán)平均值可得:LAMP法為50倍稀釋,最高可達(dá)102倍稀釋;熒光PCR法為380倍稀釋,最高可達(dá)103倍稀釋;而套式PCR法為1 225倍稀釋,最高可達(dá)到104倍稀釋,其檢測限可低至6.8×10-10g核酸樣品。
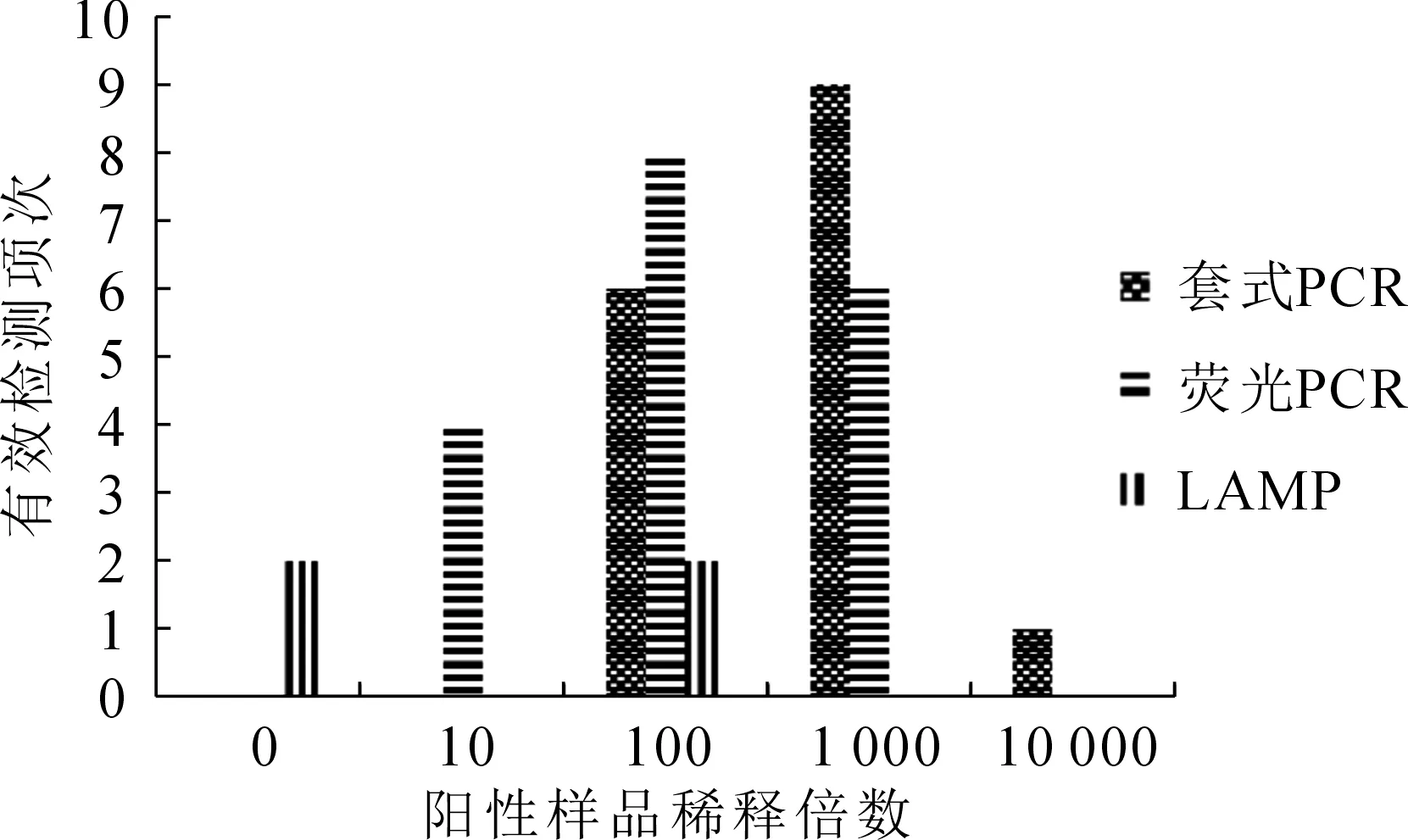
圖4 室間比對檢測限Fig.4 Detection limit of inter-laboratory comparison
3 討論
實驗室間比對其目的除了確定實驗室進(jìn)行特定檢測的能力以外,可通過對結(jié)果數(shù)據(jù)進(jìn)行分析,確定新的檢測方法的有效性和可比性[9];而能力驗證是利用實驗室間比對,按照預(yù)先制定的準(zhǔn)則開展的活動。在動物檢疫領(lǐng)域,由國家認(rèn)監(jiān)委等機(jī)構(gòu)組織的能力驗證,針對病原的核酸檢測主要為定性比對,僅部分酶聯(lián)免疫吸附檢測方法為定量比對,其目的是評價參加者的能力,其結(jié)果運(yùn)用于檢驗檢測機(jī)構(gòu)的認(rèn)可和資質(zhì)認(rèn)定。本研究設(shè)計定量比對方案,并且組織了10家實驗室進(jìn)行樣品的定性判定,在保證陽性樣品CEV核酸濃度均勻穩(wěn)定的前提下,對不同方法的檢測限結(jié)果進(jìn)行統(tǒng)計分析。
目前尚未發(fā)現(xiàn)和建立敏感細(xì)胞系,無法進(jìn)行CEV病毒分離實驗,檢測手段主要是核酸檢測。本次實驗室間比對采用CEFAS建立的套式和熒光PCR方法[10],其引物設(shè)計在p4a基因的相對保守片段上,是目前實驗室條件下,檢測已知CEV全部基因型的最佳方法。Oyamatsu等[11]建立的套式PCR方法,檢測基因型I型CEV時,結(jié)果顯示有雜帶干擾,無法有效判定結(jié)果,在檢測IIa型時有漏檢。Adamek等[12]建立的熒光PCR方法,在檢測I型CEV時,假陰性結(jié)果較多,且IIa型有漏檢。
熒光PCR法無需進(jìn)行擴(kuò)增產(chǎn)物電泳,利用收集熒光探針信號來判定靶基因擴(kuò)增與否,該方法實驗流程更少,但對儀器成本要求更高,且熒光探針的成本要遠(yuǎn)高于引物。套式PCR是傳統(tǒng)的基因擴(kuò)增方法,兩輪PCR可有效擴(kuò)增靶基因,且產(chǎn)物可
經(jīng)測序進(jìn)一步驗證結(jié)果可靠性。由該次室間比對的全部參試結(jié)果統(tǒng)計分析可得,CEFAS套式PCR方法靈敏度最高,適用于實驗室檢測;LAMP法快捷有效,對儀器要求最低,可適用于現(xiàn)場檢測。但此次比對結(jié)果顯示,LAMP法檢測限尚不夠低,須通過設(shè)計環(huán)引物和調(diào)整擴(kuò)增體系中甜菜堿濃度等方法,進(jìn)一步優(yōu)化反應(yīng)條件,提高其檢測靈敏度。
目前CEV的全基因組序列尚未公布,遺傳背景也未完全了解,急需搜集陽性樣品和開展流行病學(xué)調(diào)查,進(jìn)行毒株進(jìn)化分析,以更好地開展鯉浮腫病防治研究。本研究建立了現(xiàn)場快速檢測方法,同時為在不同應(yīng)用場景下,選擇CEV最適檢測方法提供了理論依據(jù)。

