N-乙酰半胱氨酸對TACE肝癌患者凝血酶原、膽紅素和谷丙轉氨酶的影響
李文華 劉曉紅 朱國艷 戴成艷
肝癌因起病隱匿,早期缺乏明顯臨床癥狀,大部分患者就診時已屬中晚期,手術切除者僅占20%左右;而肝動脈化療栓塞術(Transcatheter arterial embolization,TACE)雖是不宜手術切除患者的關鍵治療方法,但對其肝功能會造成可逆性損傷[1]。有資料顯示,肝癌患者TACE術前肝功能良好,術后亦存在肝功能損傷風險;而N-乙酰半胱氨酸(N-acetylcysteine,NAC)屬L-半胱氨酸乙酰化物,可保護肝臟,在乙酰氨基酚所致急性肝功能衰竭治療中能獲取較為滿意的臨床效果,但關于其治療TACE肝癌患者的報道較少[2]。基于此,本文主要深入研究N-乙酰半胱氨酸對TACE肝癌患者脫γ-羧基凝血酶原(Des-γ-carboxy prothrombin,DCP)、總膽紅素(Total bilirubin,TBil)、谷丙轉氨酶(Glutamic-pyruvic transaminase,ALT)的影響,現報道如下。
資料和方法
一、 一般資料
納入2016年1月至2018年1月于我院收治的60例TACE肝癌患者為對象。納入標準:(1)與《原發性肝癌診療規范(2011年版)》[3]中原發性肝癌診斷標準相符,均接受TACE術;(2)肝功能Child-Pugh分級為A~B級,腫瘤直徑≤10 cm;(3)年齡≥18歲,初次診斷、首次治療者;(4)獲患者知情同意。排除標準:(1)伴心、肺、腎等重要器官疾病;(2)伴門靜脈或肝靜脈主要分支癌栓形成,或存在遠處轉移;(3)入組前3個月行外科手術切除治療或聯合經皮無水酒精注射、肝動脈介入化療等治療;(4)肝功能Child-Pugh分級為C級;(5)伴重度肝硬化所致肝功能嚴重異常,或有明顯腹水、黃疸者;(6)伴其他部位惡性腫瘤者。采用抽簽隨機方法將其分為兩組,各30例,其中對照組予以常規護肝治療,觀察組在此前提下行NAC治療。本研究獲我院醫學倫理委員會批準,兩組一般資料比較差異無統計學意義(P>0.05),見表1。
二、方法
(一)手術方法 所有患者均行TACE術。術前完善血常規、腎功能、心電圖等相關檢查,術前6 h禁水、禁食,建立靜脈通道。術前,排空患者膀胱,取平臥位,利用改良Seldinger's穿刺技術,在局麻下經皮股動脈穿刺插管,動脈導管置入后并將其送至肝總動脈,予以診斷性造影。腫瘤供血動脈位置明確后,經導管超選擇插入肝動脈內行灌注化療,待灌注氟尿嘧啶(天津金耀藥業,國藥準字H12020959)750 mg+奧沙利鉑(深圳海王藥業,國藥準字H20031048)150 mg+多柔比星(常州金遠藥業,國藥準字H20123273)30 mg后,均勻混合奧沙利鉑50 mg+多柔比星10 mg+碘海醇(湖南金健藥業,國藥準字H20084190)3 mL+碘化油(法國加柏公司,注冊證號H20050307)5 mL,行栓塞處理。需要注意的是,需按患者體重行劑量調整,部分患者可利用明膠海綿顆粒栓塞劑行栓塞封閉。
表1 兩組患者一般資料比較[(±s),n(%)]
(二)治療方法 對照組予以常規治療(如維生素C、門冬氨酸鉀鎂等)。在此前提下,觀察組予以NAC治療,于TACE術前3 d至術后7 d,靜滴NAC(Zambon Italia S.R.L,批準文號H20070264)8 g+5%葡萄糖250 mL,1次/d;之后,暫停NAC治療,若肝功能未恢復至正常狀況,酌情予以維持治療。兩組均持續治療3周。
三、觀察指標
(一)凝血酶原及氧化應激指標 于TACE術前1 d及術后第7 d,采用一次性真空采血管,采集晨肘靜脈血3 mL,以3 000 r/min速度離心10 min,收集上層血清,送至第三方檢驗中心(迪安診斷)行DCP、丙二醛(Malonic dialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)水平檢測。
(二)肝功能指標 運用羅氏Cobas 8000全自動生化分析儀及相配套試劑,行TBil、ALT、谷草轉氨酶(Aspartate aminotransferase,AST)、清蛋白(Albumin,ALB)檢測。
四、統計學方法
結 果
一、 兩組治療前后DCP及氧化應激反應因子指標比較
觀察組治療后DCP、MDA顯著低于治療前及對照組治療后(P<0.05),SOD顯著高于治療前及對照組治療后(P<0.05),見表2。
二、 兩組治療前后肝功能指標比較
觀察組治療后TBil、ALT、AST水平較術前均無統計學意義(P>0.05),但均顯著低于對照組治療后(P<0.05);觀察組治療后ALB較治療前及對照組治療后均無統計學意義(P>0.05),見表3。
討 論
既往文獻顯示,中晚期肝癌患者伴有不同程度的肝功能不全,而TACE術會導致肝功能惡化風險增加,其中大約70%的患者存在肝硬化[4]。究其根源,多因TACE屬創傷性手術,對肝臟主血管予以栓塞,雖可阻斷腫瘤主要供血,斷絕肝臟腫瘤營養,使腫瘤縮小、壞死,但會斷絕肝臟自身營養供給,影響肝臟血液循環,引起肝功能異常;而基于醫師操作經驗和腫瘤血管自身特點(如側支循環較多、伴動靜脈瘺等)影響,會導致術中靶動脈超選擇不到位、順流性或反流性誤栓、過度栓塞等情況的發生,引起局部組織缺血、缺氧損傷,再加上化療藥物的影響,故肝組織會出現不同程度的損害。但TACE術后肝功能損傷具有可逆性,有資料顯示,TACE術后實施常規保肝治療(如維生素C、門冬氨酸鉀鎂等),對患者肝功能的恢復具有重要作用,但效果并不顯著[5]。
本研究結果顯示,觀察組治療后DCP、MDA較對照組低,SOD較對照組高,提示NAC能減輕TACE肝癌患者脂質過氧化反應。DCP為原發性肝細胞肝癌標志物,由肝臟合成凝血酶原過程中前體羧化不完全引起。有資料顯示,原發性肝細胞肝癌患者血清中DCP水平顯著升高,于甲胎蛋白陰性患者中DCP仍有可能上升,與腫瘤血管侵襲、肝內轉移等因素有關[6]。
表2 兩組治療前后DCP及氧化應激反應因子指標比較(±s)
注:與同組治療前比較,#P<0.05
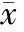
表3 兩組治療前后肝功能指標比較(±s)
注:與同組治療前比較,#P<0.05
而NAC為琉醇化合物,亦為細胞內還原性谷胱甘肽前體,于肝臟細胞中通過代謝結合蛋白質肽鏈,形成多種代謝產物,聯合常規護肝治療(維生素C、門冬氨酸鉀鎂等),可抑制肝癌細胞DCP產生,降低血液中DCP含量,下調HIF-1α合成,誘導肝癌HepG2細胞survivin、VEGF表達受抑,并抑制肝細胞癌生長。正常情況下,大多數體內產生自由基由還原性谷胱甘肽消耗,一旦還原性谷胱甘肽產生不足或消耗過多,會引起肝細胞過氧化損傷。動物實驗發現,NAC應用后,于肝門靜脈血漿中可見分解及氧化的NAC,形成無機亞硫酸鹽、半朧氨酸等代謝產物,保護肝臟[7]。筆者認為,NAC毒性小,可增加機體內還原性谷胱甘肽合成酶含量及細胞內還原性谷胱甘肽含量與活性,快速穿過細胞膜,于細胞內去乙酰化后轉變為半胱氨酸,而后者屬于體內還原性谷胱甘肽生物合成所必需氨基酸,可誘導肝細胞內還原性谷胱甘肽合成,緩解細胞脂質過氧化程度,誘導SOD活性增強,降低MDA,促使機體清除自由基能力增強;并且,NAC結合氧自由基,產生非酶促反應,抗炎作用顯著,可使炎性細胞因子釋放受抑,緩解機體炎性損傷,進而發揮保護肝細胞目的。
本研究發現,觀察組治療后TBil、ALT、AST水平較對照組低,提示NAC能有效改善TACE肝癌患者肝功能。有資料顯示,NAC可糾正庫普弗細胞氧化還原失衡,干擾NF-κB p65活化(核易位),誘導炎性因子(如TNF-α等)基因表達受抑,從而緩解肝損傷[8]。動物實驗發現NAC預處理能保護細菌脂多糖與D-氨基半乳糖所致小鼠急性肝損傷,可能與其抗氧化和抗凋亡作用有關[9]。NAC于機體內結合NO,生成亞硝酸基硫醇,誘導收縮微循環血管擴張,調節血液對組織氧輸送及釋放,改善缺氧,預防肝細胞壞死。本研究認為,NAC通過促進NO與肝臟還原型谷胱甘肽合成,改善TACE肝癌患者肝損傷;另外,NAC能調節淋巴細胞活性,促使T細胞凋亡受抑,逆轉T細胞IL-2及IL-2 mRNA活性介導機體免疫應答,改善患者肝細胞功能,預防肝損傷。
綜上,NAC對TACE肝癌患者DCP、TBil、ALT均存在重要影響,值得臨床積極推廣,但因本文樣本量偏少,觀察時間較短,未涉及NAC對TACE肝癌患者TNF-α等炎癥指標的影響及安全性觀察,故今后仍需深入調查研究。