Ishak與METAVIR在評價慢性病毒性肝炎中的異同
李正鑫 劉成海
Ishak與METAVIR系統是臨床中用以評價病毒性肝炎的最常見的兩大半定量評分體系。兩者均能較好的反映病毒性肝炎的炎癥活動度與纖維化程度[1-2],兩者在判讀中的不同特點已被廣大病理工作者所熟知,但在纖維化的分級判讀中,仍存在爭議。本文旨在系統論述兩者在炎癥和纖維化程度判讀中的區別和轉換方式,通過探討兩系統中概念的內涵和局限,以期更好地應用在日常的病理評價中,并實現使應用這兩種評價系統的研究得以相互比較和系統分析。
一、Ishak和METAVIR半定量評分系統的產生歷史:
過去20年的工作中,Knodell為我們提供了慢性肝炎組織病理學的基礎[3]。早期的評價系統主要關注在區分急性和慢性肝炎,以及揭示決定疾病預后的病變特征。但在Knodell評分系統中[4],將纖維化評價融入到炎性評分標準里。隨著對疾病的進一步認識,人們意識到,纖維化和炎癥是兩種有關聯但彼此相互獨立的病理狀態,且兩者需要分別進行評定的觀點已經成為共識[5]。
Ishak等是在Knodell系統的基礎上進行了許多細節上的修訂[6]。①Ishak采用連續的整數評分替代Knodell系統的跳越式評分以表示不同嚴重程度炎癥的評價;②炎癥活動度和纖維化分期分開進行評估。③炎癥活動度用門管區、界面炎、小葉內炎癥、融合性壞死四個維度進行評價,與Knodell相比:將融合性壞死從門管周圍炎中分離出來;用界面炎替代碎屑樣壞死來反應發生在界板處的肝細胞損傷。
法國METAVIR研究小組通過總結慢性丙型肝炎(chronic hepatitis C, CHC)的病理特征,提出了另一種評價方法,根據決定疾病預后的病變特征來定義炎癥活動度,并選取碎屑樣壞死和小葉內壞死病變,作為評價公式的兩個參數。同時賦予兩種參數不同的權重,而不是像現有的評價方法中,將各種參數的視為一致。
二、慢性乙型肝炎與慢性丙型肝炎的病理特征的異同
Ishak系統是總結自以慢性乙型肝炎(chronic hepatitis B, CHB)患者為主,包含慢性丙型肝炎、自身免疫性肝炎、酒精性肝炎、藥物性肝炎等慢性肝病患者的肝活檢標本。而METAVIR系統單純總結自CHC患者,因此認識CHB和CHC病理的特點是區別Ishak與METAVIR系統的關鍵。
CHC與CHB相比,在整體炎癥程度相似的情況下,門管區炎癥及小膽管損傷則較明顯,且持續存在,病變早期即可出現明顯的門管區淋巴細胞集聚乃至淋巴濾泡形成、小膽管損害,在進展為肝硬化后,纖維間隔內仍可見明顯的淋巴細胞聚集及濾泡形成[7]。
CHB小葉內炎癥活動較重,特別是中、重度CHB,融合壞死、橋接壞死及多小葉壞死多見;發生重型肝炎者多;長期病程中可發生從輕到重和從重到輕的轉換。而CHC小葉內炎癥相對輕,較少發生融合性壞死或橋接壞死,極少發生多腺泡、多小葉的壞死。易發生肝竇細胞化、嗜酸小體多見等,竇內局限或彌漫成串的T淋巴細胞浸潤,且浸潤與小葉內肝細胞損傷無明顯相關性。
界面性肝炎是發生在門管區或纖維間隔與肝實質相交界處的炎癥或侵蝕肝實質的過程。過去很長一段時間界面炎被認為是評價慢性肝炎至肝硬化的重要評價指標[8]。界面炎與門管區周圍肝細胞缺失以及網織纖維骨架的塌陷有關,是形成門管區周圍纖維化的直觀機制[9]。在CHB和CHC中均表現為淋巴細胞性界面炎,可有少量漿細胞浸潤,當兩者炎癥活動在同一級別時,界面炎程度相當。
CHC較CHB于門管區的纖維化更加明顯,常以擴大的門管區基礎上形成門管區之間相連的P-P纖維間隔,而門管區與中央靜脈相連的P-C纖維間隔較CHB發生少,且纖維間隔的炎癥往往較CHB要輕。但CHC竇周纖維化發生較早且廣泛,可能提示丙肝的纖維化發生得更早[7]。
CHC患者較容易出現脂肪變性,通常以大泡性脂肪變性為主;而單純的CHB極少出現脂肪變性。
三、Ishak與METAVIR系統的不同及各自特點:
(一)Ishak與METAVIR中炎癥評分參數不同 如上所述,Ishak與METAVIR系統參考的肝活檢標本來自不同病種的患者,兩者病理特征各有側重,因此所納入的評價參數也不同。Ishak評分系統中,引入了4個參數對炎癥進行評價,分別是門管區炎癥、界面炎、融合性壞死和小葉內活動度。而METAVIR評分系統中,僅將碎屑樣壞死(界面炎)和小葉內活動度作為參考指標。
METAVIR系統應用逐步分析法分析了Ishak系統的4個參數,認為①門管區炎癥不作為參數,原因是門管區炎癥是定義慢性肝炎的前提,并且碎屑樣壞死與其有很強的相關性,單獨評價意義很小。②碎屑樣壞死在慢性肝炎中有重要價值,故作為首選的參數[8]。③將小葉內活動度和融合性壞死合并[10],因CHC的小葉內炎癥較少發生,但不常出現的暴發性小葉炎癥,與CHC的進展密切相關,即使沒有界面炎仍可以進展至肝硬化[11]。
(二)Ishak與METAVIR中界面炎與小葉內炎癥權重不同 在Ishak系統中,將不同病變參數的權重視為一致,即不同的參數被獨立評價后再進行相加。在METAVIR系統中,參數具有不同的權重,碎屑樣壞死較小葉內壞死權重高,因為逐步分析的結果顯示碎屑樣壞死遠高于小葉炎癥對疾病進展的影響[10]。
(三)Ishak與METAVIR在纖維化評價中跨度不同 Ishak在纖維化評價的跨度為0~6,首次區分了早期肝硬化和完全肝硬化[6];METAVIR的纖維化評分跨度為0~4[12],對早期肝硬化沒有進行歸類,因此有學者提出,應將METAVIR纖維化中的F3一分為二:①F3a:顯著的橋接纖維化;②F3b:不完全(早期)肝硬化。因為越精細的纖維化分期越有助于指導臨床藥物試驗準確的評價[13]。
四、評分在Ishak與METAVIR系統間的轉換:
Elzbieta和Marek[14],報道比較了3種組織學評分系統來評價慢性肝炎(Batts and Luwig,Ishak,METAVIR)顯示出彼此間都具有較好的關聯性。因此,系統間可以比較炎癥程度和纖維化等級。
(一)炎癥評分間的轉換 通常CHC小葉內炎癥較輕,以Ishak系統來對CHC進行評價可能會低估病情,所以Gamal Shiha 和Khaled Zalata等[13]認為在應用Ishak系統評價CHC炎癥活動度時應將融合性壞死的6分剔除,將滿分設置為12分。相反,因METAVIR系統中小葉內炎癥的權重較低,其在評價CHB中,可能會得到不正確的結果,影響對病情的判斷。因此炎癥評分的轉換,只能由Ishak單項向METAVIR轉換。
(二)纖維化評分間的轉換 首先需要明確METAVIR和Ishak系統中不同術語的內涵。“septa”在METAVIR中的意思是橋接纖維,而在Ishak評分中“septa”和“bridge”是兩個不同的概念。在Ishak中,septa的意義是擴張的門管區未形成橋接纖維,即未連成門管與門管或門管與中央靜脈的纖維間隔。而bridge是門管與門管、門管與中央靜脈的已相連纖維間隔。
Rozario和Ramakrishna[15]認為METAVIR的F2等同于Ishak的F2。而Goodman[16]以及Gamal Shiha和Khaled Zalata等[13]認為METAVIR的F1等同于Ishak的F1、F2,METAVIR的F2等同于Ishak的F3。如表1,Ishak的F1和F2的差別是擴張門管區數量的多與少,在考慮到慢性病變的不均一性和樣本的抽樣誤差等多種因素后,Ishak的F1、F2應劃歸在METAVIR的F1中。Goodman[16]認為Ishak 5分(不完全肝硬化)應該包含在METAVIR F4中;而Gamal Shiha 和Khaled Zalata等[13]則認為在實際應用中METAVIR的F3也應包含早期肝硬化在內,盡管這些并未詳細闡述在評分系統細則當中。這種觀點與Bedossa和其他METAVIR小組成員意見一致[10, 12]。
肝硬化過去作為各種慢性肝病終末期的代名詞,其不僅僅包含纖維膠原的沉積、假小葉的形成,同時還有血管系統的重建[17]。這種血流動力學的改變往往是不可逆的,即使在纖維消退后,異常的血管系統也很難再恢復正常[18]。基于纖維化的可逆性和血管重構在早期肝硬化和完全肝硬化兩個階段的不同特點,METAVIR系統中F3應包含早期肝硬化的概念,而F4是完全的肝硬化(見表1)。這種差別會使一些對比兩評分系統的系統性研究出現一定的分歧。
五、局限與展望:
(一)半定量評分系統的共性局限 Ishak與METAVIR系統是典型的半定量評分系統,與其他半定量評價系統一樣,具有一定局限性,包括:①樣本隨機性:肝活檢的標本占肝臟的比例極小,樣本隨機性是不可避免的。在慢性肝病中,炎癥和纖維化本身就是非均一性的。有研究指出,肝活檢標本至少需要2cm長,1.4mm粗,標本內呈現11個門管區時,才會呈現比較穩定可信的結果[19]。在經過統計設計后的大樣本的臨床試驗中,隨機的誤差才可能會變小。②評判主觀性:盡管觀察者之間的差異可以在長期的專業訓練下縮小,但即使是資深的病理學家,不同時間評價同1例標本,結論也可能不同。未來可借助自動化的定量評價模式消除主觀的評價的差異性[20]。
(二)評價系統的階段性與趨勢性 肝臟病理可通過判斷炎癥與纖維化的程度預估疾病的發展趨勢。Wanless等[21]總結的8大肝臟恢復特征,北京標準[22]選取其中4項,以“進展”、“逆轉”、“不確定”為基本分類方式,對CHB肝穿標本的纖維化發展趨勢進行了評定,三組患者間的纖維化定量和血清學分析均有良好的差異性,但該系統是否適應于其他慢性肝病仍有待推廣。北京標準可能較早的預測疾病變化的方向,有助于更早的指導臨床以協助診斷;并為臨床新藥試驗提供新的有效的評價方式。
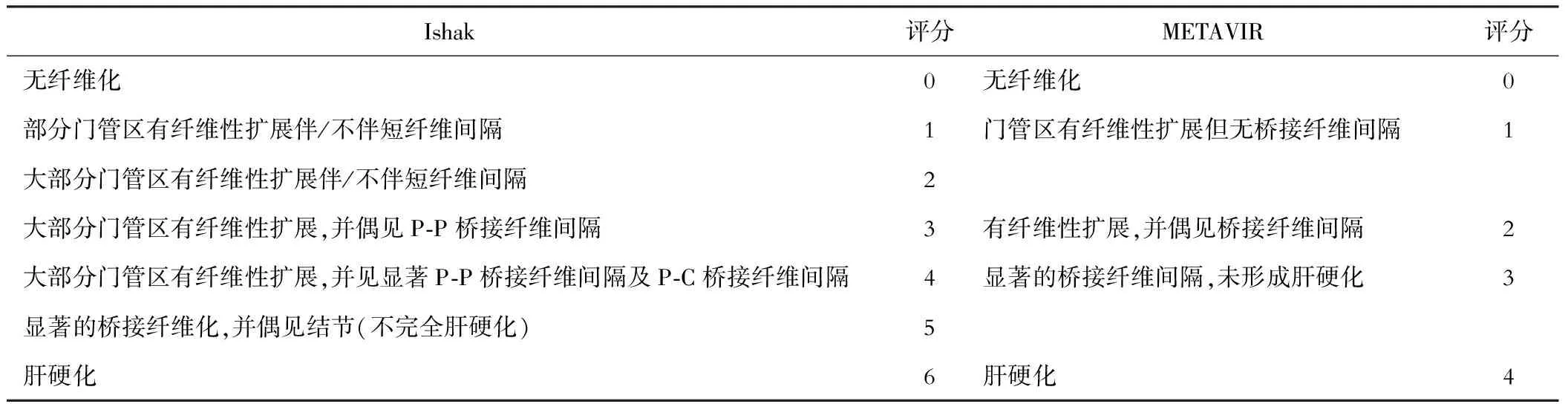
表1 Ishak與METAVIR纖維化評分轉換表

表2 Ishak與METAVIR區別表
(三)脂肪變性與血管病變的獨立評價 METAVIR與Ishak系統中,均未將脂肪變性設為參數引入到公式。目前非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是導致慢性肝病的第一位常見病因,估計人群中發病率可高達30%,死亡率為6.3%~45%[23]。同時在合并非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的慢性肝病患者中,肝纖維化的進展和肝癌的發生率會有所上升,這提示肝細胞脂肪變在疾病進展中可能是作為一種獨立的風險因素[24]。
血管病變包括門脈血管瘤、肝竇擴張、實質內異常的靜脈、靜脈硬化以及異常的門脈等[25-26]。最近研究表明[27],在不同纖維化程度下,血管病變可呈現出不同的病變趨勢,這些不同程度的血管病變,有利于我們更深刻的理解纖維化的分期,以及臨床癥狀與病理特征間的微妙聯系。因此在未來的評分系統中,有必要對脂肪變性、血管病變的程度單獨進行評估。
(四)展望 在病毒性肝炎中,通過有效的抗病毒治療后,肝纖維化及早期肝硬化可以得到逆轉已經成為普遍的共識;但即使在有效治療后,仍有小部分患者會出現疾病的進展(失代償、肝癌)。僅僅對纖維化和炎癥進行分類已經無法滿足臨床對病理的期望,臨床渴望病理提供更多的、能夠反映疾病預后的信息。未來的評價系統,不僅需要基于纖維化、炎癥、血管的變化進行疾病階段的分級,同時還需要對參考的預后特征再次分類。