人腫瘤抑制因子Folliculin(FLCN)蛋白的原核表達純化
申一凡,黃凱悅,任亞哲,陳婷,陸昌瑞,施宇,張云龍
(東華大學 化學化工與生物工程學院,上海 201620)
Birt-Hogg-Dube′(BHD)綜合征是一種常染色體單基因顯性遺傳病,由于FLCN基因缺失或突變引起。1970年,加拿大醫生Birt、Hogg和Dube發現其臨床表現為細胞纖維瘤、腎囊腫、肺囊腫[1-3]。利用基因連鎖分析發現BHD綜合征是由FLCN基因突變和缺失引起的[4]。通過動物模型實驗發現FLCN雙基因敲除致死,而單基因敲除導致腎囊腫的產生[5-6]。目前的研究證實了FLCN作為腫瘤抑制因子在人體中發揮重要的作用,但FLCN誘發腫瘤的機制尚不明確。
FLCN蛋白具有高度保守性,并與目前已知的蛋白不具有同源性[7-8]。目前,FLCN的結構與功能的研究還處于起步階段。Nookala R.K.通過X射線衍射技術解析了FLCN的C端(341~566)的結構,推測其具有鳥苷酸交換因子的功能,但尚未得到明確的功能驗證實驗證據[9]。FLCN的N端結構域及全長的結構和功能更是未知。目前已知FLCN通過mTOR、TGF-β、自噬等細胞增殖與發育信號通路中都發揮著重要的作用[10-11],但具體分子機制還存在一定缺陷。為了更有效地揭示其結構與功能,FLCN的結構解析尤為重要,結構的解析將為功能的分析奠定基礎。
本實驗通過pGEX-6p-1載體構建GST-FLCN融合基因重組質粒,通過Top10菌種擴增基因和BL21菌種表達蛋白。通過GST親和介質、離子交換介質純化獲取GST-FLCN融合蛋白,再用Xa因子蛋白酶切除GST標簽,經二次分子篩純化獲取高純度FLCN蛋白,從而為FLCN的結構和功能研究奠定基礎。
1 材料與方法
1.1 材料
pGEX-6p-1載體、重組質粒pET28a-FLCN,由實驗室提供;E.coli Top10、E.coli BL21,質粒抽提試劑盒,膠回收試劑盒購自上海生工;限制性核酸內切酶、T4 DNA連接酶,購自NEB公司;GST親和介質,購自常州天地人和公司;高壓細胞破碎儀JNBIOJN-3000,購自廣州聚能納米生物科技股份有限公司;其余試劑皆為分析純。
1.2 方法與步驟
1.2.1 重組質粒構建
優化并構建pGEX-6p-1-GST-FLCN重組質粒,首先利用PCR擴增FLCN基因,模板為本實驗室重組質粒pET28a-FLCN,上、下游引物委托上海生工公司合成,上游引物:5'-ATACATGGATCCAATGCCA TTGTTGCCCTGTGTC-3';下游引物:5'-ATACATC TCGAGTTAATTACGAGATTCAGATGCG-3'。隨后,將PCR產物和pGEX-6p-1載體利用限制性內切酶BamH Ⅰ和Xho Ⅰ進行雙酶切,使用生工的膠回收試劑盒回收FLCN基因和載體,再在16 ℃下T4 DNA連接酶過夜連接。將連接產物轉入Top10感受態細胞后,委托上海生工進行測序鑒定。
1.2.2 表達純化GST-FLCN融合蛋白
將重組質粒轉入BL21感受態細胞中,于平板上37 ℃過夜培養。挑取單克隆,加入LB培養基中37 ℃225 r/min培養至OD600=0.5左右,加入1 mmol/L的IPTG在16 ℃誘導表達。
將菌液4 000 r/min 4 ℃離心30 min,棄上清后在冰上加入預冷凋亡1 L菌液/20 mL bind buffer(50 mmol/L Tris,500 mmol/L NaCl,pH=8.0)重懸沉淀。再加入終濃度1 mmol/L的PMSF蛋白酶抑制劑,使用細胞高壓破碎儀在4 ℃,1.3×105kPa的壓力下破碎細胞。將破碎后的菌液兩次12 000 r/min 4 ℃離心30 min。使用Wash Buffer(50 mmol/L Tris,500 mmol/L NaCl,5 mmol/L谷胱甘肽,pH=8.0)洗雜蛋白,使用Elusion Buffer(50 mmol/L Tris,500 mmol/L NaCl,20 mmol/L谷胱甘肽,pH=8.0)洗脫蛋白。將洗脫液濃縮收集。
1.2.3 Xa因子蛋白酶酶切
將純化好的GST-FLCN融合蛋白和1 μL的Xa因子蛋白酶加入Buffer(50 mmol/L Tris,1 mmol/L DTT,pH=8.0)中,4 ℃酶切過夜。將酶切后的蛋白通過GST介質親和純化,收集穿出液。
1.2.4 FLCN蛋白的分子篩純化
將酶切后的FLCN融合蛋白通過分子篩進一步純化,以獲得更高純度的FLCN蛋白。FLCN蛋白的分子量為64 kDa,使用Superdex 75層析柱,在SCGp100蛋白層析系統下進行純化。使用Buffer(50 mmol/L Tris-HCl,1 mmol/L DTT,1 mmol/L EDTA,500 mmol/L NaCl)進行上樣、洗脫及純化。
2 結果與分析
2.1 生物信息學分析FLCN蛋白組成
在Uniprot官網上下載FLCN的蛋白序列,使用EditSeq軟件對蛋白序列進行分析,結果見圖1。如圖1a,發現FLCN蛋白中大部分蛋白為疏水性氨基酸,表明其水溶性不高,為此選用了GST標簽增加其溶解性。在http://cbs.dtu.dk/services/NetNGlyc網站上對FLCN進行糖基化位點預測,發現其在494位點可能存在糖基化修飾。糖基化修飾有利于蛋白和細胞膜的接觸或結合,因而推測FLCN可能參與跨膜轉運。
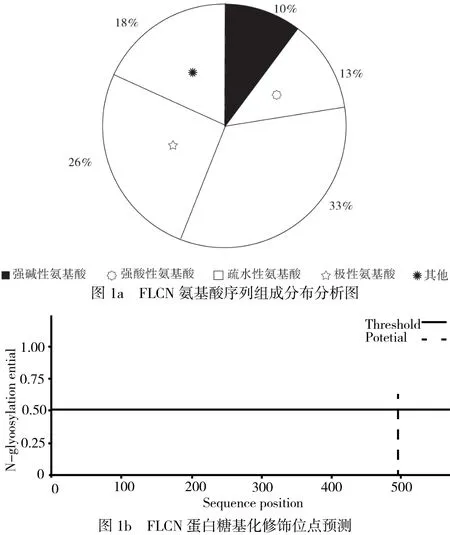
圖1 FLCN蛋白生物信息學分析
2.2 FLCN重組質粒的構建
以pET28a-FLCN為模板,使用PCR擴增目的基因。使用BamH Ⅰ和Xho Ⅰ雙酶切將目的基因和載體,并用T4 DNA連接酶將FLCN連入pGEX-6p-1載體中。將構建好FLCN重組質粒與pGEX-6p-1電泳,檢測結果如圖2所示。在生工測序結果顯示構建成功并且沒有基因突變。
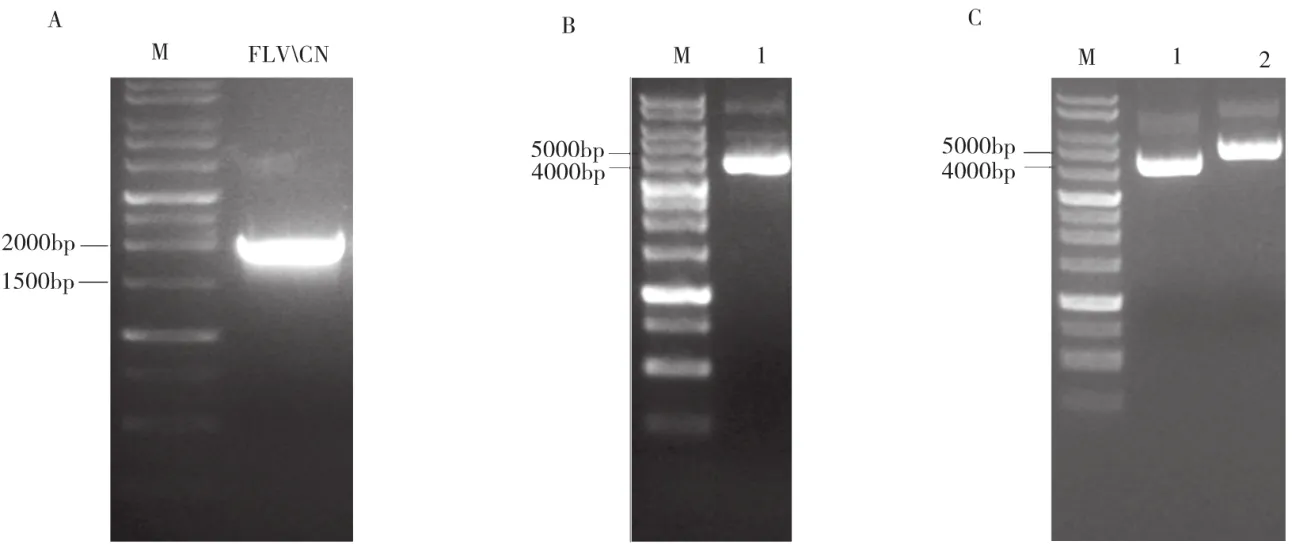
圖2 FLCN重組質粒的構建結果
2.3 GST-FLCN融合蛋白表達純化
將構建的GST-FLCN質粒轉入大腸桿菌中誘導表達,將菌液高壓破碎獲得含有目的蛋白的溶液,隨后通過GST介質純化GST-FLCN融合蛋白。使用Wash Buffer多次洗脫能將大部分雜蛋白洗去,但是還會有一些雜蛋白和目的蛋白混在一起,無法洗脫,如圖3所示。

圖3 GST-FLCN蛋白的表達純化檢測結果
2.4 GST-FLCN融合蛋白Xa因子蛋白酶酶切
在蛋白濃縮樣品中加入適量Xa因子蛋白酶,4 ℃靜止過夜酶切。將酶切樣品再通過GST介質親和純化,得到FLCN蛋白。如圖4所示,Xa因子蛋白酶酶切后得到了FLCN蛋白。
2.5 分子篩純化FLCN蛋白
GST-FLCN經過酶切后,得到的FLCN蛋白中還有一部分雜蛋白,為了獲得更高純度的FLCN蛋白,使用了分子篩進行進一步的純化。FLCN蛋白酶切后的分子量為64 kDa,所以選用Superdex 75層析柱,在SCGp100蛋白層析系統下進行純化。如圖5所示,通過SDS檢測,可以發現得到了純度較高的FLCN蛋白,其純度為90%左右。
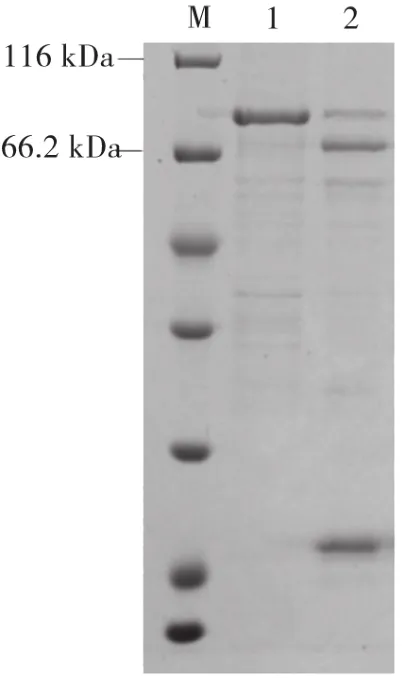
圖4 GST-FLCN蛋白酶切檢測結果
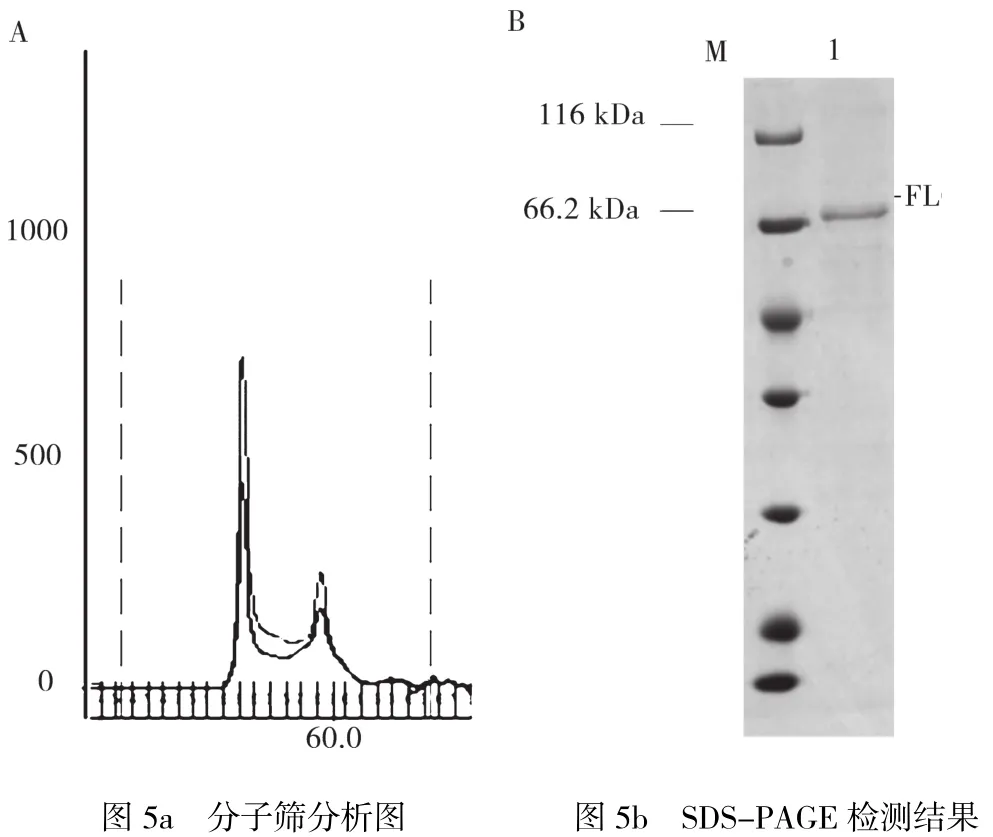
圖5 FLCN蛋白分子篩純化結果
3 結論
FLCN蛋白作為腫瘤抑制因子,在細胞中影響了細胞的增殖與凋亡,在機體中發揮著重要的作用。但目前為止,對FLCN蛋白的研究還不深入,其在機體中的作用機制還不明確。
在本實驗中,以pGEX-6p-1作為載體,在原核體系中高表達FLCN蛋白,通過GST介質親和純化,Xa因子蛋白酶酶切以及分子篩獲得的高純度的FLCN蛋白,為FLCN蛋白的結構和功能研究提供了基礎。

