BMP-2對肺癌細胞上皮-間質轉化的影響及其作用機制
王福琴
(山西醫科大學晉祠學院,山西太原 030025)
目前,肺癌發病機制仍未明確,臨床多經手術、放化療治療,但術后癌細胞侵襲性轉移、復發仍是影響肺癌患者死亡的重要原因[1]。因此,探尋肺癌細胞侵襲、轉移發生機制至關重要。而包括肺癌在內的多種腫瘤細胞侵襲、轉移與上皮-間質轉化有較大關聯。研究發現,肺癌組織中BMP-2特異性升高,可判斷預后[2]。骨形態發生蛋白(BMPs)是轉化生長因子-β超家族成員,可刺激骨細胞分化。骨形態發生蛋白-2(BMP-2)為BMPs最具代表性因子,可促進骨修復,抑制腫瘤細胞生長。但臨床就其BMP-2對肺癌細胞上皮-間質轉化影響的研究仍較少。
1 材料與方法
1.1 實驗材料
采用中國科學院上海細胞生物研究所提供的肺腺癌細胞系A549,取自12例手術切除肺腺癌組織新鮮標本,其中男8例、女4例;年齡41~75(60.05±1.55)歲。儀器包括美國Beckman公司高速低溫離心機、美國Forma Scientific公司細胞培養箱、日立公司7000型自動生化分析儀、美國BD公司Matrigel侵襲小室24孔培養板等。試劑包括Bioscience公司流式細胞檢測試劑盒、美國R&D公司BMP-2(質量濃度1 mg/mL)、美國Cell Signaling公司鼠抗人E-cad單克隆抗體、美國Invitrogen公司DMEM高糖培養液、鏈霉素、青霉素等。
1.2 方法
1.2.1 BMP-2對A549細胞上皮-間質轉化、侵襲、凋亡影響檢測
1.2.1.1 實驗分組
人肺腺癌A549細胞以青霉素、10%胎牛血清、鏈霉素制成的DMEM培養液培養;均處于對數生長期、生長良好。隨機分為A組(空白對照)、B組(10 μg/mL BMP-2處理24 h)、C組(50 μg/mL BMP-2處理24 h)、D組(100μg/mL BMP-2處理24 h),各3例。
1.2.1.2 細胞上皮-間質轉化實驗
經免疫組織化學SP法檢測E-cad表達:SP法行E-cad蛋白染色,加入一抗,4 ℃下孵育,過夜;PBS液洗滌,3次;加入二抗,37 ℃下孵育,30 min;DAB顯色,10 min;染色、脫水、透明,中性樹膠封固。陽性標準為細胞質呈棕黃色顆粒著色。400倍光學顯微鏡下檢測E-cad表達強度,每個點陣計數1 000個腫瘤細胞。陽性(++)為E-cad陽性細胞≥90%,弱陽性(+)為10%~90%,陰性(-)為<10%或完全消失。
蛋白質印跡法檢測:200 μL RIPA裂解液裂解細胞,提取蛋白,100 ℃下煮沸,5 min,混合蛋白加樣緩沖液,10% SDS-PAGE分離蛋白。室溫下封閉2 h,加入一抗、vimentin、BMP-2、β-actin單克隆抗體,4 ℃下過夜。緩沖液洗膜,3次,加入二抗,室溫孵育,1 h。緩沖液洗膜,3次,加增強化學發光試劑,室溫孵育,3 min。暗室曝光,30 s~5 min,顯影,定影,成像。目的條帶以IPP軟件行灰度分析。
1.2.1.3 細胞侵襲實驗
B、C、D組以胰蛋白酶消化細胞,離心,置于無血清DMEM培養液,細胞密度5×105/個。24孔培養板中置入Matrigel侵襲小室,以含10%胎牛血清DMEM培養液500 μL加入下室,以細胞懸液200 μL加入上室,培養24 h。PBS液洗滌,3次;37 ℃下,以4%多聚甲醛溶液固定細胞,30 min;PBS液洗滌,3次;小室內面Matrigel基質膠以棉簽清除干凈,細胞核染色,置于載玻片,200倍熒光顯微鏡下觀察。分別取每張膜上、下、左、右、中部視野計數穿膜細胞數,檢測3次,取平均值。
1.2.1.4 細胞凋亡實驗
6孔培養板內,以1×106個/mL密度接種A549細胞。B、C、D組各設置3個平行孔。作用24 h后,收集細胞,離心,PBS液洗滌,2次;結合液重懸蛋白、Annexin V-FITC避光孵育,15 min;離心,沉淀。流式細胞儀檢測細胞凋亡率,檢測3次,取平均值。
1.2.2 BMP-2促進A549細胞上皮-間質轉化、凋亡中p38 MAPK信號作用
實驗分組:進入對數生長期細胞中加入100 μg/mL BMP-2處理24 h,設為E組;E組基礎上再加終質量濃度10 μmol/L的sb203580處理細胞24 h,設為F組。分別經免疫組織化學法、FCM法等檢測p38 MAPK信號通路對BMP-2誘導A549細胞上皮-間質轉化、侵襲、凋亡的影響,方法同1.2.1。
1.3 統計處理
數據以GraphPad Prism 5軟件分析。計量資料以(±s)表示,以t檢驗對比。P<0.05為有統計學差異。
2 結果與分析
2.1 BMP-2對A549細胞上皮-間質轉化影響
B、C、D組細胞質內E-cad表達強度呈濃度依賴性降低,見圖1。C組、D組BMP-2表達水平高于A組(P<0.05),D組vimentin水平高于A組(P<0.05),見表1。
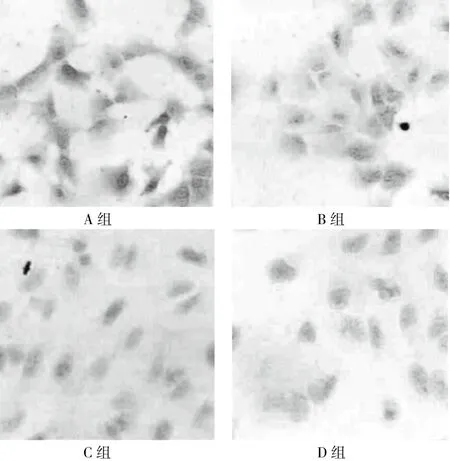
圖1 四組細胞質內E-cad表達強度
表1 四組E-cad、vimentin水平對比(±s,μg/mL)
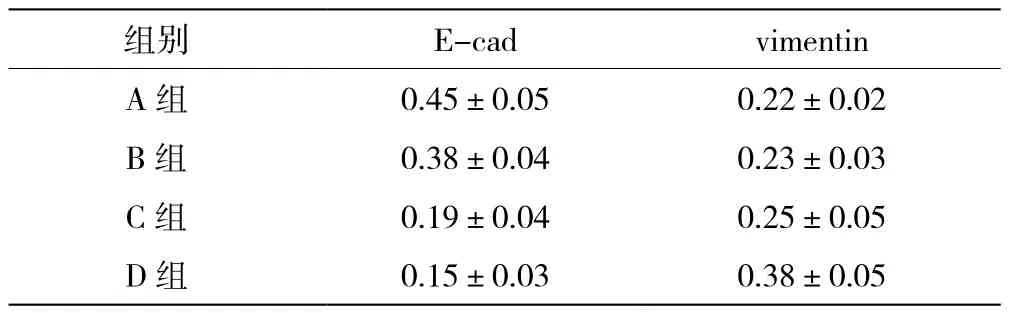
表1 四組E-cad、vimentin水平對比(±s,μg/mL)
組別E-cadvimentin A組0.45±0.050.22±0.02 B組0.38±0.040.23±0.03 C組0.19±0.040.25±0.05 D組0.15±0.030.38±0.05
2.2 BMP-2對肺癌A549細胞侵襲、凋亡的影響
B、C、D組穿過濾泡細胞數多于A組,細胞早期凋亡率低于A組(P<0.05),見表2。
表2 四組穿過濾泡細胞數、早期凋亡率對比(±s)
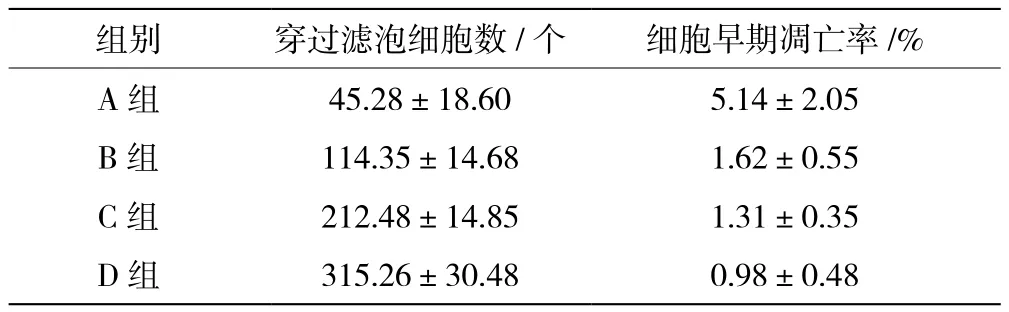
表2 四組穿過濾泡細胞數、早期凋亡率對比(±s)
組別穿過濾泡細胞數/個細胞早期凋亡率/%A組45.28±18.605.14±2.05 B組114.35±14.681.62±0.55 C組212.48±14.851.31±0.35 D組315.26±30.480.98±0.48
2.3 BMP-2促進A549細胞上皮-間質轉化中p38 MAPK信號作用
F組細胞質內E-cad表達高于E組,如圖2。F組E-cad表達水平高于E組,vimentin表達水平低于E組(P<0.05),如表3。
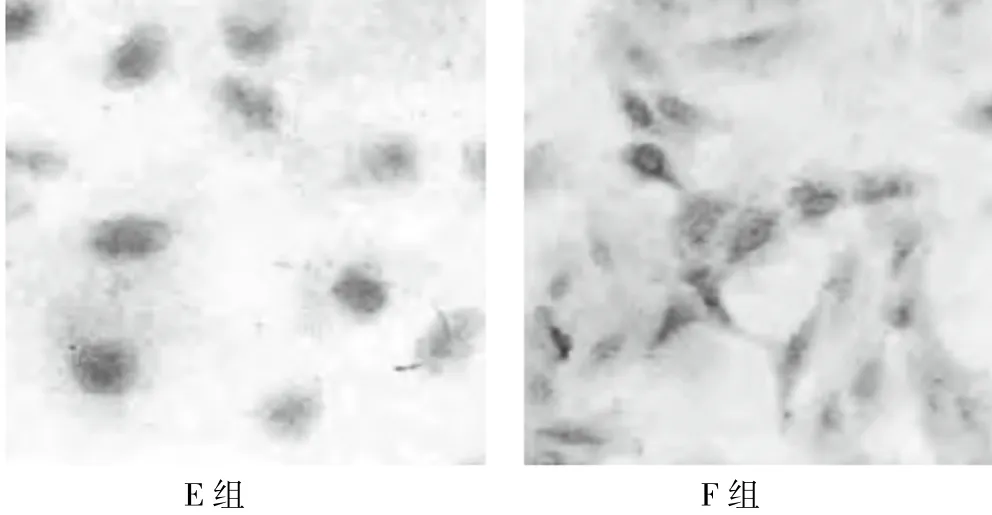
圖2 兩組細胞質內E-cad表達強度
表3 兩組E-cad、vimentin水平對比(±s,μg/mL)

表3 兩組E-cad、vimentin水平對比(±s,μg/mL)
組別E-cadvimentin E組0.20±0.100.51±0.10 F組0.31±0.110.39±0.08
2.4 BMP-2促進A549細胞侵襲、凋亡中p38 MAPK信號作用
F組穿過濾泡細胞數少于E組,細胞早期凋亡率高于E組(P<0.05),見表4。
表4 兩組穿過濾泡細胞數、早期凋亡率對比(±s)
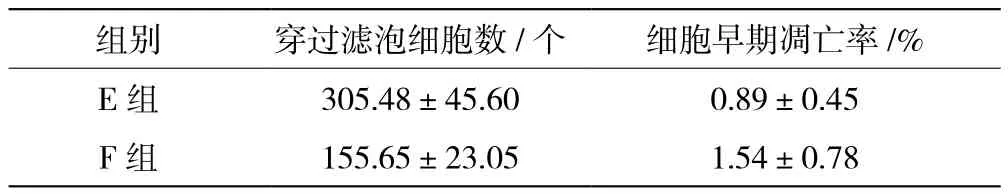
表4 兩組穿過濾泡細胞數、早期凋亡率對比(±s)
組別穿過濾泡細胞數/個細胞早期凋亡率/%E組305.48±45.600.89±0.45 F組155.65±23.051.54±0.78
3 討論
目前認為,肺癌形成是一個多因素、多步驟過程,具體發病機制尚不清楚,誘發機體死亡重要原因之一為腫瘤細胞侵襲、轉移[3]。BMP信號通路與腫瘤進展密切相關,抑制BMP受體表達可阻斷BMP信號通路,控制腫瘤細胞生長分化[4]。上皮-間質轉化即特定生理、病理狀況下上皮細胞向間充質細胞轉化現象,可致使腫瘤細胞轉變為具有較強運動能力“間質樣”細胞,且可侵入周圍組織間隙、脈管系統,引發腫瘤侵襲、轉移。而肺癌細胞上皮-間質轉化由多種細胞因子參與,如BMP-2等。BMP-2能參與調控多種基因生理活性,可引發細胞增殖、凋亡,且在組織修復、再生中作用顯著。研究發現乳腺癌細胞中存在BMP-2高表達,且參與腫瘤發生、發展[5]。但臨床就肺癌細胞中BMP-2表達的研究仍較少。
機體正常上皮細胞完整性維持中,E-cad蛋白意義顯著,該蛋白屬于上皮細胞表型特征蛋白,廣泛參與細胞間連接。本研究中,B、C、D組細胞質內均存在E-cad表達,且強度呈濃度依賴性降低。而E-cad表達下降,可反映上皮細胞特征的丟失。Vimentin是一種細胞骨架蛋白,在正常上皮細胞中不表達,但可在間質細胞中廣泛存在,如巨噬細胞、內皮細胞等,是上皮-間質轉化的一個重要因素。本研究中,隨著BMP-2濃度的提升,肺癌細胞內vimentin呈濃度依賴性增加。提示BMP-2可促使肺癌細胞向間質細胞轉化,誘導出現上皮-間質轉化。此外,B、C、D組穿過濾泡細胞數較A組多,且三組呈遞增趨勢,推測BMP-2可提升A549細胞侵襲能力。細胞凋亡為腫瘤轉移調控一個重要機制。但臨床針對肺癌細胞出現上皮-間質轉化后是否影響細胞凋亡能力仍存在較大爭議。本次研究中,B、C、D組細胞早期凋亡率均較A組低,三組呈遞減趨勢,分析可能與所選細胞株本身凋亡率偏低有關,而BMP-2可抑制A549細胞早期凋亡,且增強侵襲能力。
本研究還分析了BMP-2促進A549細胞上皮-間質轉化中p38 MAPK信號的作用。p38 MAPK是一種細胞信號轉導途徑,在腫瘤細胞出現上皮-間質轉化中發揮重要作用,且可影響多種腫瘤細胞侵襲、轉移。研究發現,p38 MAPK特異性抑制劑SB203580能激活caspase-8啟動外源性凋亡途徑,誘導細胞凋亡[6]。本研究中,F組E-cad表達水平較E組高,vimentin水平較E組低,提示p38 MAPK通路抑制劑能調控部分BMP-2誘導肺癌A549細胞上皮-間質轉化。F組穿過濾泡細胞數少于E組,早期凋亡率高于E組,故推測p38 MAPK通路抑制劑能對BMP-2誘導肺癌A549細胞侵襲能力進行抑制,并逆轉BMP-2誘導A549細胞早期凋亡。但考慮到肺癌細胞上皮-間質轉化的發生與多種復雜信號通路有關,并非由單因素決定,故今后仍需進行更深層次分析。
綜上所述,肺癌細胞上皮-間質轉化發生中BMP-2作用顯著,可經由激活p38 MAPK信號通路調控,從而促使細胞侵襲能力增強,抑制細胞凋亡。

