CRISPR-Cas9系統編輯DNA誘導基因敲除的發展及優缺點
張佳珊 譚 韜
(昆明理工大學靈長類轉化醫學研究院,昆明650500)
CRISPR(Clustered regularly interspaced short palindromic repeats)是一種特別的免疫系統,利用Cas9(CRISPR associated protein 9)蛋白酶進行切割,達到自身免疫的效果[1]。它是絕大部分細菌,以及一些古生菌的天然免疫系統。這篇綜述分別從CRISPR-Cas9靶向敲除目的基因的原理,應用CRISPR相關的實驗進行小鼠的基因編輯,CRISPR-Cas9與ZFN、TALEN、RNAi等幾種不同的基因編輯技術相比的優缺點,以及如何改進CRISPR-Cas9靶向敲除的效率等五個方面論述了CRISPR-Cas9的近期狀況。
1 CRISPR-Cas9靶向敲除目的基因原理
CRISPR(Clustered regularly interspaced short palindromic repeats)是古生菌等微生物本身處理外部DNA(Deoxyribonucleic acid)的系統,基本原理是由RNA(Ribonucleic acid)指導Cas9蛋白對靶向基因進行修飾。CRISPR是一種有趣的重復序列,存在于基因組中,CRISPR位點由一些較短的、高度保守的重復序列組成,重復序列之間會被長度為26~72 bp的間隔序列隔開,而序列長度通常為21~48 bp[2]。 CRISPR系統的基因識別功能,就是通過這些間隔序列實現的[3]。當CRISPR-Cas9系統去降解同源序列時,它是通過將DNA片段整理合并到CRISPR系統中,也就是降解了靶向序列,以此來實現靶向敲除等技術[4]。
CRISPR-Cas9系統的工作原理是Guide-RNA和Cas9蛋白結合形成復合體[5],簡單來說,復合體擔負著導向作用,引導蛋白酶在靶位點剪切目標DNA。應用特異性RNA將Cas9酶引導到基因組的靶位點上,該基因的靶位點即為需要敲除掉的基因位點,DNA的定點切割就是這樣通過CRISPR系統完成的見圖1。
2 CRISPR-Cas9編輯小鼠的免疫球蛋白基因
2016年,Cheong等[6]利用CRISPR-Cas9系統來編輯小鼠免疫球蛋白基因。其原理是通過Guide-RNA和Cas9結合來誘導免疫球蛋白重鏈(IgH)的類別轉換重組(CSR),來得到需要的Ig亞型。
Cheong等[6]首先構建了一個以小鼠免疫球蛋白重鏈(IgH)為靶向目標的系統,利用有缺陷的小鼠B細胞,使用逆轉錄酶病毒載體表達Cas9。其中有缺陷的B細胞需要選擇缺乏AID的B細胞[7]。AID,即活化誘導胞嘧啶脫氨酶,它是一種抗體變異蛋白,在缺乏AID小鼠的B細胞中,不能形成S區的雙鏈DNA斷裂(DSB)[8]。而CSR是須要通過DNA的切除和非同源末端連接實現的,而不能形成雙鏈DNA斷裂的B細胞無法實現非同源末端連接,也就是說缺乏AID的小鼠B細胞在自然條件下是不能完成類別轉換重組的過程,所以選擇了AID缺陷的B細胞來做。當Guide-RNA和Cas9結合之后,Cheong等[6]觀察到一小部分B細胞從IgM轉化成IgG1,生成了免疫球蛋白重鏈的亞型,說明CRISPR-Cas9在小鼠B細胞中進行類別轉換重組成功了。
這個實驗同樣可以在小鼠雜交瘤細胞中重復,能夠檢測到IgM+,甚至水平比普通B細胞中檢測到的CSR還要高[9]。結果是小鼠雜交瘤中分泌抗體ab片段,而不是完整的免疫球蛋白,這意味著,小鼠的免疫球蛋白基因可以通過CRISPR-Cas9進行基因編輯得到想要的IgH亞型或者片段[10]。
3 應用CRISPR-Cas9進行基因編輯治療杜氏肌營養不良
2016年,Young等[11]應用CRISPR-Cas9技術成功的在小鼠身上找到了治療人類杜氏肌營養不良的可能性。
杜氏肌營養不良(DMD)發病是由一個在人體
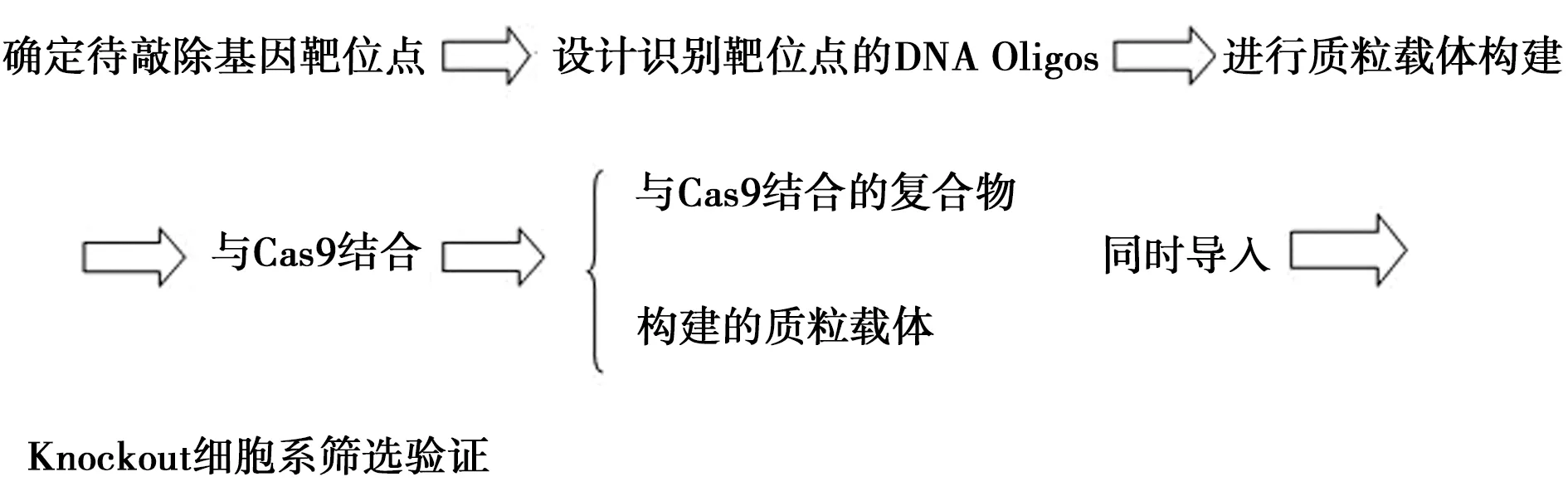
圖1 CRISPR-Cas9靶向敲除目的基因的基本操作步驟Fig.1 Basic operation procedure of CRISPR-Cas9 target knockout gene
內調控肌纖維的基因突變引起的[12]。這個名為dystrophin基因的作用是幫助加強和連接肌肉纖維和細胞。
Young等[11]發現,當敲除突變基因后,母體小鼠能夠生成人類dystrophin蛋白。也就是說,可以通過CRISPR技術進行基因編輯來逆轉蛋白的表達,而后治療杜氏肌營養不良患者。這個實驗的成功進行,表明未來人類在治療杜氏肌營養不良方面有所希望,可以說是應用CRISPR技術的一個最新成果,同時也是一個很大的突破。
4 經CRISPR-Cas9技術在母體小鼠體內形成嵌合體
將Cas9/sgRNA作用于受精卵的標記基因,體外發育為囊胚,注入大鼠的iPSCs,于小鼠體內培養,能夠在母體內發現嵌合體[13]。基于這項技術的實驗,分別敲除了小鼠的Pdx1、基因、Nkx2基因、Pax6基因(控制小鼠胰腺、心臟、眼的合成),囊胚內注入iPSCs后,母體小鼠體內形成的嵌合體分別檢測到有胰腺、心臟和眼的形成[14,15]。見圖2。
這項技術的成功應用,表明有基因缺陷的小鼠可以通過注射iPSCs 在母體內形成無基因缺陷的嵌合體,對于未來治療人類由基因缺失引起的失明或者心臟病提供了一個新的思路[16]。
5 CRISPR-Cas9與不同的基因編輯方法相比的優勢和不足以及發展前景
傳統的基因編輯辦法包括轉錄激活因子核效應物核酸酶(Transcription activator-like effector nuclea-ses,TALEN)、鋅指核酸酶(Zinc-finger nucleases,IFN)以及RNAi等[17]。
5.1RNAi的作用機制 RNAi,即RNA干擾,是指雙鏈RNA 被特異的核酸酶降解,產生小干擾RNA(siRNA),siRNA與同源的靶RNA互補結合,能夠特異性降解靶RNA,以此達到抑制或下調基因的表達目的。但這種基因編輯方法的缺點是存在不可預知的脫靶情況[18]。
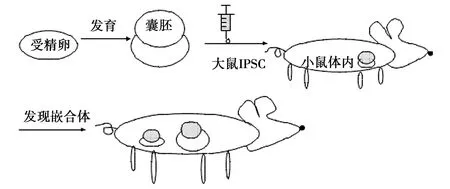
圖2 經過體外培育的基因缺失囊胚,通過注射大鼠iPSCs,在母體內形成無基因缺失的嵌合體Fig.2 Gene-deficient blastocyst was cultured in vitro,by injecting iPSCs of rats,forming normal chimera in mother
5.2TALEN的作用機制 TALEN的工作原理相比RNA干擾來說更加簡便可行,具體來說,是結合特定的一段DNA序列,通過切割這一序列的特定位點來造成DNA雙鏈斷裂(DSB)。在DNA的雙鏈斷裂后,通過DNA自我修復,來完成多種基因編輯功能[19]。這種技術能夠廣泛應用于植物、哺乳動物、人類、大鼠等多種研究對象,甚至于在CRISPR問世前,它是最主要的編輯技術。
5.3ZFN的工作原理 ZFN與TALEN類似,仍然先對DNA雙鏈分子進行切割,形成DSB,通過應用細胞的自我修復機制來完成DNA的基因修復。
5.4CRISPR-Cas9的作用機制和原理 CRISPR-Cas9則是Guide-RNA和Cas蛋白結合形成復合體,復合體起導向作用,引導核酸酶 Cas9 蛋白在靶位點上剪切雙鏈脫氧核糖核酸,從而完成通過CRISPR技術對 DNA 的定點切割。CRISPR作為一種新興的基因組編輯技術,具有效率高、性價比高、敲除效果好等優點[20]。
5.5TALEN和CRISPR-Cas9的效率比較 Ding等[21]人分別利用TALEN和CRISPR-Cas9兩種方法對同一基因進行了修飾,實驗結果表明效率分別是0%~34%和51%~79%,通過這個結果,Ding等[21]人充分驗證了CRISPR的高效性。此外從實驗角度看來,CRISPR比TALEN更容易操作,因為每一對TALEN都需要重新合成,但是CRISPR技術應用中的Guide-RNA的設計則簡便許多。
在另一個關于TALEN和CRISPR的效率比較的實驗中,結果相差不多。Li等[22]人分別使用CRISPR和TALEN來修復DMD患者的肌營養不良基因。結果二者敲除的效率都差不多,使用T7EI酶檢測脫靶,其中CRISPR包含5個脫靶位點,最高包含三對錯配。在這個實驗中,脫靶的效率是在可接受的范圍之內的。
6 如何實現高效率的靶向敲除
CRISPR技術問世不久,就顯示出其各方面的優點,比如敲除效率高、操作簡便等,但同時脫靶效率很高也是CRISPR不可忽視的缺點,其中最為明顯的就是Cas9會在基因組的一些脫靶位點進行剪切,脫靶的影響不容忽視[23]。Kuscu等[24]經過研究發現,CRISPR技術脫靶位點的多少主要取決于gRNA,假如Cas酶失活,那么脫靶率將大大增加。Wiles等[25]則認為CRISPR-Cas9靶向特異性是由5′端的序列以及PAM序列綜合決定的。由此推斷,sgRNA應當選用與基因組位點不同或不相似的序列。由此,Wiles等[25]人指出了一些可以與某些軟件聯合使用,來減少脫靶效應的方法:①全基因組同源性檢索。但很多時候由于條件所限,全基因組測序存在一定的不可行性,此方法的實際操作性還有待考證。②在導向序列的長短上進行改進,試著將序列長度變短。③對Cas9進行基因工程改造。
7 討論
CRISPR-Cas9能夠高效發揮識別和降解入侵的外源DNA功能[26],同時,CRISPR-Cas9具有以下幾個優點:①構建方便,簡單快捷。②高效的介導基因定點敲入,能同時沉默任意數量基因。③前景廣闊,能應用于臨床醫學。④價格便宜,性價比高。
眾所周知,CRISPR-Cas9目前最大的缺點就是嚴重的脫靶性。除此之外,Cas9酶導入目的基因后的殘留也是個大問題。目前并沒有有效的手段在Cas9-sgRNA奏效后去除Cas9[27]。就像人會有免疫反應,如果在實驗對象體內存留時間過久,可能會出現不可預知的結果。另外,CRISPR敲除的效率雖然比較高,但傳代后的穩定性卻不是很確定。CRISPR的修飾同時還受到PAM位點+sgRNA的限制[28]。
2017年5月,發表在Nature Methods的一篇文章,提出了CRISPR基因編輯方法的一個致命缺點:引起基因突變[29],該研究成果顯示應用CRISPR-Cas9基因編輯技術可以對基因組引進很多意想不到的錯誤,數量上甚至可以達到數百個,其中包括基因組單核苷酸突變和基因組的非編碼區域突變。正如上文提及的cas9導入后的殘留可能是影響基因突變的一個重要原因,而在其他實驗中沒有出現如此嚴重的突變情況,可能的原因之一是gRNA的設計略有偏差,造成細胞分泌過量的Cas9,以至于造成了重大脫靶效應。此外,另一個可能的原因則是小鼠體內的DNA本身發生的變異,并不能完全歸結到CRISPR-Cas9應用的后果上。
這項研究同時也表明,一直以來所使用的普通測序可能沒有辦法發現一些潛在的、重要的突變。但同時,全基因組的測序過于耗時耗力,在普通的研究和實驗中是難以實現的。
總的來說,CRISPR-Cas9系統的應用范圍是十分廣泛的,包括基因敲除、修飾、治療等。還可以在臨床上對疾病修飾和病毒修飾做出貢獻[30]。雖然伴隨著一些脫靶效應的出現,但目前研究成果尚不完善,也許是由于小鼠體內細胞的一些未知變化導致的,而這些變化或許日后可以通過修改gRNA或是使用其他品系的小鼠進行改變。此外,這種大范圍大規模的突變也許存在很多潛在的風險,然而在沒有進行全基因組的測序發現這個問題之前,我們可以大膽假設在應用CRISPR/Cas9編輯基因后,某些點突變(Single-nucleotide variant)已經存在,更加重要的是這些突變是否影響了生物體的機能。每一種新技術的產生和應用都是一把雙刃劍,必然伴隨著或多或少的副作用,所以可以預測未來CRISPR-Cas9基因編輯系統仍然會對基因治療、人類遺傳病、腫瘤、癌癥等的治療做出非常大的貢獻,但在進行實驗研究的過程中,具體的測序方法還值得進行進一步改進。

