對比增強能譜乳腺X線攝影診斷乳腺影像報告和數據系統4類鈣化
龍 蓉,曹 崑,曹 敏,李海蛟,孫應實
(北京大學腫瘤醫院暨北京市腫瘤防治研究所醫學影像科 惡性腫瘤發病機制及轉化研究教育部重點實驗室,北京 100142)
鈣化是乳腺X線檢查中最主要的影像學征象之一,40%乳腺癌中可出現鈣化[1],80%導管原位癌僅表現為乳腺鈣化[2]。部分乳腺病變X線僅以鈣化為征象,不伴腫塊或結構扭曲等其他征象,故只能依據鈣化分布和形態對乳腺疾病進行定性診斷。依據美國放射學會(American College of Radiology, ACR)發布的2013版乳腺影像報告和數據系統(breast imaging reporting and data system, BI-RADS)指南[3],BI-RADS 4類病變惡性可能性為2%~95%,需進行活檢等進一步檢查,以獲得定性診斷[4]。研究[5]表明,BI-RADS 4類鈣化中,僅20%~25%最終病理結果為惡性。因此,提高乳腺鈣化的診斷效能成為目前研究的熱點。對比增強能譜乳腺X線攝影(contrast-enhanced spectral mammography, CESM)在常規乳腺X線攝影的基礎上應用對比劑,可以同時獲得乳腺病變的形態學和血供信息。本研究對比分析CESM和常規全視野數字化乳腺X線攝影(full-field digital mammography, FFDM)在BI-RADS 4類鈣化中的診斷價值。
1 資料與方法
1.1 一般資料 收集2015年1月—2016年12月于我院接受FFDM檢查及乳腺鈣化灶經術前導絲定位的48例乳腺疾病患者(FFDM組),均為女性,年齡32~72歲,平均(48.7±8.2)歲;收集2017年3月—2018年1月于我院接受CESM檢查的30例乳腺疾病患者(CESM組),均為女性,年齡37~76歲,平均(47.9±7.4)歲。納入標準:①乳腺X線片中出現鈣化征象,不伴腫塊或結構扭曲等其他征象;②根據ACR BI-RADS分類標準[3]診斷為BI-RADS 4類病變;③臨床體檢或超聲均未于病變部位發現軟組織腫塊;④于我院接受乳腺鈣化活檢或手術切除,獲得病理結果。排除標準:3個月內病變側乳腺接受過干預或治療,如手術、活檢、放射治療等。
1.2 儀器與方法 FFDM檢查采用GE Senographe Esse和Siemens Novation DR鉬靶機,行雙側乳腺標準體位投照,包括頭足(craniocaudal, CC)位和內外側斜(mediolateral oblique, MLO)位。采用自動管電壓及管電流。
CESM檢查采用GE Senographe Essential CESM鉬靶機。檢查前于立位經前臂血管團注含碘對比劑碘海醇(300 mgI/ml),劑量2 ml/kg體質量,流率2.5 ml/s,開始注射對比劑后2~7 min內對雙側乳腺依次行CC位及MLO位攝片,在同一壓迫體位下進行低能和高能射線攝影,低能射線為26~31 kVp,高能射線為45~49 kVp,采用自動管電流和管電流,分別獲得低能圖像和高能圖像,經后處理得到減影圖像。
1.3 圖像分析 由2名有3年工作經驗的放射科醫師在不知曉臨床及病理結果的情況下分別獨立閱片,意見不同時由第3名具有15年以上工作經驗的上級醫師最終確定。以ACR BI-RADS分類中的鈣化描述為依據,對所有鈣化的分布和形態進行分類描述。將鈣化根據形態分為無定形、粗糙不均質、細小多形性、細線樣或細分枝狀及其他形態;根據分布分為團簇狀、區域性及段樣,計算各鈣化的分布和形態診斷惡性鈣化的效能。根據ACR BI-RADS分類,在FFDM圖像上,將BI-RADS 4C類鈣化診斷為惡性。在CESM圖像上,以鈣化處有無強化為標準,有強化診斷為惡性,無強化診斷為良性。
1.4 統計學分析 采用SPSS 20.0統計分析軟件。以病理結果為金標準,分別計算FFDM及CESM診斷惡性鈣化的敏感度、特異度、陽性預測值、陰性預測值及準確率。采用χ2檢驗比較FFDM與CESM對惡性鈣化診斷效能和2組間鈣化特征。P<0.05為差異有統計學意義。
2 結果
2.1 FFDM組 48例均為單發鈣化病灶,共納入48個病灶,其中惡性病灶13個,包括12個導管原位癌,1個腺樣囊腺癌;良性病灶35個,包括24個乳腺腺病,3個纖維腺瘤,2個導管內乳頭狀瘤和6個乳腺組織。根據鈣化形態及分布特征診斷惡性鈣化的敏感度、特異度和準確率見表1。FFDM診斷惡性鈣化的敏感度、特異度、陽性預測值、陰性預測值及準確率分別為69.23%(9/13)、77.14%(27/35)、52.94%(9/17)、87.10%(27/31)及75.00%(36/48)。
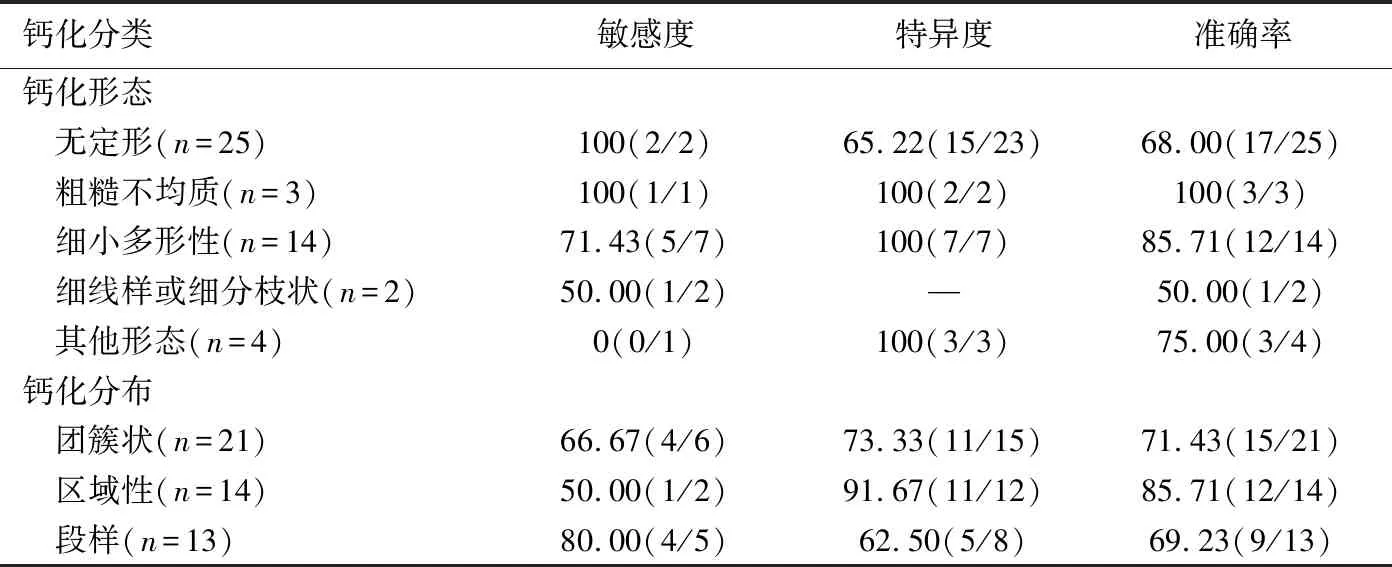
表1 FFDM組各鈣化形態和分布特征診斷惡性鈣化的效能[%(個)]
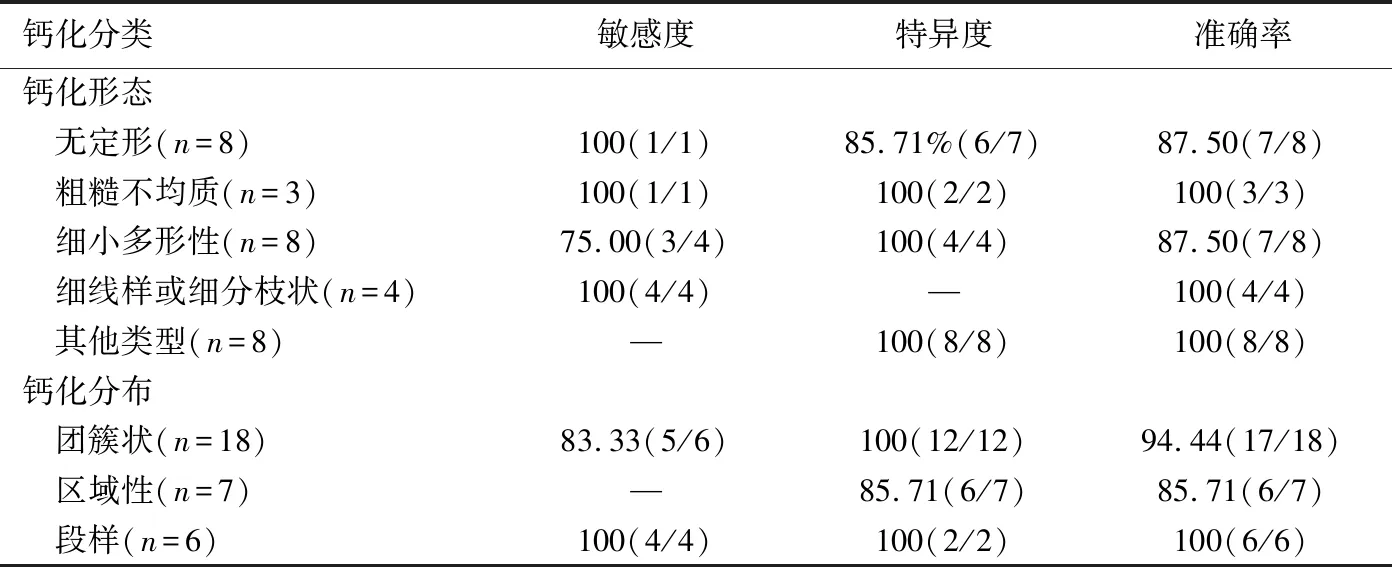
表2 CESM組各鈣化類型和分布特征診斷惡性鈣化的效能[%(個)]
2.2 CESM組 30例中,29例單發,1例多發,共31個病灶,多發病變為非同質病灶,最終納入31個病灶,其中惡性病灶10個,包括8個導管原位癌,2個浸潤性導管癌;良性病灶21個,包括乳腺腺病15個,纖維腺瘤3個,導管內乳頭狀瘤1個,乳腺組織2個。
10個惡性鈣化中,9個診斷正確,21個良性鈣化中20個診斷正確,1個假陰性為導管內原位癌,1例假陽性為導管內乳頭狀瘤。CESM診斷惡性鈣化的敏感度、特異度、陽性預測值、陰性預測值及準確率分別為90.00%(9/10)、95.24%(20/21)、90.00%(9/10)、95.24%(20/21)及93.55%(29/31),見圖1、2。CESM組各鈣化形態及分布特征診斷惡性鈣化的的敏感度、特異度和準確率見表2。
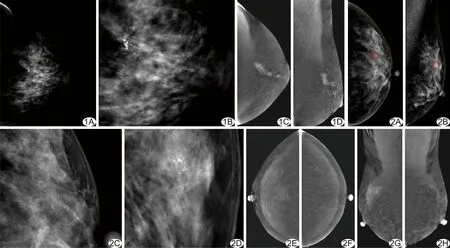
圖1 患者45歲,超聲體檢發現左乳鈣化,穿刺活檢病理證實為浸潤性導管癌 A、B.CESM低能圖像CC位(A)和鈣化部位局部放大(B)圖像示左乳外上象限段樣分布微鈣化; C、D.CESM減影圖像CC位(C)和MLO位(D)示鈣化處可見強化 圖2 患者46歲,左側乳腺低級別導管原位癌 A~D.CESM低能圖像,A為CC位,B為MLO位,C、D分別為A、B局部放大圖像,顯示左側乳腺外象限團簇狀鈣化; E~H.CESM減影圖像顯示雙側乳腺體強化,左側乳腺鈣化處及周圍腺體亦可見強化
2.3 FFDM與CESM的診斷效能對比 CESM診斷BI-RADS 4類鈣化的陽性預測值及準確率均高于FFDM(χ2=3.891、4.444,P=0.049、0.035),敏感度、特異度及陰性預測值差異無統計學意義(χ2=1.433、3.186、0.955,P=0.231、0.074、0.329)。
FFDM與CESM組患者間鈣化形態及分布差異無統計學意義(χ2=9.160、1.557,P=0.057、0.459)。
3 討論
3.1 乳腺微鈣化的診斷方法及對比 乳腺X線攝影是檢出乳腺鈣化最敏感的方法,優于超聲和MRI。鈣化形態和分布是判斷良惡性的重要因素,團簇狀、段樣或線樣分布鈣化比散在或區域性分布的鈣化惡性可能性大,無定形、細小多形性及細線樣或細分枝狀鈣化的惡性可能分別為20%~26%、25%~41%和>80%[6]。典型惡性鈣化或鈣化同時伴腫塊或結構扭曲等其他征象時,臨床不易漏診或誤診;但以鈣化為唯一征象、尤其形態類型難以分類時,判斷良惡性較困難。乳腺X線診斷的BI-RADS 4類鈣化中,最終僅20%~25%病理為惡性[5],提示以鈣化為診斷標準,敏感度高而特異度較低。
超聲對乳腺結節的敏感度較高,但對鈣化不敏感,僅能發現35.3%乳腺鈣化[7],在不伴腫塊時無法根據鈣化本身形態來判斷良惡性。動態增強MRI是目前檢出乳腺癌最敏感的方法,敏感度達79%~98%[8],但不能直接顯示鈣化,僅能參考X線片中鈣化的位置,觀察相應區域是否有強化及強化方式來判斷鈣化部位是否存在惡性病變,診斷BI-RADS 4類鈣化良惡性的敏感度、特異度和準確率為96%、82%和88%[9];但乳腺X線與MR檢查體位不同,前者為站立位,且在壓迫狀態下腺體重疊,而后者采取俯臥位檢查,腺體處于自然下垂狀態,導致MRI上難以精準定位X線片所示鈣化[10]。
3.2 CESM對乳腺鈣化診斷的價值 CESM是在傳統乳腺X線攝影技術基礎上結合使用對比劑的一項新檢查技術,在同一個壓迫體位,可在很短時間間隔內進行低能和高能2個不同能量射線的照射,獲得2組圖像,低能射線的能量一般為26~31 kVp,高能射線的能量一般為45~49 kVp。碘原子發生電離的最低能量為33.2 keV[11],在低能X線照射下,碘不能吸收X線發生電離,而軟組織能夠吸收低能X線,因此低能圖像相當于傳統的乳腺X線攝影圖像;而在高能X線照射下,碘及軟組織均能夠吸收X線,故高能圖像與低能圖像的減影圖像為碘攝取圖像。Lobbes等[12]比較113例同時接受CESM和FFDM檢查的患者,發現CESM診斷乳腺癌的敏感度、特異度均高于FFDM。uczyńska等[13]報道,CESM診斷乳腺癌的敏感度和準確率為100%和79%,MRI為93%和73%,兩者比較,CESM敏感度高于MRI。CESM一次曝光可獲得2組圖像,其中低能圖像與傳統乳腺X線攝影圖像類似,可用于評價鈣化的形態和分布;而減影圖像與MRI增強圖像類似,可用于評價鈣化部位是否存在可疑血供。CESM結合了乳腺X線攝影和增強MRI的優勢,有望提高對乳腺鈣化的診斷效能。Cheung等[14]分析了94例BI-RADS 4類鈣化患者的CESM圖像,其診斷惡性鈣化的敏感度、特異度、陽性預測值、陰性預測值及準確率分別為88.89%、86.56%、72.72%、95.08%及87.24%,本研究結果與之相似。本研究結果顯示,CESM診斷惡性鈣化的陽性預測值和準確率均高于FFDM(P均<0.05)。通過對鈣化形態和分布進行分類,本研究發現CESM和FFDM對不同類型鈣化的診斷能力有所差別,但本研究中樣本量較少,尚需增加樣本數量以進一步驗證所獲結果。
與既往研究[14-15]結果相似,本組1例CESM中假陰性患者為導管內原位癌,這也是MRI易漏診的病變。對此類病變,CESM較MRI的優勢在于能夠同時分析鈣化形態,CESM讀片時應兼顧低能圖像表現,同時輔以減影圖像所示強化特征。另外,本組CESM出現誤診或漏診的病例與正常腺體廣泛強化、影響病灶局部判斷有關(圖2)。注射對比劑后,正常乳腺腺體在CESM上也會產生強化,廣泛的正常腺體強化必然會對病灶的強化產生遮掩,且惡性簇狀鈣化的強化范圍通常較小,在腺體強化的背景下不易發現。臨床工作中需反復仔細閱片,并與對側乳腺進行對比,以盡可能降低誤診或漏診。
本研究的不足在于CESM應用于臨床的時間短,經驗較少,在判斷強化上仍有很多困難;樣本量較小,仍需擴大樣本量、積累經驗,以進一步觀察CESM的應用價值。
總之,作為一種新的乳腺檢查方法,CESM既能提供常規乳腺X線的影像信息,又能觀察病變的血供情況,有利于提高對BI-RADS 4類鈣化的診斷效能。

