草魚腦細胞原代培養
周 怡,郭本月,魏萬權,袁小琛,梁旭方
(1.中國海洋大學食品科學與工程學院,山東 青島 266000;2.青島蔚藍生物集團有限公司,山東 青島 266000;3.青島瑪斯特生物技術有限公司,山東 青島 266000;4.華中農業大學水產學院,湖北 武漢 430070)
構建細胞體外培養體系是魚類生理代謝機制研究的重要手段。與活體實驗相比,采用魚類培養細胞作為實驗對象不僅實驗成本低,可以精確控制實驗條件,重復性、均一性也較好,還可以同時提供大量生物學性狀相似的實驗對象[1-2]。這些優點使得魚類細胞在生物學研究領域中得到廣泛應用,已被應用于細胞生物學、病毒學、環境毒理學、腫瘤學以及資源保護等方面[3-5]。因此,深入研究魚類細胞培養,不僅能推動魚類生理相關理論研究,在實際應用方面也具有一定意義。
神經細胞系是開展神經發育生物學及生理機制研究的重要工具。近期國內外學者進行了多種魚類腦細胞的培養工作,包括卡特拉魚、羅非魚、海鱸魚、玳瑁石斑魚、青石斑魚以及斜帶石斑魚等[6-12]。研究者多采用離體腦細胞進行病毒感染及污染物毒理學研究,其應用遠不及哺乳動物廣泛。本研究參考其他魚類相關研究成果,初步探討了草魚腦細胞的原代培養技術,以期為研究魚類腦部生理規律及其調控機制提供新的技術和思路。
1 材料與方法
1.1 實驗動物
草魚購于湖北仙桃排湖漁場,暫養于實驗室循環水系統,選取健康且體表無損傷的個體,平均體重(187.50±8.42)g。
1.2 實驗試劑
L-15液體培養基、胰蛋白酶均為Gibco公司產品;胎牛血清(FBS)為Hyclone公司產品;CellTiter 96?AQueous One Solution Cell Proliferation Assay為Promega公司產品。青霉素、鏈霉素、兩性霉素分別配制成母液,經0.22 μm濾過除菌,分裝,-20℃保存。PBS緩沖液:0.01M Na2HPO4、0.01M NaH2PO4、0.15M NaCl,pH 7.2,高壓滅菌,4℃保存。4.0%臺盼藍母液,用濾紙過濾,4℃保存,使用時用PBS將其濃度稀釋至0.4%。
1.3 細胞原代培養
實驗草魚冰上麻醉,剪斷鰓部脈弓,放血約10 min,70%乙醇體表消毒。在無菌條件下,解剖取腦,以含有抗生素500 IU/mL青霉素和500 μg/mL鏈霉素及2.5 μg/mL兩性霉素的PBS緩沖液沖洗3次。分別采用不同方法嘗試進行原代培養:1)組織塊培養法,用眼科剪將組織剪碎成約1~2 mm3的小塊。用完全培養基(10 % FBS,青霉素100 U/mL、鏈霉素100 μg/mL、兩性霉素2.5 μg/mL)浸潤培養瓶,將組織塊轉移到培養瓶中,均勻排列,加入1 mL完全培養基,于28℃ CO2培養箱(SANYO,MCO-18AIC)中培養。在培養的1~2 d內避免移動培養瓶,以便組織塊貼壁,在2~3 d吸出培養基,添加3 mL新鮮培養基繼續培養。2)消化法,用眼科剪將組織切成2~3 mm3小塊,以便于消化。0.25%胰蛋白酶酶解處理,期間輕輕搖動數次。消化液混濁則吸出少許消化液于顯微鏡鏡檢,若組織已分散成單個細胞或細胞團即終止消化。通過30 μm不銹鋼篩,濾掉尚未充分消化開的組織塊。600 rpm低速離心10 min收集細胞,完全培養基再懸浮,于28℃培養箱中培養。3)機械破碎法,在完全培養基浸潤的細胞培養皿中,將腦組織置于200目滅菌尼龍網上,采用無菌注射器的橡膠推頭輕輕擠壓使腦組織通過網孔,得到細胞懸液,收集細胞懸液后通過 100目的尼龍網過濾,600 rpm低速離心 10 min 洗滌細胞一次,棄掉上清液后加入完全培養基重懸浮后,于28℃培養箱中培養。
1.4 細胞活力測定
細胞活力測定采用CellTiter 96?AQueous One Solution Cell Proliferation Assay試劑盒測定。采用如1.3中機械破碎法制備細胞懸液,取出20 μL細胞懸液,加入等體積的0.4%臺盼藍染液,利用血球計數板快速估算細胞密度以及檢驗細胞成活率[細胞成活率(%)=活細胞總數/(活細胞總數+死細胞總數)×100],當細胞活力大于90%時可用。用完全培養基將細胞稀釋至2×106個/mL,細胞懸液分別接種到24孔及96孔細胞培養板,培養24 h后細胞貼壁穩定,在培養24、48、72、96、120 h后,分別計數其細胞數及測定其細胞活力。實驗開始時,向培養板每孔中加入20 μL CellTiter 96?AQueous One Solution Reagent溶液,黑暗中孵育 4 h后終止培養,490 nm波長讀取吸光度值。
2 結果與分析
2.1 草魚腦細胞形態學觀察
本實驗采用臺盼藍檢驗,死細胞被臺盼藍染色,顯微鏡下可見為淺藍色細胞,而活細胞膜結構完整使染料未進入細胞內,顯微鏡下呈無色透明狀。顯微鏡觀察并計數,采用機械法分離制備的草魚腦細胞的細胞成活率達到92.2%,表明細胞存活率較好。
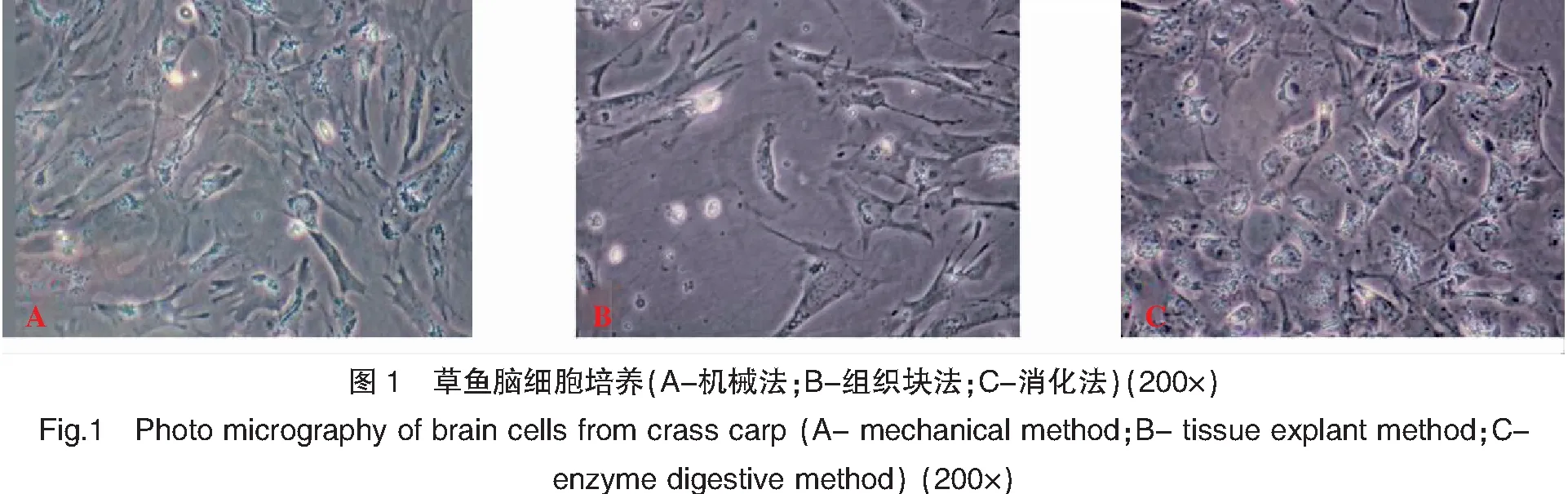
培養24 h后觀察到機械法培養腦細胞貼壁,呈不規則的多角形,貼壁的細胞多為上皮樣細胞形態,并匯合形成單層細胞(圖1A)。組織塊法獲得的細胞培養24 h后觀察也多呈多角形,細胞形態與機械法類似,但是細胞貼壁數量較機械法少(圖1B)。而消化法獲得的近乎圓形的細胞較多,少量不規則的多角形細胞(圖1C)。
2.2 原代培養及細胞活力
在5 d培養期內,細胞數量如表1所示,培養24 h細胞數目為2.53×106個/mL,而培養48~72 h細胞數目明顯增多,約為原來數量的2.6倍,但是隨著培養時間的增長,細胞進入衰退期,細胞數目減少至5.2×105個/mL。

表1 不同培養時間草魚腦細胞的細胞數目(106個/mL)
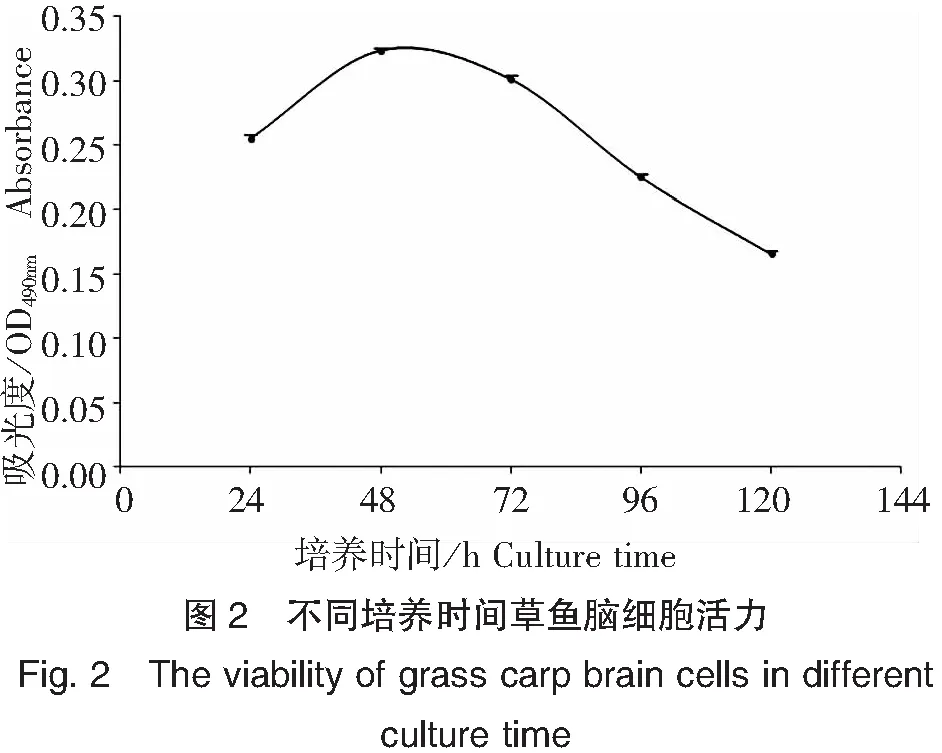
細胞活力隨培養時間的變化如圖2所示,草魚原代腦細胞的活力在前3 d培養期內基本保持穩定,第4天開始下降,第4、5天的細胞活力分別比第1天下降了11.7%和34.8%,說明3 d培養期是進行原代草魚腦細胞體外實驗比較合適的時間段。
3 討論
目前,魚類細胞作為研究工具頗受關注,已經被應用到魚類腫瘤學、環境毒理學、遺傳學、內分泌學、生理學和資源保護等方面。與體內實驗相比較,魚類細胞培養具有一定優勢:細胞培養產品標準化程度高、均一性好;魚類離體培養細胞尤其是原代培養細胞,其生理生化功能接近在體狀態,能夠快速獲得實驗結果;而且可根據魚類生長階段,進行不同時期影響研究;可重復性高,離體條件下可以更為精確控制實驗條件,有針對性地開展研究[1,3-4]。因此,本研究成功進行了草魚腦細胞的原代培養,為進一步開展體外生理調控機制研究提供基礎。
魚類種類、年齡以及不同組織器官的生理結構不同,不同細胞內環境也存在很大差異,因此,不同組織器官材料的取材方法、培養方式以及培養條件也因細胞而異[5]。本實驗嘗試了不同的培養方法以獲得草魚原代腦細胞。組織塊固定法操作相對簡單,但是獲得單層細胞時間較長,細胞得率較低。消化法細胞獲得量大,均一性較好,貼壁后可迅速形成單層細胞,但是要根據不同組織調整消化酶濃度以及消化時間,否則消化過度會損傷細胞。機械法操作同樣相對簡便、快速,但對組織機械損傷較大,且細胞分散效果差于消化法,僅對纖維成分少的軟組織,如腦組織、胚胎組織較為適用[4]。本研究比較了以上三種培養方法,其中采用機械法獲得草魚原代腦細胞,細胞分散較為均勻、形態良好。
影響細胞體外培養效果的因素包括血清濃度、培養基、培養溫度等。不同研究在進行不同物種的腦細胞培養時所采用的體系不盡相同。血清濃度與培養基大多采用含有10%~20%胎牛血清的L-15培養基[6-10];哺乳動物多采用37℃作為培養溫度,而在魚類培養細胞實驗中采用的溫度因種類不同而有所差異,如培養青石斑魚28℃[6],斜帶石斑魚30℃/35℃[7],羅非魚腦細胞25℃[7],卡特拉魚腦細胞28℃[8],海鱸魚22℃[9],玳瑁石斑魚30℃[10]本研究用含有10%胎牛血清的L-15培養基在28℃進行培養,獲得了生長相對穩定的腦細胞,可能是由于物種不同,細胞培養條件也存在一定的差異。魚類是變溫動物,在一定的溫度范圍內可以保持細胞功能和生理的完整性,對于魚類細胞培養溫度的選擇方面尚無定論。草魚最適生長溫度為25~32℃,而在27~30℃時代謝最為活躍,細胞培養最佳溫度與其基本一致。
細胞能夠在體外培養體系中保持活力,是進行體外生理機制研究的基礎。本研究分離了草魚的原代腦細胞,而且可以獲得較高的細胞產率,從而可以滿足后續魚類腦部生理規律及其調控機制研究實驗的需要。并且本實驗采用比色法檢測細胞活力,代謝活躍的細胞將新型四唑化合物MTS生物還原成一種有色甲臢產物。結果顯示,原代腦細胞的活力可以穩定地保持3 d,超過3 d后,細胞明顯退化。因此在當前培養條件下所制備的原代魚腦細胞可用于部分生理機制的離體分析。近年來,國內外學者對魚類腦細胞培養進行了大量研究[6-11]。利用魚類原代腦細胞進行離體測試已得到應用,主要包括魚類病毒感染與細胞毒性實驗[2,6,10-11],以及持久性有機污染物的毒理學相關研究[12];但是持久細胞系隨著代數的增加,其細胞的基因型和表型都有可能發生改變,導致某些重要的生理功能和分化特征喪失,實驗穩定性較差;而魚類細胞的原代培養是從活體動物獲取組織細胞后在體外進行的首次培養,細胞剛剛離體,生物性狀尚未發生很大變化,大多數細胞表現出原有組織的特性,在一定程度上更能反映體內狀態,測試的結果比較準確,重復性好[13-14]。
目前,魚類細胞培養已被應用于魚類生理、毒理等分子機制研究,但是其應用廣度遠遠不及其在哺乳動物上的應用。本研究進行了草魚腦細胞原代培養的初步探索,后續需要開展進一步的工作:完善細胞培養條件以建立持久細胞系;采用特定因子進行細胞鑒定;利用培養細胞進行神經生理機制研究;開展離體實驗與在體實驗結果對比,探討兩者區別與聯系,建立有效的評價指標,使離體實驗結果與在體實驗結果對應,建立體外實驗的細胞模型。

