曲靖市中醫醫院制劑質量標準存在問題整理與分析
云南省曲靖市中醫醫院,云南 曲靖 655000
醫療機構制劑是指醫療機構根據本單位臨床需要經批準而配制、自用的固定處方制劑[1]。隨著醫院制劑的發展,我國醫療機構制劑注冊管理辦法存在的不足[2]、區域間經濟和科技發展的不平衡等種種原因,不同省份、不同時期,醫療機構制劑申報人和審批機構對制劑注冊、再注冊標準的理解逐漸產生差異,不但不同省份間存在差異,而且同一省份不同時期也出現差異,導致醫療機構制劑質量標準不統一,水平差參不齊。北京、天津等省市藥品監管部門已先后著手開展醫療機構制劑標準提高工作,以規范醫院制劑的管理[3]。
2017年5月云南省食品藥品監督管理局對云南省內注冊的醫療機構制劑在再注冊工作基礎上開展制劑標準整頓工作[4],申報資料涉及9個項目,并同時出臺《云南省醫療機構制劑質量標準整頓技術要求》,對申報資料項目涉及制劑質量標準和說明書的制劑名稱、處方等11項內容的整頓技術做了具體要求。
1 我院制劑情況
1.1 歷年注冊的品種統計 見表1。
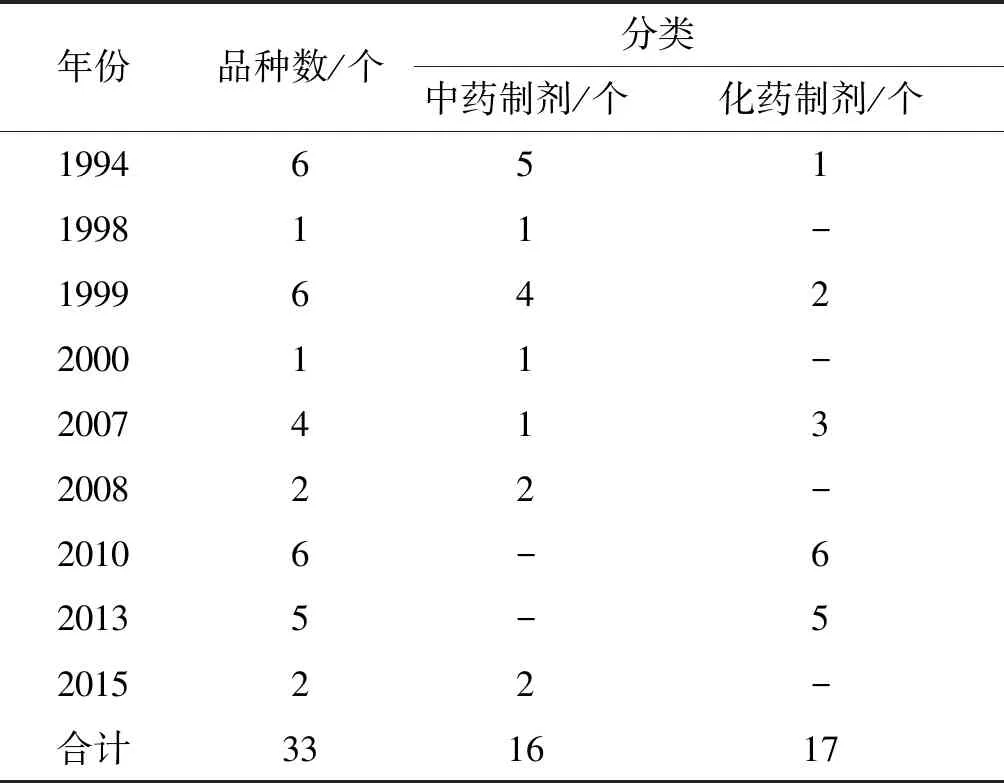
表1 歷年制劑注冊情況統計表
上表統計有原始檔案可追溯的制劑品種共計33個。2005年《辦法》實施后,云南省藥監部門曾對2005年前注冊的品種參照《辦法》要求,對質量標準進行過整頓規范。從上表可以看出,截止2015年底,我院注冊制劑品種共計33個,中藥制劑16個,占比48%;化藥制劑17個,占比52%。從注冊年份看,中藥制劑品種1994~2004年《辦法》實施前,注冊了11個,占中藥制劑品種數69%;2005~2015年,《辦法》實施后,注冊了5個,占中藥制劑品種數的31%。雖然從上表可以看到多年來不斷有制劑注冊成功,但截止2017年12月,實際持有有效再注冊批件的制劑品種共有26個,占總注冊數量的79%。其它品種隨時間流逝被逐漸淘汰,制劑批文也未再保留。《辦法》實施后有效地杜絕了低水平制劑的同時,也使云南省醫療機構制劑近些年發展呈萎縮態勢[5]。
1.2 處方、質量標準來源情況 醫療機構制劑根據處方、質量標準來源的不同,可分為非自擬標準與自擬標準2類。以我省制劑品種為例,非自擬標準類制劑標準參照《中國醫院制劑規范》(西藥制劑 第二版)(中華人民共和國衛生部藥政局編,1995年出版)、《醫院制劑檢驗手冊》(云南省衛生廳編,1986年出版)執行。自擬標準制劑的處方、質量標準均由申報人自主研究制訂,且不得與市場已有品種雷同,我院共有17個自擬標準品種。
1.3 自擬標準制劑情況統計
1.3.1 制劑檔案情況 此次標準整頓,是在制劑品種的原始注冊文件和現行質量標準、說明書的基礎上進行規范,但查此17個品種的檔案材料,有1個品種原始檔案遺失。經藥監部門核定的說明書樣稿的品種僅有2個在2015年注冊的品種可查,其余皆無;制劑質量標準與批件內容不符可提供補充變更證明資料的品種僅有1個。究其原因,一是醫療機構對制劑檔案管理不夠規范;二是藥監相關部門對制劑注冊、變更的流程不規范,醫療機構申請變更時未出具相關證明文件供醫院存檔。
1.3.2 處方來源統計按照《云南省食品藥品監督管理局醫療機構制再注冊及標準整頓工作方案》要求,我院共17個自擬標準品種需進行標準整頓。根據處方來源不同,源于經典古方、質量標準自擬的品種有3個,占比18%;處方來源于本院醫師、質量標準自擬的品種有14個,占比82%。
1.3.3 對比技術要求情況統計 《云南省醫療機構制劑質量標準整頓技術要求》對自擬標準制劑質量標準和說明書中制劑名稱等共11項內容作了具體技術要求。對比技術要求,對17個自擬標準品種不規范情況做了統計。詳見表2。

表2 制劑質量標準各項目情況統計
從上表可以看出,自擬標準的制劑質量標準從技術角度而言情況不容樂觀。從單一品種情況來看,17個品種沒有一個品種質量標準完全符合此次整頓的技術要求。
2 不規范情況總結
2.1 制劑名稱 整頓要求:制劑名稱凡不符合《中國藥品通用名稱命名原則》、國家最新頒布的管理辦法或與已上市藥品重名的,其制劑名稱應予以修訂;原有劑型與現行版《中國藥典》不符的,根據制劑品種的制法(工藝)、用法等內容,參照《中國藥典》附錄中的制劑通則進行修訂;其他品種名稱原則不得修訂。
《辦法》規定:醫療機構制劑的名稱,應當按照國家食品藥品監督管理局頒布的藥品命名原則命名,不得使用商品名稱。《中國藥品通用名稱命名原則》由國家衛生部2006年發布并施行。《中成藥通用名稱命名技術指導原則》由國家食品藥品監督管理總局2017年11月發布。綜上所述,化學制劑參照《中國藥品通用名稱命名原則》、中藥制劑參照《中成藥通用名稱命名技術指導原則》。如劑型表述不規范的,如“××霜”應規范“××乳膏”;名稱中有病理學字樣的,如“××感冒膠囊”。
2.2 處方 整頓要求:處方應為真實全方,方中所用原料、輔料、藥味、制藥用水等均應按現行版《中國藥典》規范名稱書寫;如無特殊說明,中藥制劑配制中應用飲片投料。
中藥原料未按《中國藥典》飲片規范名稱書寫問題突出,如橘核誤寫成桔核;牡丹皮寫成丹皮;浙貝母寫成浙貝;地方習用品滇柴胡寫成柴胡;蜈蚣以藥材條計數,而不是以飲片重量計數;炒白術未明確是麩炒還是土炒等。處方投料量描述不規范,應以實際投料量折算為制成1000個制劑單位(片、粒、g、ml等),如“××散”以成品1000袋來描述投料量,應以成品1000 g來描述投料量。處方各藥味順序排列未按君、臣、佐、使順序排列。處方中使用的中藥飲片無國家標準,僅有地方標準的,未按要求制定內控標準,如“××片”中使用的絞股藍飲片。
2.3 制法 整頓要求:中藥制劑制法格式參照現行版《中國藥典》中相應劑型的制法項書寫;化學制劑參照《中國醫院制劑規范》和《云南省醫療機構制劑檢驗手冊》中相應劑型的制法項書寫;制法原則上與批準時保持一致,但要求有與制法相對應的配制工藝規程,并在配制工藝中明確關鍵工藝參數。
17個品種中除2015年注冊的2個中藥制劑品種制法中工藝關鍵工藝參數明確外,其余均存在不同程度的參數不明確。如干燥未注明溫度、時間參數;粉碎、混合無篩網孔徑參數;煮提只有次數、時間,無加水量等;顆粒劑未注明所用輔料品種及數量、添加工藝點等;煎膏劑中所用煉糖工藝不明確等。
2.4 性狀 整頓要求:根據制劑的實際情況描述其性狀。
多存在描述不規范情況。如某乳膏劑原質量標準中表述為“本品應為乳劑型白色軟膏”應規范為“本品應為白色乳膏”。部分制劑性狀有顏色描述,缺少氣、味等描述。
2.5 鑒別 整頓要求:以原料藥粉末入藥的藥味一般應研究建立顯微牲鑒別,君、臣藥及貴重藥一般應建立薄層色譜鑒別;化學制劑未設置含量測定方法的,應根據原料藥藥品標準建立鑒別方法。
綜合此17個制劑品種情況,均建有薄層鑒別,但有描述與現行《中國藥典》不符的地方,如三氯甲烷描述為氯仿、乙酸乙酯描述為醋酸乙酯等;部分品種有粉末入藥的未建立粉末顯微鑒別;部分薄層鑒別使用的試劑毒性較大,如苯可用甲苯替代等。
2.6 檢查 整頓要求:各品種應根據劑型,按《中國藥典》附錄制劑通則規定的項目進行檢查。此次整頓還要求對中藥制劑中含有的重金屬、砷鹽狀況進行考察。
所有品種均未對中藥制劑中含有的重金屬、砷鹽狀況進行考察。對照不同劑型項下檢查要求,所有制劑品種均存在不同程度的檢查缺項。如含毒性藥材的制劑品種未設置限量檢查;有以單一成分投料的制劑品種無法測定含量時未添加浸出物測定項;有一酊劑品種未檢查甲醇量的;有外用軟膏劑內含中藥原料藥粉未檢查粒度的。
2.7 含量測定 整頓要求:建議中藥制劑制定含量測定方法;化學制劑建立含量測定方法,制定合理的含量限度。
除2個品種有含量測定外,其余15個品種均無。且此2個品種的測定方法為2005年制定,方法煩瑣、操作環節多,檢驗結果易出現偏差,方法有改進余地。
2.8 功能主治或適應癥 整頓要求:中藥制劑的功能主治按功能、主治加西診斷順序書寫。化學制劑的適應癥先寫臨床作用,后寫具體用途。此項內容僅限于對原標準欠規范的內容進行修訂,不得新增加適應癥。
如“××通淋顆粒”功能中有“消炎”等西醫術語的描述;如一用于消渴病的制劑主治中有“主治糖尿病”等不規范描述;如“××××膏”主治中描述了中醫癥狀卻未描述證侯。
2.9 用法用量 整頓要求:用法用量的書寫要求先寫用法,后寫用量。對于患者調整用量的,可在用量后加“或遵醫囑”表示。此項修訂僅限對原批準欠規范內容進行修訂,不得變更人群、用法、用量。不適宜或不建議老年人、孕婦、哺乳期婦女及兒童及其它特殊人群使用的制劑應在制劑說明書中明確標注。
我院有15個制劑品種注冊時藥監部門未核定說明書樣稿,僅有2個2015年注冊品種有核定說明書樣稿,故17個品種的說明書存在不同程度的不規范之處。如有含有毒性藥味或其他特殊成分的未標識警示語。有的外用藥未明確用量或用法描述含糊,如描述為“外涂患處”或“外用”等,未明確使用量。用法用量書寫時要求先寫用法,后寫用量,但有的口服制劑描述用量時描述順序錯誤,如應描述為“一日×次,一次×g”,錯誤描述為“每次×袋,每天×次”等。
2.10 規格 整頓要求:規格修訂僅限于對文字表述的修改,并對修訂原則做了說明。
《中國藥典》2015版四部凡例指出“制劑的規格,系指每一支、片或其他每一個單位制劑中含有主藥的重量(或效價)或含量(%)或裝量。” 查17個品種原有質量標準上均用包裝規格描述,均不符合此次整頓要求。如“×××片”規格描述為“×g/片”,要求規范描述為“每片相當于飲片×g”;如“××通淋顆粒”規格描述為“10 g/袋”,應規范描述為“每1 g相當于飲片×g”。
2.11 貯藏 整頓要求:現行質量標準沒有此項的應進行補充完善。現貯藏項的修訂僅可參照現行版《中國藥典》對貯藏條件的文字表述進行修訂。
17個制劑品種可查見均有貯藏項描述,但部分制劑描述與現行版《中國藥典》相同劑型通則項下要求有不一致地方。如“××膠囊”貯藏項下描述為“密閉,置陰涼干燥處”,現行藥典膠囊劑項下要求“除另有規定外,膠囊劑應密封貯存,其存放環境溫度不高于30 ℃,濕度應適宜,防止受潮、發霉、變質”,因此應修訂為“密封,置陰涼干燥處”。
3 小結
通過以上資料可以看出,雖然在2005年云南省藥監部門和相關醫療機構制劑生產單位曾對醫院制劑的質量標準進行過規范,使制劑的質量標準從技術方面有了較大提升,但隨著時間的推移,新的生產方法、生產設備和檢測手段不斷出現,原有的質量標準從技術層面上已經滯后于科技的發展,原來未發現或未凸顯的問題逐漸顯現,質量標準和說明書與現行藥典或相關法規相比不規范的地方,也給臨床使用帶來一定安全隱患。規范質量標準與說明書對醫療機構制劑生產單位而言勢在必行,是對患者用藥安全的負責,對自己生產行為的負責。以發展的眼光對醫療機構制劑的注冊、生產、使用、質量標準各個環節進行規范、提高,才能使醫療機構制劑產業健康發展。

