細胞傳代對SD大鼠骨髓間充質(zhì)干細胞衰老的影響
黃玉圣 呂辰菲 莊景燊 徐平 涂晨 吳迪崢 鐘招明
(南方醫(yī)科大學南方醫(yī)院 1脊柱骨科,廣東 廣州 510515;2神經(jīng)內(nèi)科)
間充質(zhì)干細胞(MSCs)是一類多能干細胞,主要存在于結(jié)締組織和組織器官中,如骨、軟骨、脂肪、內(nèi)皮、肌肉和神經(jīng)組織等,以骨髓組織中含量最為豐富,占骨髓細胞總數(shù)的0.001%~0.100%〔1〕。骨髓MSCs(BMSCs)具有自我復制能力和向成骨、成脂、成軟骨等多向分化能力,可參與骨形成與骨吸收的動態(tài)平衡過程,維持組織和器官的內(nèi)環(huán)境穩(wěn)態(tài)及修復組織損傷等方面。衰老是生物界的普遍現(xiàn)象,BMSCs也可發(fā)生衰老變化。衰老的BMSCs不但形態(tài)上會發(fā)生變化,其增殖和多向分化能力也會發(fā)生不同程度的改變〔2〕。BMSCs的體外培養(yǎng)是其功能研究的重要途徑。有研究表明體外培養(yǎng)的細胞會隨著傳代次數(shù)的增加而衰老,甚至喪失其特有的功能〔3,4〕。本實驗擬通過體外分離培養(yǎng)大鼠BMSCs,探討傳代次數(shù)對BMSCs衰老的影響。
1 材料與方法
1.1實驗動物 3~4周齡的SD雄性大鼠,由南方醫(yī)科大學動物實驗中心提供。動物許可證號:SCXK(粵)2016-0041,實驗過程中對動物的處置符合中華人民共和國科學技術(shù)部2006年頒布的《關(guān)于善待實驗動物的指導性意見》標準。
1.2主要試劑與器械 胎牛血清(FBS,Sigma),CO2培養(yǎng)箱(Thermo Fisher 公司),青-鏈霉素(PanEra Life Science),0.25%胰蛋白酶-乙二胺四乙酸(EDTA,PanEra LifeScience),MEM/F12(Hyclone公司),磷酸鹽緩沖液(PBS),水平離心機(上海德洋意邦儀器有限公司),超凈工作臺(廣州瑞智科學儀器有限公司),SpectraMax M5多功能酶標儀(MDS公司),倒置顯微鏡(德國Leica儀器股份有限公司,DM IL LED),電泳槽、轉(zhuǎn)膜儀(Bio-RAD),化學發(fā)光儀(Tanon),細胞衰老β-半乳糖苷酶染色試劑盒(Beyotime),CCK-8試劑盒(Beyotime),兔抗大鼠單克隆抗體P53、P21(Abcam),大鼠Ig G二抗(Proteintech)。
1.3實驗方法
1.3.1SD大鼠BMSCs的原代分離與培養(yǎng) 3~4周齡SD雄性大鼠脫頸處死,體積分數(shù)為75%酒精浸泡 5 min,無菌條件下取出大鼠雙側(cè)股骨和脛骨,浸泡于裝有75%酒精的10 ml離心管中,帶入超凈臺中,用高溫消毒后的器械剔除肌肉和貼附骨面的纖維結(jié)締組織,剪開股骨和脛骨的骨骺端,暴露出骨髓腔,用5 ml無菌注射器抽取PBS(含青-鏈霉素100 U/ml),反復柔沖骨髓腔 3~5次,直至骨髓腔呈白色。70 mm篩網(wǎng)過濾后,收集過濾液以800 r/min離心3 min,棄上清,加入紅細胞裂解液,吹打混勻,冰上裂解3 min后,800 r/min 離心3 min,棄上清,按1×109/ml密度接種至100 mm的培養(yǎng)皿,置于37℃、體積分數(shù)為5%CO2飽和濕度培養(yǎng)箱中培養(yǎng)。
1.3.2BMSCs 的純化與擴增 原代培養(yǎng)48 h半量換液,72 h后全量換液,全量更換培養(yǎng)基(不沖洗),可將其中未貼壁細胞去除,以后每3 d全量更換新鮮培養(yǎng)基,PBS沖洗兩遍。待細胞鋪滿培養(yǎng)皿底,密度達80%融合時,用0.02%EDTA+ 0.25%胰酶消化,消化時間約2 min,加入全培終止消化,800 r/min 離心3 min,棄上清,用含10%胎牛血清的 MEM/F12培養(yǎng)基重懸細胞后,1∶2的比例進行傳代培養(yǎng)。重復上述步驟進行 P2~9代的傳代培養(yǎng)。
1.3.3BMSCs 的形態(tài)學觀察 取各代細胞,每日用倒置相差顯微鏡觀察其生長形態(tài)及特征并拍照記錄。
1.3.4BMSCs表面標志物的鑒定 取第3代骨髓間充質(zhì)干細胞,胰酶消化,收集細胞于5 ml離心管中,800 r/min離心3 min,除上清,PBS重懸,調(diào)整細胞密度為1×106個/L,取流式細胞儀專用試管4個,每管加入300 μl細胞懸液,加入熒光抗體CD29 FITC、CD45 PE-Cy5.5、CD90 PE及同型對照抗體各5 μl,孵育15 min,采用BDFACSEALIBUR流式細胞儀進行測定。
1.3.5BMSCs 細胞周期檢測 取生長良好的P3 BMSCs,先收集培養(yǎng)液備用,用4℃預冷的PBS洗滌細胞2次,洗下的細胞也需收集,胰酶消化,加入收集的細胞培養(yǎng)液終止消化,以800 r/min離心 3 min富集細胞,棄上清,PBS洗滌細胞一次(2 000 r/min,5 min),收集并調(diào)整細胞濃度為1.0×106/ml,取1 ml細胞懸液,以800 r/min離心3 min富集細胞,棄上清,在細胞中加入體積分數(shù)為70%冷乙醇500 μl重懸,吹勻細胞,4℃過夜。次日離心收集細胞,再以1 ml PBS洗滌1次,除去固定液,1 000 r/min離心3 min,加入100 μl RNase A,37℃水浴30 min,再加入400 μl碘化丙啶(PI),4℃避光孵育30 min,離心棄上清,200 μl PBS 重懸后,流式細胞儀上機檢測。
1.3.6BMSCs生長曲線的繪制 取P1、P3、P5、P7和P9代細胞,胰酶消化重懸后計數(shù),以1×104個/孔接種于96孔板,分為8組,每組6個復孔,于第1~7天同一時間作相同檢測,每孔加入10 μl CCK-8溶液,37℃,飽和濕度,5%CO2培養(yǎng)箱孵育2 h后,用酶聯(lián)免疫檢測儀于450 nm波長下檢測吸光度值。以時間為橫軸,吸光度值為縱軸繪制細胞生長曲線。
1.3.7細胞衰老β-半乳糖苷酶染色 細胞傳代,分別取P1、P3、P5、P7和P9代細胞,PBS洗3次,加入β-半乳糖苷酶染色固定液,室溫固定15 min,PBS洗3次,加上新配制的SA-β-gal 染色工作液,保鮮膜封口,37℃(無CO2)孵育過夜,PBS液清洗3次后,倒置顯微鏡下觀察并拍照。
1.3.8免疫印跡檢測 加入RIPA 細胞裂解液靜置5 min,超聲破碎儀裂解1 min,4℃ 12 000 r/min離心15 min,取上清,BCA法測定蛋白濃度,行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),轉(zhuǎn)移至聚偏氟乙烯(PVDF)膜電轉(zhuǎn),5%脫脂奶粉室溫封閉1 h,條帶加入兔抗大鼠P53和P21單克隆抗體(1∶1 000),選取37 kD GAPDH作為內(nèi)參,4℃ 20 r/min孵育過夜,TBST洗膜10 min x 3次,加入 HRP 標記的大鼠IgG二抗(1∶5 000),室溫孵育1 h,TBST洗膜10 min×3次,化學發(fā)光,采用Image J計算目標各帶灰度值。
1.4統(tǒng)計學分析 采用SPSS21.0軟件進行t及χ2檢驗。
2 結(jié) 果
2.1SD大鼠BMSCs鑒定 流式細胞儀檢測結(jié)果示,培養(yǎng)的P3 BMSCs均一表達CD29及CD90,陽性率分別為97.72%,98.23%;而CD45,呈陰性,陽性率為1.52%。
2.2BMSCs 細胞周期 流式細胞儀檢測P3 BMSCs細胞周期,細胞100%為二倍體,其中G0/G1期87.37%,G2/M期4.06%,S期8.57%,提示絕大部分細胞處于靜止休眠期,符合干細胞周期特征。
2.3不同代數(shù)細胞生長情況 分別對P1、P3、P5、P7和P9代細胞進行1~7 d連續(xù)培養(yǎng)測定發(fā)現(xiàn),傳代后1~2 d處于潛伏期,細胞增長不明顯,3~5 d進入指數(shù)増長期,6 d后細胞增殖速度便有所減緩,進入平臺期,增殖基本停滯,生長曲線見圖1。從結(jié)果可發(fā)現(xiàn)P3~P5代的細胞增殖狀況更良好。
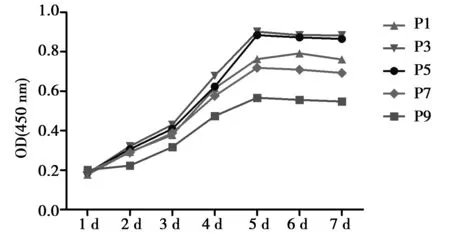
圖1 CCK-8檢測不同代數(shù)BMSCs 1~7 d的增殖能力
2.4不同代數(shù)細胞β-半乳糖苷酶染色陽性率 對不同代數(shù)的細胞行β-半乳糖苷酶染色,紅色箭頭標注的著深藍色的細胞即為衰老細胞(圖2)。隨之進行β-半乳糖苷酶染色陽性細胞計數(shù),其中P7(52.67%±7.93%)和P9(83.67%±3.27%)相較于P1(3.67%±1.25%)、P3(8.33%±3.11%)和P5(20.00%±5.35%),SA-β-gal陽性細胞比例明顯增高(圖2)。
2.5不同代數(shù)細胞P53和P21表達變化 隨著傳代次數(shù)的增加,衰老相關(guān)蛋白P53和P21的蛋白水平表達量也逐漸增高,Western印跡結(jié)果示:P53和P21在P9代的蛋白相對表達量分別為3.43±0.66和3.31±0.28,明顯高于P1代,見圖3,表1。

圖2 倒置相差顯微鏡下觀察β-半乳糖苷酶染色陽性細胞(×100)
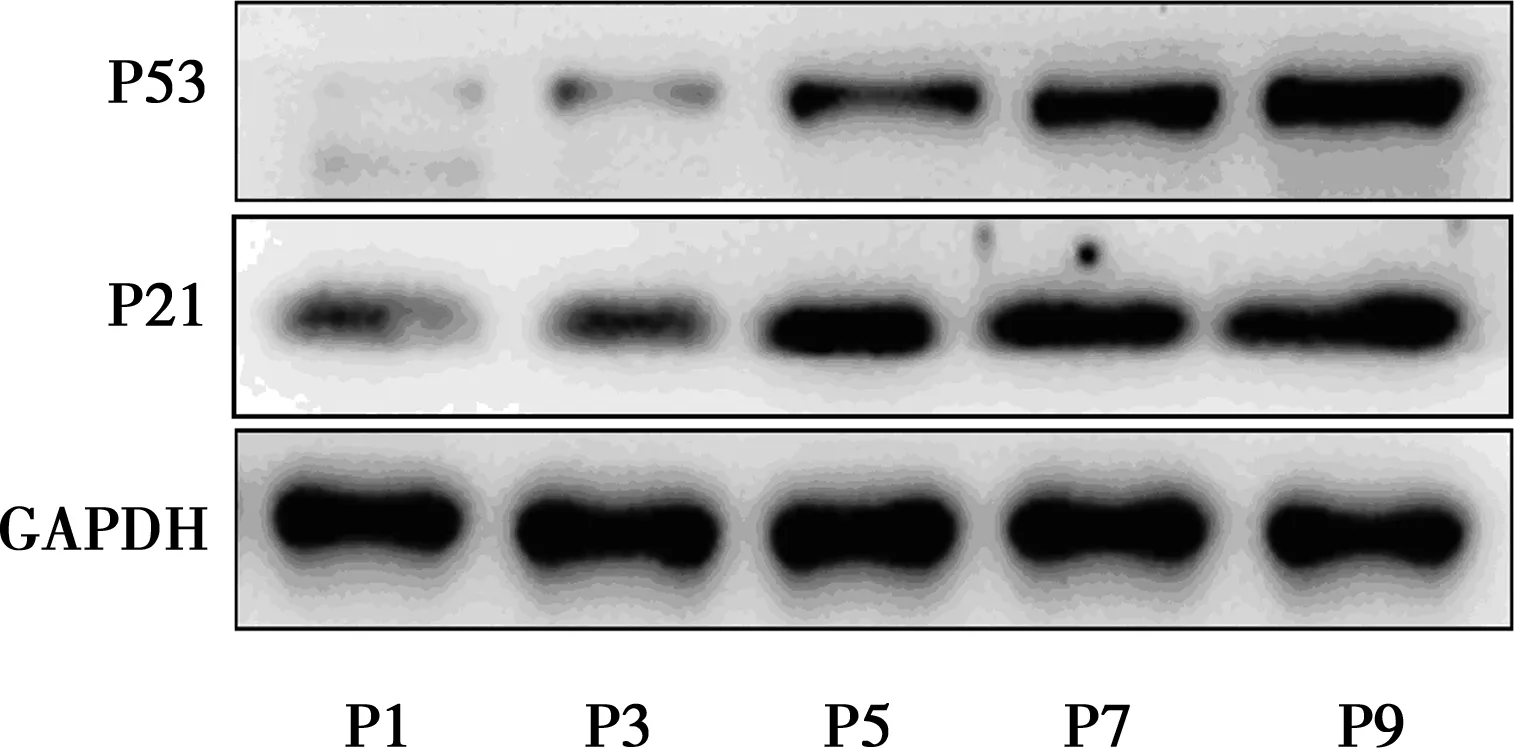
圖3 細胞傳代對衰老相關(guān)蛋白P53和P21表達的影響
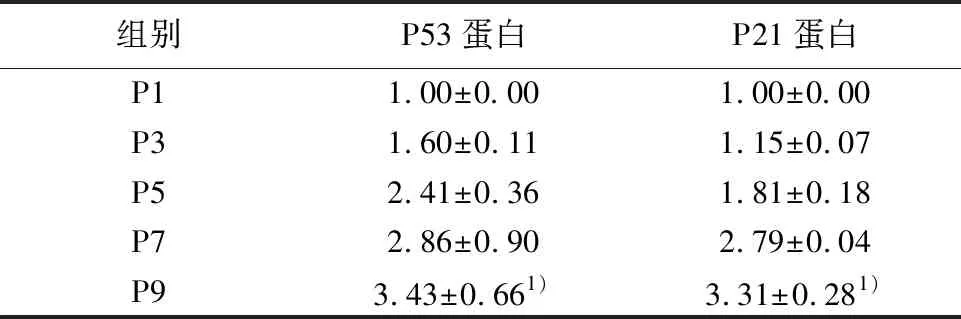
組別P53蛋白P21蛋白P11.00±0.001.00±0.00P31.60±0.111.15±0.07P52.41±0.361.81±0.18P72.86±0.902.79±0.04P93.43±0.661)3.31±0.281)
與P1代比較:1)P<0.05
3 討 論
BMSCs是骨髓基質(zhì)中的非造血系成體干細胞,具有多向分化潛能,現(xiàn)已成為醫(yī)學研究的熱點。雖然BMSCs 沒有公認的獨特的抗原表型,但其培養(yǎng)過程可表達細胞CD表型〔5,6〕。本實驗培養(yǎng)的BMSCs 均一表達CD29,CD90,陽性率分別為97.72%,98.23%,均大于95.00%;而CD45,呈陰性,陽性率為1.52%,小于5.00%,符合文獻報道MSCs表面抗原的表達〔7〕。前期研究表明干細胞大部分細胞處于靜止休眠期,此實驗的細胞周期檢測結(jié)果發(fā)現(xiàn)G0/G1期占88.37%,符合干細胞周期特征。
骨髓細胞成分復雜,造血干細胞是骨髓中含量最豐富的細胞,而MSCs 僅占骨髓細胞的 0.001%~0.01%〔8〕。由于BMSCs在骨髓中豐度低、分選難、分離細胞活性弱、純度低、生物學活性易改變等缺點,嚴重限制了BMSCs的應用。本實驗采用全骨髓貼壁法體外培養(yǎng)BMSCs,具有操作簡便、效果可靠、對細胞活性影響較小等優(yōu)點〔9,10〕。
細胞增殖能力下降是機體衰老的重要影響因素。既往研究發(fā)現(xiàn),年輕小鼠中獲取的MSCs的數(shù)量、細胞增殖能力明顯優(yōu)于老齡小鼠MSCs〔11,12〕。MSCs發(fā)生衰老時,影響其分化潛能,成脂能力增加而成骨分化能力下降〔13~15〕。本研究證實隨著體外細胞傳代次數(shù)增加,可導致MSCs增殖能力的改變,從而發(fā)生復制性衰老。
體外培養(yǎng)細胞在pH為6時,其β-半乳糖苷酶染色的陽性率隨代齡增加而增加,這種中性β-半乳糖苷酶被定義為衰老相關(guān)的β-半乳糖苷酶。衰老細胞產(chǎn)生的β-半乳糖苷酶可以催化底物X-Gal,生成深藍色產(chǎn)物,被作為衰老細胞的生物標記〔16,17〕。研究表明衰老BMSCs細胞核膜內(nèi)折,核染色質(zhì)濃縮,線粒體數(shù)量減少,內(nèi)質(zhì)網(wǎng)擴張,體積增大或腫脹,并且高度表達β-半乳糖苷酶〔18〕。本研究證實隨著體外細胞傳代次數(shù)增加,β-半乳糖苷酶染色陽性率細胞增加。
細胞衰老與基因調(diào)控密切相關(guān)。研究發(fā)現(xiàn)具有細胞增殖調(diào)控功能的衰老相關(guān)基因包括抑癌基因P53、P21和P16、細胞周期素D1、周期素依賴性激酶(CDK)2、增殖細胞核抗原(PCNA)、轉(zhuǎn)錄因子(E2F)等,這些基因在調(diào)控細胞衰老的過程中發(fā)揮著重要作用〔19〕。本實驗結(jié)果示,隨著傳代次數(shù)的增加,BMSCs表達衰老相關(guān)蛋白P53和P21增加,蛋白表達量明顯高于低傳代次數(shù)BMSCs。綜上所述,體外培養(yǎng)傳代次數(shù)的增加,BMSCs增殖能力明顯下降,衰老細胞數(shù)量增加。為了避免復制性衰老對BMSCs功能研究的影響,建議使用P1-5代細胞。此外,深入研究BMSCs衰老的調(diào)控機制和作用靶點,可為延緩干細胞衰老及防治各種老齡化疾病提供重要的理論基礎(chǔ)。

