miR-182靶向調控FOXO3a表達對膠質瘤細胞增殖和侵襲能力的影響
余振興,鄧 磊,張先斌, 胡祖力,祝新根, 吳淼經
神經膠質瘤亦被稱為膠質細胞瘤,是顱內最常見的惡性腫瘤之一,約占顱腦腫瘤的50%。按照腫瘤的起源可分為:星形細胞瘤、膠質母細胞瘤、髓母細胞瘤、室管膜瘤及少突膠質細胞瘤[1]。由于膠質瘤細胞所處特殊位置,藥物治療療效差、手術難度大、易轉移、復發[2]。小分子RNA-182(microRNA,miR-182)為編碼區序列,通過調控下游基因的轉錄而影響相關蛋白的表達,影響細胞的增殖、凋亡和分化[3]。研究[4]顯示,miR-182在癌細胞組織中高表達。“叉頭蛋白”的O亞家族(forkhead, FOXO3a)是由FOXO3基因編碼的一類蛋白質,FOXO3a蛋白在肝癌、肺癌、胃癌、前列腺癌、結腸癌、卵巢癌、淋巴瘤、白血病等多種惡性腫瘤細胞中均有表達[5]。該研究通過對膠質瘤U251細胞系中miR-182與FOXO3a的相互作用關系,探討miR-182通過對FOXO3a蛋白的調控對膠質瘤細胞的增殖與侵襲能力的影響。
1 材料與方法
1.1 主要試劑與儀器膠質瘤細胞U251購自上海中科院細胞所;DMEM高糖培養基、胰酶及脂質體Lipofectamine2000均購自美國Invitrogen公司;胎牛血清及雙抗(100 U/ml青霉素與100 g/L鏈霉素組成)購自美國Gibco公司;FOXO3a一抗(兔抗)購自美國Cell Signaling公司;FOXO3a二抗(羊抗兔)購自北京康為世紀公司;β-action內參購自德國Tiangen公司;BCA蛋白濃度試劑盒、PCR擴增儀購自購自美國Thermo公司;miR-182與抑制劑及逆轉錄試劑盒購自美國ABI公司;熒光素酶基因檢測試劑盒購自美國Promega公司;低溫離心機購自德國Eppendoff公司;倒置顯微鏡購自日本Olympus公司。
1.2 細胞培養與轉染向U251細胞與正常人星型細胞分別加入含10%胎牛血清與1%雙抗的DMEM高糖培養基溶液,制成懸液,放入培養箱(37 ℃、5% CO2)中培養。待細胞生長至對數期,加入胰酶進行消化,獲得U251細胞懸液,按照分組分別加入對照組、無義序列miR-182、miR-182 micmics已整合成功的脂質體,完成細胞轉染,繼續培養約48 h直至轉染成功后的細胞進入對數期。
1.3 構建FOXO3a質粒使用pc DNA3作為空載體質粒,報告強化綠色熒光蛋白(enhanced green fluorescent protein, EGFP)質粒載體,分別將野生型(亦稱無干擾型)FOXO3a 3′-非翻譯區(untranslated region, UTR)與突變型(亦稱過表達型)FOXO3a 3′-UTR序列復制后導入pc DNA3載體,得到無干擾型與過表達型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒。
1.4 進行熒光素酶報告實驗將長滿瓶底約80%的U251細胞消化后接種于96孔板,正常培養過夜,顯微鏡下觀察,細胞密度超過75%時分別加入:A組突變型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒;B組共轉染突變型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和無義序列;C組共轉染突變型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和miR-182 mimics;D組野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒;E組共轉染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和無義序列;F組共轉染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和miR-182 mimics。待質粒與脂質體轉染成功后,按照熒光素酶試劑盒操作,測定對應熒光素酶活性。
1.5 Western blot檢測FOXO3a蛋白表達收集轉染成功后不同處理的U251細胞,得細胞懸液,PBS清洗3次,取下層細胞,加入蛋白裂解液(PMSF與 RIPA按照1 ∶100)提取蛋白;4 ℃、12 000 r/min離心15 min,收集蛋白沉淀;BCA試劑盒測定標準蛋白曲線;按照實驗流程配制好分離膠與濃縮膠,依次加入樣品,設定電壓80 V/120 V;待溴酚藍出現在膠底附近時,電泳結束;按照膠塊、PVDF膜處于正中間,兩邊依次為三層濾紙、海綿的順序放置好,進行轉膜,持續時間為90 min;使用TBST溶液洗脫3次,邊洗邊振搖,每次10 min;5%脫脂牛奶封閉結束后,孵育對應1抗過夜,繼續TBST洗膜3次,每次10 min,加入對應辣根過氧化物標記的二抗,孵育1 h;選用ECL顯影液顯影結束后,應用Image J軟件進行灰度分析。
1.6 qRT-PCR測定FOXO3a mRNA表達采用TRIzol裂解液快速提取不同處理細胞中mRNA,加入TRIzol溶液與氯仿(5 ∶1)混合液,4 ℃、12 000 r/min離心15 min,得到3個相層;輕輕吸取上層無色含RNA水層,加入等體積異丙醇混勻,離心,保留下層沉淀;加入TRIzol溶液與75%乙醇混合液(1 ∶1),對RNA繼續清洗以去除雜質,離心,得到純度更高的RNA提取物;將EP管倒扣于吸水紙上進行干燥,加入無RNase的水,混合均勻后備用。依次加入2 μl 10×RT工作液、4 μl 25 mmol/L MgCl2、2 μl 0.1 mol/L DTT、1 μl RNaseOUT(40 U/μl)、1 μl SuperScript RT(200 U/μl)合成引物序列,按照預變性95 ℃、10 min;變性95 ℃、15 s;退火56 ℃、60 s;延伸72 ℃、32 s程序設置PCR擴增。選用GAPDH作為內參。引物序列見表1。
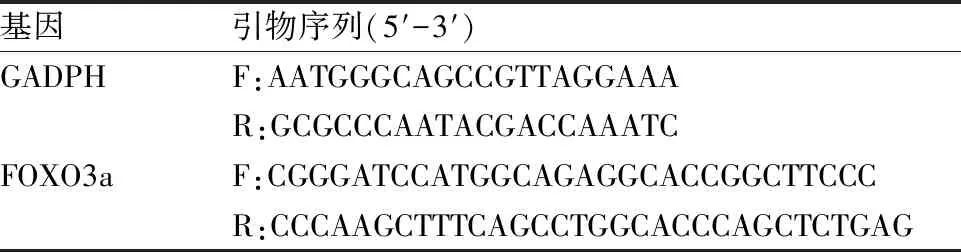
表1 基因GADPH、FOXO3a引物序列
1.7 MTT法測定細胞增殖將正常U251細胞與轉染siRNA-miR-182、miR-182 mimics及過表達FOXO3a成功的細胞進行培養,48 h后收集細胞,制備細胞懸液,按照3 000~8 000個/孔進行96孔板點板,每種設6個復孔;培養箱繼續培養1~5 d后,每孔加入20 μl MTT溶液,繼續培養4 h,加入100 ml DMSO,搖床低速振蕩10 min,酶標儀490 nm處測定吸光度值。
1.8 Transwell法測定細胞侵襲能力將轉染不同處理的細胞分別接種于Transwell上室(有/無Metrigel膠),下室為含10%胎牛血清的完全培養液,培養36 h后,蘇木精染色封片,測定穿過孔的細胞數目。
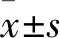
2 結果
2.1 MTT法測定轉染miR-182對U251增殖能力的影響培養第1天,各組轉染后的U251細胞增殖數量差異無統計學意義(P>0.05);培養第2~3天,與對照組及無義序列組比較,轉染miR-182 mimics組細胞數顯著增加(P<0.01);第3~5天,miR-182 mimics組細胞數雖有減小,但與對照組及無義序列組比較,其細胞數量仍呈顯著性增加(P<0.05)。第1~5天,無義序列組U251細胞,細胞數量開始呈增加趨勢后逐漸減少;與對照組細胞數比較,無義序列組細胞數無顯著變化(P>0.05)。見圖1。
2.2 Transwell法測定轉染miR-182對U251侵襲能力的影響3組間穿過小室的細胞數差異有統計學意義(P<0.05);與對照組比較,miR-182 mimics組穿過小室細胞數顯著增多(t=5.577,P=0.005)。見表2、圖2。
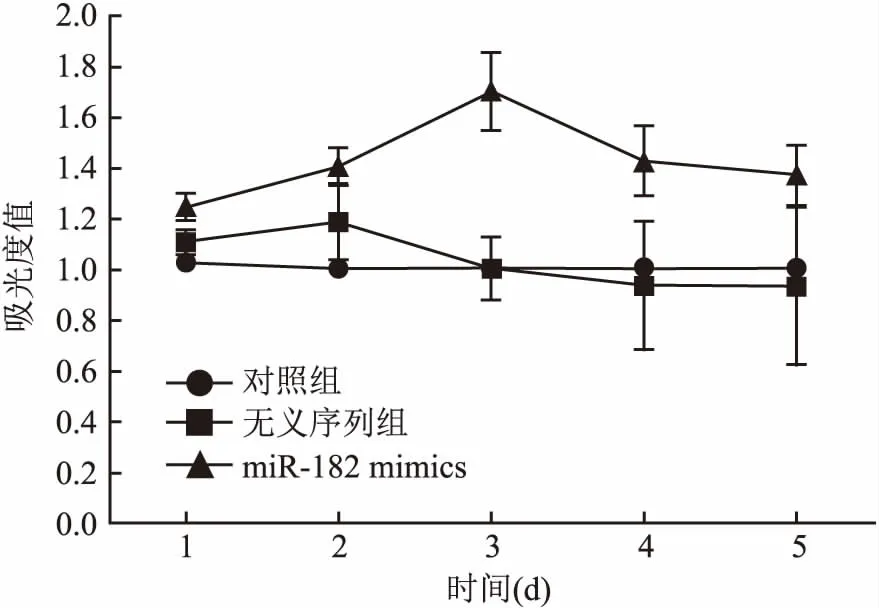
圖1 MTT法測定轉染miR-182 U251細胞的增殖能力

組別細胞數對照36.9±3.4無義序列34.6±2.7miR-182 mimics54.3±4.2F值6.551P值<0.05
圖2 Transwell法測定轉染miR-182對U251侵襲能力的影響×100
2.3 熒光素酶活性驗證結果經Microma/miRBase/TargetScan靶基因數據庫篩選,將FOXO3a暫定為miR-182調控的下游靶基因。經熒光素酶報告實驗驗證,A ~E組熒光素酶對應活性,見圖3;兩兩比較,差異有統計學意義(P<0.05),miR-182 mimics與pc DNA3/ EGFP-FOXO3a 3′-UTR共轉染組(C組)熒光素酶活性明顯較其他組低(P<0.01),證實miR-182可抑制突變型質粒的熒光素酶活性,FOXO3a是miR-182調控的直接作用靶點。
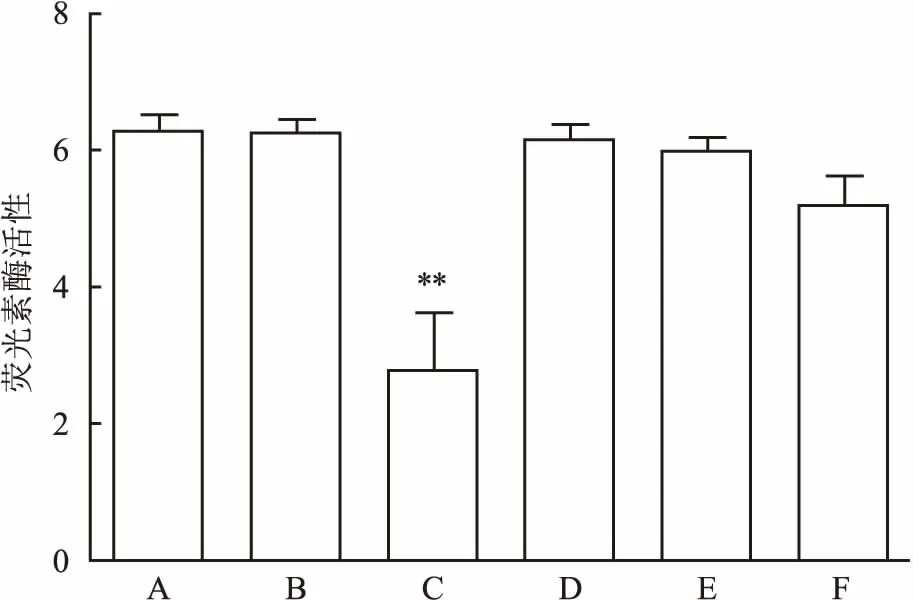
圖3 熒光素酶活性驗證結果
A組:突變型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒; B組:共轉染突變型pc DNA3/ EGFP -FOXO3a 3′-UTR質粒和無義序列; C組:共轉染突變型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和miR-182 mimics; D組:野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒; E組:共轉染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和無義序列; F組:共轉染野生型pc DNA3/ EGFP-FOXO3a 3′-UTR質粒和miR-182 mimics;與A組比較:**P<0.01
2.4 轉染miR-182后U251細胞內FOXO3a的蛋白表達情況Western blot 檢測FOXO3a蛋白的表達,3組之間差異有統計學意義(F=13.128,P<0.05);與對照組比較,miR-182 mimics組FOXO3a蛋白含量顯著降低(P<0.05)。在qRT-PCR實驗中,3組之間差異有統計學意義(F=17.227,P<0.05);與對照組比較,miR-182 mimics組FOXO3a mRNA含量顯著降低(P<0.05)。見圖4。
2.5 突變型FOXO3a干擾U251細胞增殖與遷移變化與野生型FOXO3a干擾U251細胞組比較,MTT實驗測定第1~3天,突變型組細胞數顯著增加(P<0.05);第4~5天,突變型組細胞數有減小趨勢,與野生型組比較,其細胞數仍顯著偏多(P<0.05)。在Transwell小室實驗中,培養36 h后,與野生型組穿過細胞數(37.8±2.8個)比較,突變型組穿過小室的細胞數(25.2±2.64個)顯著減少(P<0.05)。見圖5。
3 討論
膠質瘤是中樞神經系統細胞異常增殖與轉移引起的惡性腫瘤之一,約占中樞神經系統腫瘤的3/5[6]。膠質瘤細胞極易向周圍浸潤,導致膠質瘤手術切除難度大,術后易出現復發;盡管隨著現代科學技術的進步,膠質瘤患者的5年生存率仍然低至5%[7]。生命體的正常生長發育得益于基因精準的、多方位的整體調控。無論是基因本身的堿基序列發生微小改變,還是非編碼區的調控序列發生異常,都會使機體的生理活動發生異常,這種異常超出機體的自我調節承受范圍,即出現病理狀態。miRNAs是一類自身無法直接表達蛋白質、可對下游基因蛋白質表達進行調控的小分子密碼子[8]。有研究[9]者提出,下游靶mRNA的3′UTR為調控miRNA的主要結合位點。如miRNA-663可通過調控下游靶基因轉移生長因子-β抑制膠質瘤細胞的增殖、轉移與侵襲;miRNA-506可調控下游靶基因胰島素樣生長因子2 mRNA的結合蛋白1抑制膠質瘤細胞的增殖[10-11]。miR-182為miR-183-96-182家族一員,位于人類第7號染色體,被證實為具有癌基因功能。在多種膠質瘤細胞信號通路中均顯示miR-182扮演著重要角色,Feng et al[12]證實miR-182過表達可調控神經突起生長素(neuritin,NRN1)基因與NRN1蛋白表達從而控制膠質瘤細胞的增殖與轉移;Xue et al[13]等證實miR-182-5p的促進與抑制均可激活信號轉導轉錄激活因子3信號通路,從而調控膠質母細胞瘤的增殖與遷移。本研究中,對對照組、無義序列組、miR-182 mimics組的U251細胞進行培養后顯示,與其他兩組比較,轉染miR-182 mimics組的U251細胞增殖速度明顯加快,提示miR-182可促進膠質瘤U251細胞的生長;在進行Transwell小室實驗顯示,轉染miR-182 mimics組的U251細胞穿過小室的細胞數明顯較其他兩組多,提示miR-182可促進膠質瘤U251細胞的轉移;經熒光素酶活性實驗驗證,miR-182 mimics與pc DNA3/ EGFP-FOXO3a 3′-UTR共轉染組(C組)熒光素酶活性明顯較其他組低,證實FOXO3a是miR-182調控的直接作用靶點。

圖4 轉染miR-182后U251細胞內FOXO3a的
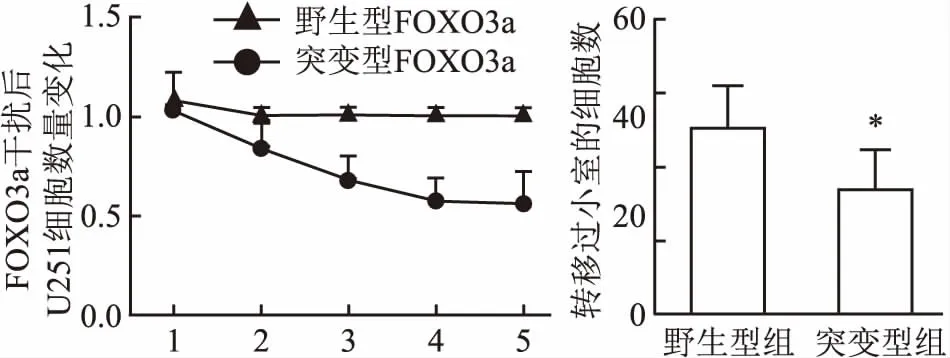
圖5 突變型FOXO3a干擾U251細胞增殖與遷移變化與野生型組比較:*P<0.05
FOXO3a是分子量為75 ku的蛋白質,含有高度保守的翼螺旋結構域,可被磷酸化或乙酰化激活。FOXO3a蛋白已被證實在受到蛋白激酶B與核因子κB激酶β的抑制劑等修飾激活后,其活性發生改變,可參與腫瘤細胞的生長與增殖。p53是一種重要的抑癌基因,當受到外界刺激時,FOXO3a與p53可相互促進以抑制腫瘤細胞的生長,且被證實二者為協同作用[14]。為近一步探討miR-182對FOXO3a調控趨勢,本研究選用脂質體進行轉染,使FOXO3a進入突變狀態,在體內過表達,結果顯示:與對照組比較,進入FOXO3a蛋白突變狀態的U251細胞增殖速度與侵襲速度均顯著減小,突變狀態U251細胞中miR-182的mRNA含量顯著減小。

