全反式維甲酸對角膜上皮損傷修復過程中細胞凋亡的影響
王多梅,宋 夢,汪 楓,2,周 青,汪 淵
角膜是眼球最外層的纖維膜,同時也是重要的屈光間質。其中角膜上皮是抵御病原微生物侵襲角膜的第一道屏障,角膜最外層的上皮細胞間形成的高密度緊密連接構成了屏障,將外界與眼內隔離,抵御外界致病因子的侵襲[1]。上皮遭受損傷后,極易發生感染性炎癥。
全反式維甲酸(all-transretinoic acid,ATRA)是天然維生素A的代謝產物。研究[2]表明,ATRA可改善血管內皮依耐性舒張功能。維甲酸類化合物對多種細胞癌變和腫瘤的生長均有抑制作用,同時可以增強上皮細胞的生長和分化[3],并且近幾年已被用于眼科相關疾病[4-5]。該研究通過ATRA處理損傷后大鼠角膜上皮,旨在探討ATRA對角膜上皮損傷修復過程中角膜上皮修復速度的影響及該過程中絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信號通路相關分子的變化及凋亡相關蛋白表達的變化,初步探討其發生的可能機制,為進一步研究打下良好的基礎。
1 材料與方法
1.1 實驗動物普通雄性清潔級SD大鼠20只,體質量250~300 g,購自安徽醫科大學實驗動物中心。實驗動物均給予12 h光照、12 h黑暗條件,環境通風,飲水自由。
1.2 主要試劑二甲基亞砜(DMSO)購自美國 Sigma公司;TUNEL(C1090)細胞凋亡試劑盒購自上海碧云天生物技術公司;一抗β肌動蛋白(β-actin)、半胱天冬氨酸蛋白酶-9(cysteine aspartic acid specific protease-9,Caspases-9)、磷酸化p38蛋白(p-p38)、p38購自美國Santa Cruz公司 ;B細胞淋巴瘤/白血病-2相關X蛋白(B cell lymphoma/lewkmia-2 assaciated X protein,Bax)、B細胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、辣根過氧化物酶標記羊抗鼠、羊抗兔、兔抗羊IgG購自美國Millipore 公司;Caspases-3購自美國Abcam 公司; ECL顯色試劑盒購自杭州弗德生物科技有限公司;羧甲基纖維素鈉(sodium carmellose ,SC)購自美國 Sigma公司;ATRA購自上海東蒼生物科技有限公司(≥98% 302-79-4)。
1.3 儀器冰凍切片機、正置顯微鏡、解剖顯微鏡購自德國 Leica公司;電泳儀購自美國Pca 300公司;全自動數碼凝膠化學發生儀購自上海歐翔科學儀器有限公司;裂隙燈顯微鏡(YZ5T)購自蘇州六六視覺科技股份有限公司;脫色搖床(TS-1)購自海門其林貝爾儀器制造有限公司;往復式脫色搖床(ZD-9550)購自太倉華利達實驗設備有限公司;高速冷凍離心機購自美國Thermo fisher公司。
1.4 大鼠角膜損傷修復模型的建立及角膜組織收取所有大鼠稱重后10%水合氯醛(0.3 ml/100 g)麻醉, 角膜環鋸器在大鼠角膜上皮做直徑4 mm環形標記,解剖顯微鏡下用無菌的手術刀片刮除并收集環形標記內角膜上皮。術后損傷眼均涂抹紅霉素眼膏以防感染。損傷修復期間每只老鼠一只眼滴加0.5 mmol/L ATRA滴眼液(溶于2% SC),另一只眼滴加對照溶液(2% SC),每天4次,每次每只眼10 μl。角膜損傷0、12、24、36 h分別滴加熒光染液并拍照記錄兩只眼角膜損傷修復情況。待最后一次拍照結束后,處死動物。收取一部分大鼠兩只眼角膜最佳切削溫度化合物(optimal cutting temperature compound,OCT)包埋劑包埋,凍存于-80 ℃用于切片原位末端凋亡法(TdT-mediated dUTP nick-end labeling,TUNEL)實驗分析,一部分大鼠角膜上皮刮取之后直接-80 ℃凍存用于Western blot實驗。
1.5 大鼠角膜上皮TUNEL細胞凋亡分析-80 ℃保存的大鼠OCT角膜標本于冰凍切片機切出厚度5 μm組織切片。室溫干燥后用預冷的冰丙酮固定10~20 min; PBS洗滌2次,每次5 min,加入含0.1% TRIton X-100的PBS,冰浴孵育2 min;PBS洗滌3次,每次5 min;在樣品上加45 μl TUNEL檢測液,37 ℃避光孵育60 min;PBS洗滌3次,每次5 min;用抗熒光淬滅封片液封片后熒光顯微鏡下觀察并采集圖片。
1.6 大鼠角膜組織蛋白印記實驗分析凋亡蛋白表達-80 ℃保存的大鼠角膜上皮組織4 ℃、14 000 r/min離心15 min;加入蛋白裂解液冰上裂解30 min;4 ℃、14 000 r/min離心15 min取上清液,加入一定比例蛋白上樣緩沖液,沸水煮10 min。配制十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)凝膠,蛋白樣本于凝膠中運動,根據分子量大小不同,不同分子量蛋白跑至不同位置;后轉移至聚偏二氟乙烯膜(PVDF膜)上;5%脫脂奶粉室溫封閉2 h;含0.05%吐溫20的三乙醇胺緩沖鹽水溶液(tris buffered saline+0.05% Tween20,TBST)洗滌1次,三乙醇胺緩沖鹽水溶液(tris buffered saline ,TBS)洗1次,每次10 min;4 ℃一抗過夜;TBST洗滌3次,每次10 min;室溫孵育對應HRP標記二抗2 h,TBST洗滌3次,TBS洗1次;避光加發光劑后曝光并采集圖片。
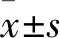
2 結果
2.1 ATRA促進大鼠角膜上皮損傷修復損傷后0、12、24、36 h分別拍照記錄大鼠角膜損傷修復情況。 通過大鼠角膜上皮損傷修復體內實驗模型,滴加含0.5 mmol/L ATRA滴眼液眼角膜損傷修復恢復率12、24、36 h分別為17.85%、53.25%、77.80%,對照(control,CT)組12、24、36 h恢復率分別為15.47%、45.59%、65.07%。見圖1。初步說明ATRA可促進大鼠角膜上皮損傷修復的進行。
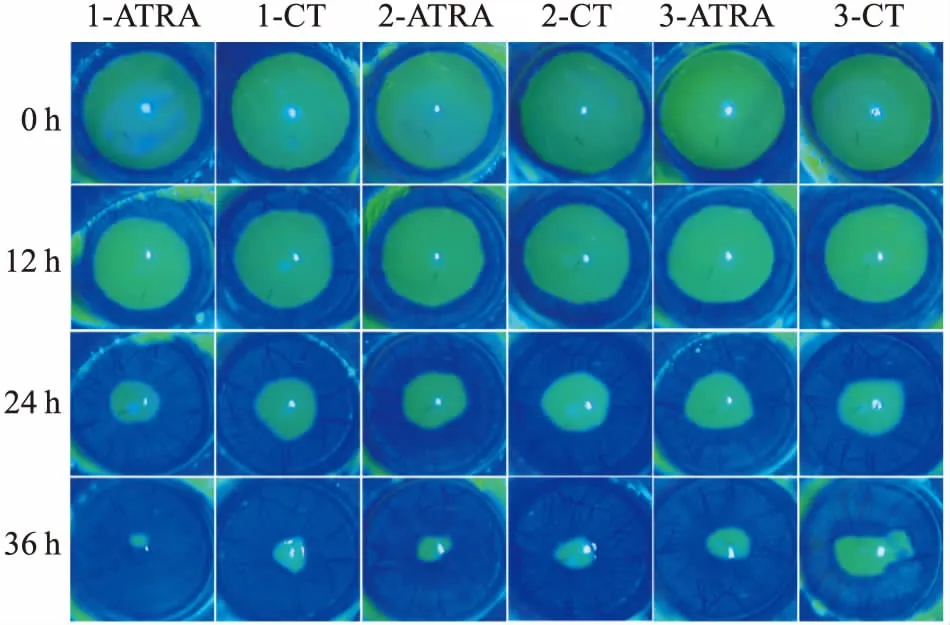
圖1 ATRA對大鼠角膜上皮損傷修復的影響1、2、3:大鼠編號
2.2 ATRA可抑制角膜上皮損傷修復過程中細胞凋亡的發生大鼠角膜組織TUNEL結果顯示,ATRA處理后角膜上皮細胞凋亡明顯少于CT組和空白組(角膜損傷0 h未處理直接取材角膜)。見圖2。
2.3 ATRA對角膜上皮組織細胞凋亡相關蛋白影響Western blot實驗結果顯示:與CT組比較,損傷修復之后,ATRA處理角膜上皮組織中促凋亡蛋白Bax表達量明顯下降(F=2.589E3,P<0.05),抗凋亡蛋白Bcl-2表達量明顯上調(F=4.808E3,P<0.05),Bcl-2/Bax比值ATRA處理后明顯增多(F=1.563E4,P<0.05)。見圖3。由此說明ATRA能抑制角膜上皮細胞凋亡的發生,從而對大鼠角膜損傷修復進程起促進作用。 同時Caspases家族蛋白表達結果顯示:ATRA處理后角膜上皮組織Caspases-9(F=2.334E3,P<0.05),Caspases-3(F=1.536E3,P<0.05)表達明顯降低,而其前體蛋白Procaspases-9(F=1.495E3,P<0.05), Procaspases-3(F=415.542,P<0.05)表達均高于CT組。 見圖4。
2.4 ATRA對角膜上皮組織MAPK通路相關蛋白影響ATRA處理后Western blot檢測MAPK通路蛋白結果顯示:p38磷酸化水平ATRA處理組均下調(F=1.350E3,P<0.05),見圖5。說明ATRA可能通過對MAPK通路蛋白活性的調節,從而對角膜上皮組織細胞凋亡起調控作用。
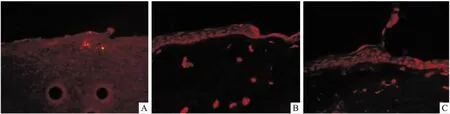
圖2 ATRA對角膜上皮組織凋亡影響 TUNEL染色×100
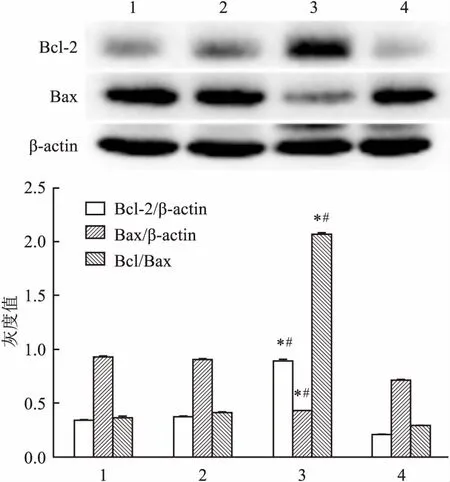
圖3 ATRA對角膜上皮組織凋亡相關蛋白Bax、Bcl-2表達的影響
1:未損傷ATRA處理角膜上皮;2:未損傷 CT角膜上皮;3:角膜損傷36 h ATRA處理角膜上皮;4:角膜損傷36 h CT角膜上皮;與未損傷組1比較:*P<0.05;與CT組4比較:#P<0.05
3 討論
角膜損傷修復是一個復雜的過程,該過程與多種因素密切相關。研究表明,晚期糖基化終末產物通過活性氧的形成從而延緩角膜損傷修復的速度[6],吸煙會延緩人角膜上皮損傷修復的速度[7],血鈣濃度過高,會延緩去卵巢大鼠角膜損傷修復的速度[8]。角膜傷口愈合是在多種眼部手術及眼部損傷例如眼部化學灼傷引起的眼外傷后獲得視力最佳恢復的必要臨床步驟。角膜上皮作為抵御外界病原體入侵的第一道屏障,角膜損傷可導致視力減退,嚴重者可使角膜脫落、穿孔,導致失明。加快角膜損傷修復可以盡可能降低這些威脅的發生。因此,對有效促進角膜上皮損傷修復的藥物機制的研究可以為臨床治療提供理論依據和研究方法。
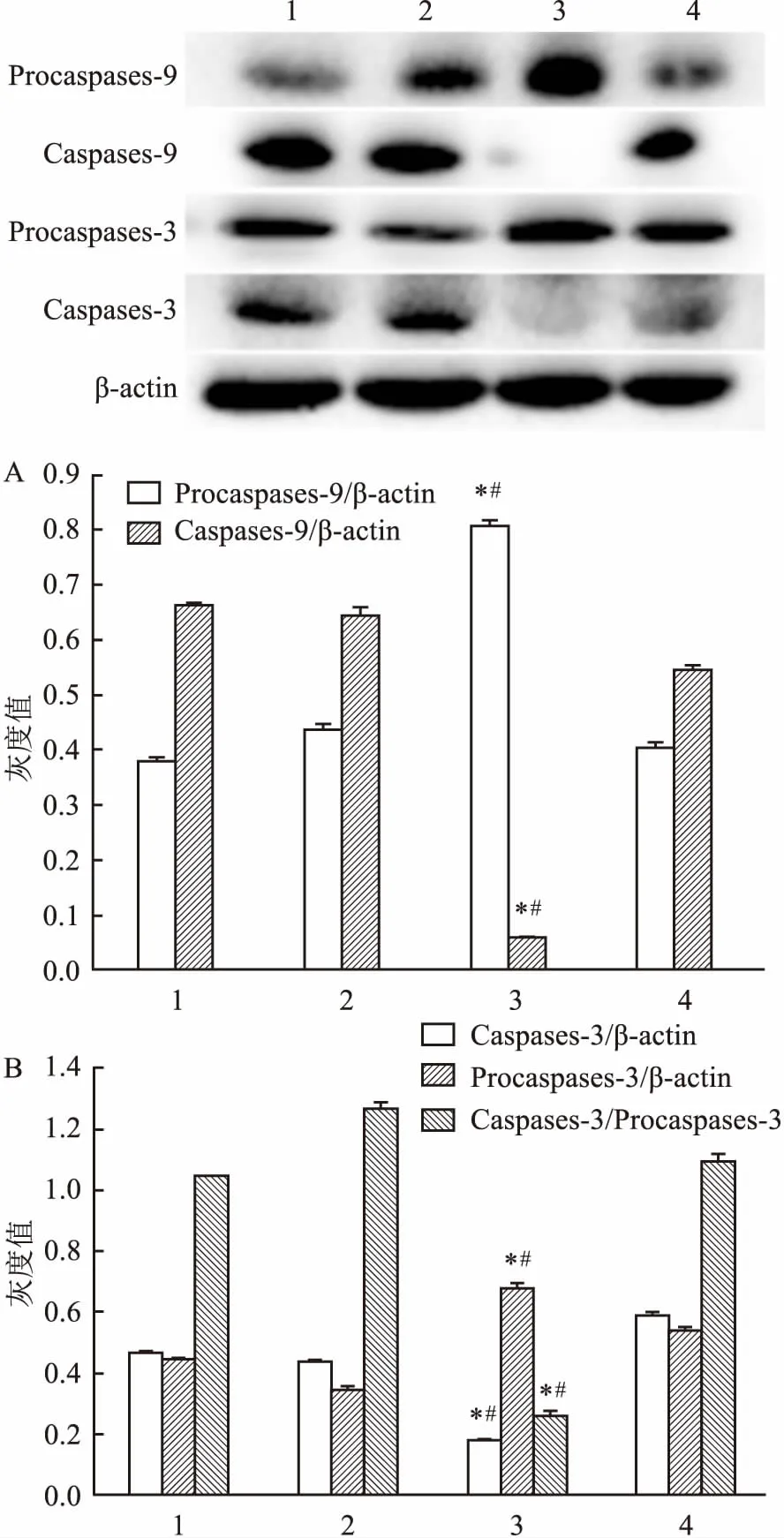
圖4 ATRA對角膜上皮組織凋亡蛋白Caspase相關蛋白表達的影響
A:Caspase-9、Procaspase-9表達條帶灰度值分析;B:Caspase-3、Procaspase-3表達條帶灰度值分析;1:未損傷 ATRA角膜上皮;2:未損傷 CT角膜上皮;3:角膜損傷36 h ATRA角膜上皮;4:角膜損傷36 h CT角膜上皮;與未損傷組1比較:*P<0.05;與CT組4比較:#P<0.05
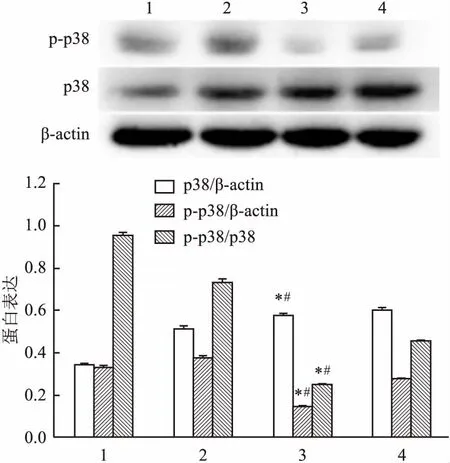
圖5 ATRA對角膜上皮組織MAPK通路蛋白表達的影響
1:未損傷 ATRA角膜上皮;2:未損傷 CT角膜上皮;3:角膜損傷36 hATRA角膜上皮;4:角膜損傷36 h CT角膜上皮;與未損傷組1比較:*P<0.05;與CT組4比較:#P<0.05
已知ATRA可以改善皮膚傷口的愈合[9]。研究[10-11]表明ATRA在眼形態發生和維持角膜完整性方面起著至關重要的作用,是角膜上皮細胞增殖和分化所必需的。大量研究[12]表明ATRA可促進角膜上皮愈合,這為ATRA用于眼科臨床試驗提供了很好的依據,但是ATRA促進角膜損傷修復的機制目前仍未見相關報導。本實驗結果顯示,含0.5 mmol/L ATRA的滴眼液處理損傷后大鼠角膜,能有效促進角膜愈合,且初步證明該過程可能與ATRA對角膜上皮損傷修復過程中細胞凋亡的調控相關,且可能與MAPK通路相關蛋白磷酸化水平的改變相關。
細胞凋亡是指由基因控制的細胞為更好地適應生存環境而主動爭取的一種死亡過程,即細胞的程序性死亡。該過程是多基因嚴格控制,這些基因包括Caspase家族、Bcl-2家族、癌基因、抑癌基因等,且彼此種屬之間非常保守。角膜組織切片TUNEL實驗提示,0.5 mmol/L ATRA處理后角膜上皮中凋亡細胞比例明顯減少。Western blot結果顯示,在角膜上皮組織中,ATRA處理后可有效抑制促凋亡蛋白Bax表達,同時上調抗凋亡蛋白Bcl-2,Bcl-2/Bax比值顯著增高。研究[13]表明Caspases尤其是Caspases-3 受Bcl-2/Bax調控,并在凋亡的執行中起關鍵作用。凋亡發生時,受凋亡信號刺激后,效應Caspases對凋亡程序的進行至關重要,然而該過程的活化需要起始Caspases對其前體進行切割。其中Caspases-3作為效應Caspases其活化需要上游Caspase-8、Caspases-9激活[14]。本實驗Western blot結果顯示ATRA作用下前體蛋白Procaspases-9、Procaspases-3降解明顯減少,從而抑制組織中Caspases-9表達,進一步抑制Caspases-3表達,最終抑制細胞凋亡的發生。
MAPKs信號途徑普遍存在于多種生物細胞中,參與調控細胞生長、發育、分化、凋亡等多種生理過程。主要包括p38MAPK、c-jun N末端激酶/應激活化蛋白激酶、細胞外信號調節激酶3種通路。其中p38MAPK通路參與多種細胞凋亡的調控。研究[15]顯示,ATRA可通過抑制p38磷酸化水平導致MAPK通路的下調,從而減少心肌細胞凋亡,有效預防心肌損傷。本實驗研究結果顯示,通過ATRA處理后,上皮組織中p38的磷酸化水平降低。提示ATRA對角膜上皮組織細胞凋亡的抑制作用可能與p38磷酸化水平的降低有關。
綜上所述,在大鼠角膜上皮損傷修復過程中,ATRA對上皮愈合的促進作用與ATRA對凋亡發生的抑制密切相關,且該作用可能與MAPK通路調控相關,通過對凋亡相關蛋白Bax、Bcl-2及Caspases-3的調控,從而抑制角膜上皮組織凋亡的發生,為深入研究角膜損傷修復的機制打下良好基礎,同時也為探討角膜病變的發病機制奠定基礎。

