胎盤絨毛CD81、HIF-1α、VEGF在早孕期復發性流產中的表達
余艷茹,許雅娟,翟閃閃,班彥杰,孫宗宗,張婧喆,張 淼,洪 騰,柳 蕊
1 材料與方法
1.1 病例資料選擇2017年1月~2018年1月就診于鄭州大學第三附屬醫院產科門診的RSA患者30例,同時篩選出30例同期正常早孕并要求終止妊娠的妊娠婦女。所有研究對象為漢族,年齡21~45(30.430±5.143)歲,孕周12周,孕前TORCH檢測無異常,無肝炎、人類免疫缺陷等病毒感染。本研究通過鄭州大學第三附屬醫院醫學倫理委員會批準,且所有研究對象簽署知情同意書。分組如下:RSA組:納入者均有≥2次的無誘因自然流產史,就診時B超確診胚胎停育。均排除胎兒染色體異常、生殖器官異常、生殖道感染、抗心磷脂抗體陽性、TORCH檢測結果示近期感染、甲狀腺功能異常、凝血功能異常、近期接觸過重金屬等毒物、近期生活中發生重大事件。正常早孕組:選擇同期因非計劃妊娠要求終止而就診的早孕正常婦女,本次妊娠就診時B超可見孕囊及原始心血管搏動,孕囊大小符合孕周,納入者既往至少有1次正常妊娠史(包括足月分娩和要求終止妊娠),且均無早產、死產等不良妊娠史。
1.2 方法
1.2.1標本采集與儲存 人工流產手術當日留取RSA組及正常早孕組婦女胎盤絨毛,將每個研究對象胎盤絨毛組織標本分為2部分,置于事先放有RNA store的凍存管和普通凍存管中,然后將凍存管迅速投入液氮中,再送至-80 ℃冰箱中保存。
1.2.2主要試劑 超純RNA提取試劑盒購自北京康為世紀生物科技公司;Prime ScriptTMRT reagent Kit with gDNA Eraser購自日本TaKaRa公司;QuantiNovaTMSYBR?Green PCR Kit 購自德國Qiagen公司;BCA蛋白濃度測定試劑盒購自上海碧云天生物技術公司;HRP標記羊抗小鼠二抗購自武漢博士德生物工程有限公司;顯影定影試劑盒購自天津漢中攝影材料廠。
1.2.3主要儀器 電泳儀電源(型號:DYY-7C)、垂直電泳槽(型號DYCZ-24DN)購自北京六一儀器廠;熒光定量PCR儀(型號QuantStudio3)、微量紫外線分光光度計(型號Nanodrop 2000)、酶標儀(型號mμlISKANMK3)購自美國Thermo公司;水平搖床(型號TS-1)購自江蘇海門其林貝爾儀器制造有限公司。
1.2.4實時熒光定量PCR(quantitative Real-time PCR,qRT-PCR)技術檢測胎盤絨毛CD81、HIF-1α、VEGF的mRNA表達 采用超純RNA提取試劑盒提取總RNA,用Nanodrop 2000微量紫外線分光光度計檢測RNA在260 nm、280 nm處的純度和濃度。Prime ScriptTMRT reagent Kit with gDNA Eraser(用來獲取cDNA,用QuantiNovaTMSYBR?Green PCR Kit 進行熒光定量PCR(qPCR),qPCR儀進行反應條件:95 ℃預變性2 min,繼而95 ℃變性5 s,60 ℃退火10 s,72 ℃延伸15 s,40個循環。以β-actin基因作為內參照,樣品目的mRNA的表達量采用2-ΔΔCt方法計算。以上操作嚴格按照試劑盒說明書操作。引物序列見表1。
1.2.5Western blot分析檢測胎盤絨毛CD81、HIF-1α、VEGF的蛋白表達 將絨毛組織加400 μl含苯甲基磺酰氟 (phenylmethanesulfonyl fluoride,PMSF)單去污劑裂解液裂于勻漿器中進行勻漿,然后置于冰上。PBS 洗滌,提取蛋白,12 000 r/min離心,吸取上清液備用。BCA法測量總蛋白濃度,蛋白樣品經SDS-PAGE凝膠電泳約2 h后轉膜,用含5%脫脂奶粉的TBST(封閉液)浸泡PVDF膜,用封閉液稀釋相應的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育過夜。然后使用封閉液稀釋相應的HRP標記二抗(1 ∶50 000稀釋),使PVDF膜浸泡于二抗孵育液中,37 ℃搖床孵育2 h,洗膜,ECL顯色,照相并分析結果。
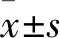
對馬克思宗教本質的認識,現有研究已經全然擺脫了“鴉片說”的簡單界定,充分認識到了馬克思對宗教的態度決不是簡單地否定,而是力圖在更為接近人的本真世界的高度上實現對宗教的揚棄。關于對馬克思宗教本質的認識除了共識性的“異化說”,還有“掌握說”和“生活說”。

表1 引物設計序列
2 結果
2.1 一般資料比較兩組女性的年齡、停經時間、孕次、產次、收縮壓、舒張壓、體質量指數(BMI)等一般資料分別比較,差異均無統計學意義(P>0.05)。見表2。

表2 兩組女性一般資料的比較
2.2 qPCR和Western blot分析CD81、HIF-1α、VEGF mRNA和蛋白的表達RSA組婦女絨毛組織中CD81 mRNA、HIF-1α mRNA、CD81蛋白、HIF-1α蛋白水平均高于正常早孕組,VEGF mRNA和蛋白水平低于正常早孕組,差異有統計學意義(P<0.05)。見圖1。

表3 ROC曲線分析CD81、HIF-1α、VEGF對RSA的預測價值

圖1 qPCR和Western blot法檢測CD81、HIF-1α、VEGF各因子mRNA和蛋白表達量
A:qPCR法分別檢測RSA組和正常早孕組CD81、HIF-1α、VEGF的mRNA表達量;B: Western blot法分別檢測CD81、HIF-1α、VEGF在RSA組和正常早孕組的蛋白表達量;與正常早孕組比較:*P<0.05
2.3 CD81、HIF-1α、VEGF在RSA中表達的相關性RSA組蛋白表達量中:VEGF與CD81呈負相關性(r=-0.415,P<0.05),與HIF-1α呈正相關性(r=0.560,P<0.05);RSA組mRNA表達量中:VEGF分別與CD81呈負相關性(r=-0.365,P<0.05),與HIF-1α呈正相關性(r=0.608,P<0.05)。正常早孕組間各指標無相關性(P>0.05)。
2.4 ROC曲線對RSA的預測價值
2.4.1ROC曲線分析CD81、HIF-1α、VEGF對RSA的預測價值 ROC曲線分析各預測因子ROC曲線下面積、95%CI、Z值、P值、Youden指數及預測的敏感性和特異性。見表3。
2.4.2CD81、HIF-1α、VEGF mRNA表達量及三者聯合預測RSA的價值 CD81、HIF-1α、VEGF表達量及三者聯合中預測RSA發生的ROC曲線見圖2A。比較CD81、HIF-1α、VEGF mRNA及三者聯合中任意兩組因子的面積之間的差異、95%CI、Z值、P值、凈重新分類指數(NRI)值,結果顯示: CD81、HIF-1α、VEGF mRNA表達量三者中任意兩因子預測RSA的效果無明顯差異(P>0.05),任一因子與三者聯合預測比較,均有統計學意義(P<0.05,NRI<0)。見表4。
2.4.3CD81、HIF-1α、VEGF蛋白表達量及三者聯合預測RSA的價值 CD81、HIF-1α、VEGF 蛋白表達量及三者聯合預測RSA的ROC曲線見圖2B。比較CD81、HIF-1α、VEGF 蛋白及三者聯合中任意兩組因子的面積之間差異、95%CI、Z值、P值、NRI值,結果顯示: CD81、HIF-1α、VEGF蛋白表達量三者中任意兩因子預測RSA的效果無明顯差異性(P>0.05),任一因子與三者聯合預測比較,均有統計學意義(P<0.05,NRI<0)。見表5。
2.4.4ROC曲線分析CD81、HIF-1α、VEGF mRNA聯合與CD81、HIF-1α、VEGF 蛋白聯合預測RSA的價值 CD81、HIF-1α、VEGF mRNA聯合與CD81、HIF-1α、VEGF 蛋白聯合預測RSA的ROC曲線見圖2C。

圖2 ROC 曲線分析CD81、HIF-1α、VEGF對RSA的預測價值
A:CD81、HIF-1α、VEGF mRNA表達量及三者表達量聯合預測RSA的ROC曲線;B:CD81、HIF-1α、VEGF 蛋白表達量及三者聯合預測RSA的ROC曲線;C:CD81、HIF-1α、VEGF mRNA與CD81、HIF-1α、VEGF蛋白聯合預測RSA的ROC曲線;o:Youden指數CD81、HIF-1α、VEGF mRNA聯合與CD81、HIF-1α、VEGF 蛋白聯合預測RSA的比較,兩者之間ROC曲線下面積差異為0.004,95%CI:-0.111~0.120,Z=0.075 6,P=0.939 7,說明兩種聯合預測的價值無差異性。

表4 CD81、HIF-1α、VEGF mRNA表達量及三者聯合預測RSA的價值比較

表5 CD81、HIF-1α、VEGF蛋白表達量及三者聯合預測RSA的價值比較
3 討論
3.1 CD81與RSA之間的關系CD81是四次跨膜蛋白,其在B細胞和T細胞突觸形成中起重要作用,并調節B淋巴細胞中CD19的表達,參與細胞生長、運動、信號轉導及骨髓歸巢[8]。有研究[9]表明CD81可通過依賴性Rac通路抑制促炎性介質釋放和激活細胞毒性T細胞或通過調節在血管發生中起重要作用的各種分子如VEGF進行免疫控制。此外,Jauniaux et al[6]發現導致流產的大多數妊娠被認為是胎盤有缺陷引起的,這與孕婦螺旋動脈未發生生理變化相關。RSA病因學研究[10]顯示RSA組織滋養層細胞增殖和遷移受到抑制,可減少血管生成。Shen et al[7]研究發現高表達CD81降低細胞滋養細胞的侵襲能力,可通過抑制滋養細胞的侵襲來影響子宮螺旋動脈重塑,從而導致胎盤淺著床。本研究中,RSA患者絨毛組織中CD81 mRNA和蛋白表達均高于正常早孕組,且RSA組CD81 mRNA和蛋白表達量均與VEGF呈負相關性,基于上述,推測高表達CD81可能抑制VEGF的表達,從而抑制血管再生。此外,高表達CD81可降低細胞滋養細胞的侵襲能力,從而可導致血管直徑顯著減小,參與RSA的發病。因此,CD81也可作為評估RSA發生的重要檢測指標。
3.2 VEGF與RSA之間的關系VEGF是內皮細胞的特異性促分裂原和存活因子,也是生理和病理條件下血管生成的主要介質[11]。VEGF作為血管生成的主要因素,越來越多的研究[12]表明血管形成和(或)功能異常在RSA的形成中發生重要作用。已有研究[13-14]表明,VEGF在妊娠初期的胚胎發育和生殖功能中參與生理性胎盤血管生成,并且與RSA發生和發展的多個步驟密切相關。先前的研究[15]表明,早期妊娠丟失與低表達VEGF相關,并且VEGF表達改變可能有助于RSA的發生。本研究中,RSA患者絨毛組織中VEGF mRNA和蛋白表達量均高于正常早孕組,與Plaisier et al[16]和對RSA病例的早期胎盤妊娠滋養層中VEGF的表達研究一致。提示VEGF可參與女性RSA的發病機制,絨毛組織中VEGF可作為一個預測流產發生的指標。
3.3 HIF-1α與RSA之間的關系HIF-1α是一種轉錄因子,通過結合低氧反應元件來調節對低氧的適應性轉錄反應。在常氧條件下,HIF-1α也能調節人絨毛滋養層細胞中基質膠誘導的血管內分化。低氧時,可通過誘導VEGF等血管生成相關基因的表達[17]。在妊娠早期,滋養層細胞的發育處于相對低氧的環境中,因此其適應低氧環境是成功妊娠的關鍵。如果過度低氧或合并炎癥發展,這種調節可能會受損,導致細胞存活和絨毛外滋養細胞分化失敗。這種失敗不僅在侵襲性方面,而且表現在血管內分化方面[18]。Fukushima et al[17]對HIF-1α在調節子宮內膜反應性EVT的血管內分化中的研究發現抑制HIF-1α上調可抑制低氧反應元件轉錄活性、VEGF誘導、ITGAV/ITGB3聚集等最終抑制血管形成。有研究[19]顯示HIF-1α在稽留流產中的表達量高于人工流產。本研究中,RSA患者絨毛組織中HIF-1α mRNA和蛋白表達量高于正常早孕組,與其研究結果一致。謝華 等[20]對小鼠持續低氧模型建立研究中發現低氧前4周HIF-1α表達水平增加,在低氧4周時達高峰,然后開始下降,低氧6周時的表達水平雖較前下降,但仍高于0周水平。本研究中RSA絨毛組織中HIF-1α表達高于正常早孕組,提示RSA絨毛組織處于低氧狀態。Pearson相關性分析顯示 HIF-1α mRNA和蛋白表達量與VEGF均呈正相關性,提示HIF-1α可能參與調控VEGF的表達。長期低氧時,雖然HIF-1α水平高于正常,但是可嚴重影響絨毛血管生成,進而導致RSA的發生。因此,絨毛組織中HIF-1α檢測可能成為評估自然流產發生風險的潛在工具。
成功的妊娠取決于足夠的絨毛血管生成,只有這樣才能提供充足的血供。對RSA新型生物標志物的發現不僅對RSA的診斷和臨床隨訪具有重要意義,而且對于確定新的治療策略也具有重要意義。本研究中對CD81、 VEGF 、HIF-1α mRNA及三者聯合進行ROC曲線分析顯示,CD81、VEGF、HIF-1α在預測RSA發生中無明顯差異性,但CD81、 VEGF 、HIF-1α三者聯合在預測RSA發生中優于任一單一因子。因此,單個預測因子診斷RSA的預測價值較聯合預測RSA的價值低,說明RSA的病因與多個因子有關,單個因子預測RSA的發生,準確性較低。此外,絨毛組織中CD81、 VEGF 及HIF-1α對妊娠結局的預測價值尚需進一步的大樣本量研究來證實。
綜上, RSA 的發生和CD81、 VEGF 及HIF-1α 的異常表達相關,當機體正常的胎盤血管網絡形成受阻時,易影響胚胎著床,進而導致流產的發生;另一方面,關于 CD81、HIF-1α、VEGF在 RSA 中的作用機制,本實驗未進行相關研究,此為本實驗的局限性。本研究將在此基礎上,通過進一步的功能調控性實驗探索上述各細胞因子在 RSA 中的具體作用機制,為臨床治療提供新的視角。

