龍膽苦苷對人上皮性卵巢癌細胞增殖、凋亡、遷移的影響及機制
高天勤,李欣,董圣軍,程春雷,史榮軍,賈龍,王健,劉寶輝
(1濱州醫學院附屬醫院,山東濱州256603;2濱州市人民醫院;3山東省食品藥品檢驗研究院;4陽信縣人民醫院)
卵巢癌是女性生殖系統常見的惡性腫瘤之一,病死率居婦科惡性腫瘤的首位[1]。化療是目前治療卵巢癌的主要方案,但卵巢癌對化療藥物的耐藥及癌細胞較強的遷移能力是治療中急需解決的難題。近年來,傳統中藥因來源廣泛、不良反應少、應用安全及缺乏耐藥性等優點越來越到關注。龍膽苦苷(GPS)是龍膽科龍膽屬植物龍膽的主要有效成分,大量臨床及實驗研究發現,龍膽苦苷不僅有抗炎止痛[2]、保肝利膽[3]的作用,還具有拮抗腫瘤的作用[4]。但GPS對卵巢癌細胞增殖、遷移等的作用及機制尚未有報道。2018年1~5月,我們觀察了GPS對人上皮性卵巢癌HO8910細胞增殖、凋亡及遷移能力的影響,并探討其機制,為GPS抗卵巢癌提供實驗依據。
1 材料與方法
1.1 細胞、材料及儀器 人上皮性卵巢癌HO8910細胞由濱州醫學院中心實驗室提供。4′,6-二脒基-2-苯基吲哚(DAPI)、噻唑藍(MTT)購買于美國Sigma-Aldrich公司;鼠源抗鼠凋亡蛋白B細胞白血病淋巴瘤相關蛋白(Bax)、P38絲裂原活化蛋白激酶(P38MAPK)、p-P38 MAPK、B淋巴細胞/白血病-2(Bcl-2)抗體及β-actin均購自美國Cell Signaling公司;原位末端轉移酶標記(TUNEL)檢測試劑盒購自美國Santa Cruz公司;辣根過氧化物酶標記羊抗兔或鼠IgG購自北京中杉金橋生物技術有限公司;二喹啉甲酸(BCA)×100蛋白質定量測定試劑盒、組織裂解蛋白提取液、蛋白酶抑制劑購自上海碧云天生物技術公司;酶標儀購自美國Biotech公司;CO2細胞培養箱購自美國Thermo公司;熒光顯微鏡購自日本Olympus公司;電泳、濕轉移槽及Western blotting發光照相系統購自美國Rio-Red公司。
1.2 細胞分組及干預 人上皮性卵巢癌HO8910細胞用10%胎牛血清的DMEM細胞培養液,于37 ℃、5%CO2的細胞培養箱內培養2~3 d。培養至細胞貼壁融合。加入0.25%胰蛋白酶進行消化并輕輕吹打將已貼壁的細胞,直至鏡下觀察細胞收縮至變圓,加入培養液以終止胰蛋白酶的作用。將脫落分離下的細胞吹打均勻后按1×108/L接種于培養板或培養瓶中。待細胞融合后,換用無血清的DMEM培養液培養4 h,使細胞同步化后將細胞隨機分為對照組、GPS低劑量組、GPS中劑量組、GPS高劑量組。對照組單純加入0.01% DMSO培養48 h;GPS低、中、高劑量組分別在加入10、20與40 μmol/L GPS的DMEM培養液中培養48 h,GPS用DMSO預溶,并用MEM培養液稀釋至相應濃度。
1.3 各組細胞增殖能力觀察 采用MTT法。待細胞干預結束后,棄細胞培養液,沖洗后加入DMEM培養液(100 μL)和含0.5%MTT的培養液(10 μL),37 ℃無菌CO2培養箱內孵育4 h后,再次棄培養液,并加入100 μL的DMSO原液,振蕩10 min后,用酶標儀計于490 nm波長處測定吸光度(A)值,并重復上述實驗3次。增殖抑制率=[(對照組OD值-各組實驗組OD值)/(對照組OD值-空白組OD值)]×100%。
1.4 各組細胞凋亡情況觀察 采用TUNEL實驗。各組細胞經4%的多聚甲醛固定1 h后,根據該實驗試劑盒所述的雙重染色法,TUNEL檢測液可沾染到凋亡細胞的細胞核,鏡下呈綠色,DAPI可沾染到所有凋亡和未凋亡的細胞核,鏡下呈藍色。每組細胞隨即在熒光顯微鏡下選擇5個視野并觀察計數。細胞凋亡率=凋亡細胞/所有細胞×100%。
1.5 各組細胞遷移能力觀察 采用細胞劃痕實驗。實驗步驟依據參考文獻[5]。將混勻的血管內皮細胞以5×105/mL均勻種于6孔板內,并鋪滿整個孔板。各組給予上述相應處理后,以P200移液器槍頭垂至于6孔板劃出三條平行的“損傷”。用PBS洗細胞3次,去處劃下的細胞,加入5%胎牛血清培養基后,放入37 ℃、5% CO2培養箱培養8 h。運用倒置相差顯微鏡對遷移的各組細胞進行拍照,并計算出劃痕上下界限之間距離的平均值。對照組設定為100%,計算細胞遷移率。
1.6 各組細胞內p-P38 MAPK、凋亡相關蛋白表達檢測 采用Western blotting法檢測p-P38 MAPK、促凋亡蛋白Bax、抗凋亡蛋白Bcl-2的表達。待細胞干預結束后,棄細胞培養液,充分沖洗后加入細胞裂解液裂解細胞,收集細胞裂解物,對各組蛋白總量進定量。取20 μL總蛋白在1×十二烷基硫酸鈉(SDS)緩沖液中煮沸8 min。當蛋白充分變性充分后,用SDS-聚丙烯酰胺凝膠電泳(PAGE)并電轉移至硝酸纖維素膜上,硝酸纖維素膜用含50 g/L脫脂奶粉的TBST室溫封閉1 h。然后依次滴加p-P38 MAPK、P38 MAPK、Bax、Bcl-2和β-actin抗體(1∶1 000稀釋),4 ℃過夜后TBST洗滌3次,每次10 min,然后用1∶5 000的辣根過氧化物酶(HRP)-羊抗兔或鼠IgG孵育2 h,然后用TBST洗滌3次,最后用增強化學發光(ECL)發光液進行曝光顯影,Bio-Rad照相系統進行照相并用其附帶的軟件分析蛋白的相對表達量。對照組設置為100%。
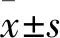
2 結果
2.1 各組細胞增殖抑制率、凋亡率及遷移率比較 與對照組相比,GPS中劑量組、GPS高劑量組細胞增殖抑制率、遷移率均降低,凋亡率均升高(P<0.05或0.01);且GPS高劑量組細胞增殖抑制率、遷移率均低于GPS中劑量組,凋亡率高于GPS中劑量組(P均<0.05)。見表1。
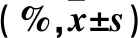
表1 各組細胞增殖抑制率、凋亡率及遷移率比較
注:與對照組比較,*P<0.05,△P<0.01;與GPS中劑量組比較,#P<0.05。
2.2 各組細胞內Bax、Bcl-2及p-P38 MAPK蛋白表達比較 與對照組相比,GPS中劑量組、GPS高劑量組細胞內Bax、p-P38 MAPK表達上調,Bcl-2表達下調(P<0.05或0.01),且GPS高劑量組細胞內Bax、p-P38 MAPK表達均高于GPS中劑量組,Bcl-2表達低于GPS中劑量組(P<0.05)。見表2。
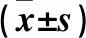
表2 各組細胞Bax、Bcl-2及p-P38 MAPK表達比較
注:與對照組比較,*P<0.05,△P<0.01;與GPS中劑量組比較,#P<0.05。
3 討論
卵巢癌因其起病隱匿,缺乏早期診療指標,易早期出現浸潤、轉移及等原因,病死率位居婦科惡性腫瘤首位[1, 6]。雖然目前對卵巢癌的診療取得了一定的進展,但患者的5年病死率仍在25%~30%[7]。目前臨床上用于治療卵巢癌的藥物不良反應大,且易產生耐藥性[8]。因此,尋找新的對卵巢癌細胞敏感、且具有更少不良反應及耐藥性的藥物,是降低卵巢癌患者病死率、改善預后的關鍵。
GPS屬于裂環環烯醚萜苷類化合物,是龍膽屬植物的主要藥效成分之一。除了有抗炎止痛[2]、保肝利膽[3]、保護心肌[9]等作用外,在最近的研究發現,從龍膽中分離獲得的乙醇提取物具有抑制小鼠肉瘤、早幼粒細胞性白細胞及肺癌等多種腫瘤細胞的增殖作用[4,10]。趙忠偉等[11]研究發現,GPS能夠肝癌細胞的增殖,其具體機制為使肝癌細胞的G0/G1細胞增多,改變肝癌細胞的周期,同時可以誘導肝癌細胞發生凋亡。但GPS對卵巢癌細胞增殖、遷移的影響尚未有報道。本研究發現,與對照組相比,GPS中劑量組、GPS高劑量組細胞增殖抑制率、遷移率均降低,凋亡率均升高,提示GPS可抑制人上皮性卵巢癌細胞的增殖及遷移,并促進其凋亡;GPS高劑量組細胞增殖抑制率、遷移率均低于GPS中劑量組,凋亡率高于GPS中劑量組,提示GPS較高時作用更明顯。
P38 MAPK是細胞內MAPK之一,P38 MAPK信號通路在許多腫瘤組織中呈持續激活狀態,腫瘤細胞中P38 MAPK可影響到下游細胞周期調節蛋白及凋亡相關蛋白等效應分子的活性[12]。P38 MAPK激活的性質決定P38 MAPK信號通路促進還是抑制細胞凋亡[13]。例如P38 MAPK可通過改變Bcl-2的構象使其抗凋亡活性降低,從而抑制Bax/Bcl-2二聚體的形成,誘導癌細胞凋亡[14]。本研究發現,與對照組相比,GPS中劑量組、GPS高劑量組細胞內p-P38 MAPK表達上調,且GPS高劑量組細胞內p-P38 MAPK表達高于GPS中劑量組,提示GPS可抑制人上皮性卵巢癌細胞的增殖及遷移,并促進其凋亡的作用可能與激活P38 MAPK信號通路,進而抑制Bax/Bcl-2等相關細胞凋亡途徑而實現。
Bax是一種線粒體蛋白,位于細胞的胞質當中,通常以單體形式存在,當細胞過氧化損傷時Bax可以與線粒體膜相互結合形成復合體,促使凋亡因子從線粒體中釋放出來,從而啟動凋亡,加重組織損傷。Bcl-2屬于一種抗凋亡蛋白,可以抑制凋亡因子的釋放,從而減少超氧陰離子。同時Bcl-2還可以與Bax聚合,抑制Bcl-2從而抑制細胞凋亡[15]。本研究發現,與對照組相比,與對照組相比,GPS中劑量組、GPS高劑量組細胞內Bax表達上調,而Bcl-2表達下調,表明GPS可能通過Bax/Bcl-2信號通絡導致細胞凋亡。
綜上,GPS具有抑制人上皮性卵巢HO8910細胞增殖、遷移并促進其凋亡的作用,其作用機制可能通過P38 MAPK信號通路,進而上調凋亡蛋白Bax、下調抗凋亡蛋白Bcl-2,誘導HO8910細胞凋亡。但具體的作用機制需應用P38 MAPK信號通路特異性抑制劑SB203580干預進一步證實。

